CLINICAL STUDIES / ETUDES CLINIQUES
LES ADÉNOMES HYPOPHYSAIRES CLINIQUEMENT NON-FONCTIONNELS : PEUVENT-ILS ETRE DIAGNOSTIQUES PLUS TOT ?
NON-FUNCTIONING PITUITARY ADENOMAS : A PLEA FOR AN EARLIER DIAGNOSIS
- Service de neurochirurgie du CHU d’Abidjan Yopougon
RESUME
Introduction
Les adénomes pituitaires « silencieux » n’entraînent pas de tableau en rapport avec une hypersécrétion hormonale. Ils posent un problème de diagnostic tardif au stade des complications comprimant les voies visuelles. Le but de ce travail est de permettre un diagnostic précoce en dégageant un profil clinique et biologique de ces adenomes.
Matériels et méthodes
44 dossiers de malades opérés entre 1994 et 2005, tous des macroadénomes de plusieurs types histochimiques, ont été analysés au plan clinique : Le sexe, le status gynéco-obstétrique, l’âge, le délai diagnostic, les circonstances de découverte, le tableau clinique ont été notés. Le dosage de base des gonadotrophines ainsi que les tests dynamiques aux GnRH et TRH ont ete etudies separement chez les hommes, les femmes menopausees, et celles en periode d’activite genitale. L’anatomopathologie et l’immunohistochimie ont ete realisees. La loi des moyennes a été utilisée
Résultats
28 hommes (63,6%) et 16 femmes (36,4%) dont 10 ménopausées. L’âge moyen était de 58 ans et demi, le délai diagnostic moyen était de 9 mois et demi.
Le syndrome tumoral était au premier plan (86,4%) avec des troubles visuels dans tous les cas (100%), dominés par les anomalies campimétriques.
Les signes cliniques d’hypopituitarisme (41%) qui sont en rapport avec la compression/destruction de l’hypophyse saine par la tumeur predominaient sur ceux d’hypersécrétion de gonadotrophines (9,1%) vus essentiellement dans les adénomes gonadotropes. Le bilan hypophysaire montrait des insuffisances antehypophysaires (IAH) chez plus de 60% des patients, surtout gonadotropes, dans tous les groupes. L’hyperprolactinemie variait de 41 a 89% mais toujours inferieure a 150 ng/ml. A l’immunohistochimie les adenomes gonadotropes etaient les plus nombreux (81,8%) suivis des non-secretants vrais (11%), des corticotropes (4,5%) et d’un plurisecretant (2,3%)
Conclusion
Le tableau clinique évocateur est exceptionnel ; il faut donc, par une analyse plus fine, retrouver ces signes au début, qui sont pourtant perçus à posteriori à l’interrogatoire, par un examen rigoureux et faire ainsi realiser un bilan hypophysaire qui montrerait une IAH gonadotrope et une hyperprolactinemie moderee. Le dosage des sous-unites α et β devra etre realise. Les tests dynamiques et de freinage devront etre faits exceptionellement en cas de doute, voire supprimes. L’interprétation reste cependant difficile chez la femme ménopausée.
Mots-clés : adénome hypophysaire gonadotrope, diagnostic
SUMMARY
Introduction
Clinically silent pituitary adenomas are not diagnosed because of hormonal hypersecretion. They are detected late when the optic pathway is compressed. The objective of this work is to define clinical and biological profile which will allow an early diagnosis.
Material and methods
44 files of patients operated on between 1994 and 2005 were analyzed. They all had macroadenomas of different histochemical types. Sex, gynecological and obstetrical history, age, delay before diagnosis, circumstances of diagnosis and clinical data were obtained in each case. Basic gonadotrophins level, GnRH and TRH dynamical tests were separately performed in men, sexually active women and women in menopause. Histopathology and immunohistochemistry studies were performed.
Results
the series comprised 28 men(63.6%) and 16 women (36.4%) (10 of them were in menopause). Mean age was 58.5 years and diagnostic delay was 9.5 months. Tumoral syndrome was present in 86.4 % of cases, all the patients had visual impairment, mainly visual’s field amputation or restriction. Hypopituitarism syndrome was present (41 %) according to the degree of compression or destruction of the normal pituitary gland by the tumor, except for gonadotrophic hypersecretion signs (9.1%).
Hormonal dosage showed more than 60% of pituitary gland insufficiency in all three groups, particularly the gonadotrophic one. Moderate prolactin hypersecretion was found in 41 to 89% of cases, but the absolute value was always less than 150 ng/ml
At histoimmunochemistry, gonadotroph cell adenomas predominate (81.8%), followed by the real non-secreting one(11%), then corticotroph (4.5%) and lastly the multi-secreting adenomas (2.3%)
Conclusion
The clinical syndrome of non secretory pituitary adenoma is not clearly defined. Practitionners need to identify early these symptoms, which were actually present from the beginning of the clinical history, by a meticulous examination. If patient presents cephalalgia and visual impairment, cerebral CT scan or MRI explorations are mandatory to explore the presence of a pituitary tumor. In case of non-functioning pituitary adenoma, basic endocrine exploration should find a hypopituitarism, mainly gonadotropic, with a moderate prolactin hypersecretion. The dosage of α and β subunits must be done. Dynamic tests should be performed only in case of difficulty. Analysis is difficult in menopausal women
Mots-clés : diagnosis , gonadothropin pituitary adenoma, non secreting adenomas, pituitary tumor
INTRODUCTION
Les adénomes cliniquement non-fonctionnels ou silencieux sont des tumeurs glandulaires de l’hypophyse, n’entraînant pas de tableau clinique en rapport avec une hypersécrétion. Pendant longtemps, ils étaient considérés comme des lésions ne produisant aucune hormone. Les progrès de l’immunohistochimie ont permis de montrer qu’une grande partie d’entre eux sécrétait des gonadotrophines. Ils posent tous un problème de diagnostic, car révélés tardivement au stade de macroadénomes (figure 1) avec un syndrome tumoral en particulier une compression des voies visuelles .Le but de ce travail est de permettre un diagnostic clinique précoce pour une meilleure prise en charge.
MATERIELS ET METHODES
Une étude rétrospective de 1994 à 2005 a été réalisée sur 44 dossiers exploitables de patients opérés d’adénome hypophysaire « silencieux »
L’identité, le sexe, le status gynéco-obstétrical, l’âge de découverte de l’adénome, le délai diagnostic ainsi que le délai préopératoire et le tableau clinique avec les circonstances de découvertes ont été relevés.
Le bilan hormonal hypophysaire préopératoire a été étudié. Les sécrétions de base ont été classées selon qu’elles étaient augmentées, normales ou diminuées, et les insuffisances des différents axes antéhypophysaires ont été relevées. Au niveau des tests dynamiques, la réactivité a été notée quand l’élévation des taux de base était d’au moins 25% pour la FSH et de 20% pour la LH, après administration aigué de GnRH et TRH. L’anatomopathologie et l’immunohistochimie ont été réalisés.
RESULTATS
Sur les 44 patients, il y avait 28 hommes (63,7%) et 16 femmes (36,4%), dont 10 ménopausées (62,5%) et 6 en période d’activité génitale (37,5%).
Les patients ont été suivis pendant une durée moyenne de 40 mois
L’âge moyen de découverte de la lésion était de 58 ans et demi, allant de 23 à 83 ans.
La répartition des tranches d’âge de découverte de l’adénome se trouve dans le tableau I.
Le délai moyen entre les premières manifestations cliniques et le diagnostic était de 9 mois et demi (allant de 0 à 120) ; il est stratifié dans le tableau II. Sur les 8 patients ayant un délai diagnostic inférieur à 1 mois, 6 (75%) ont eu une découverte fortuite à l’occasion d’un bilan d’imagerie pour une autre symptomatologie, 1 a été diagnostiqué lors d’une apoplexie sans signe préexistant et 1 a eu des troubles oculomoteurs rapidement évolutifs.
La symptomatologie était dominée par le syndrome tumoral, présent 38 fois sur 44 (86,5%).
- Tous ces patients (100%) ayant un syndrome tumoral avaient des troubles visuels :
– La baisse de l’acuité visuelle était retrouvée dans 36 cas/ 38 (95%).
– Les anomalies du champ visuel étaient observés chez 29/38 patients (66% de tous les patients, 76% des patients avec atteinte visuelle) :
– Hémianopsie bitemporale : 15 cas.
– Quadranopsie temporale supérieure : 10 cas .
– Elargissement de la tâche aveugle : 8 cas.
– Des paralysies oculomotrices ont été observée sdans 6 cas, diversement associés:
Atteinte du III : 5 cas.
Atteinte du IV : 0 cas.
Atteinte du VI : 4 cas.
- Les céphalées étaient présentes 24 fois sur 38 (63%)
Les signes endocriniens étaient dominés par les tableaux d’hypopituitarisme chez 18 patients (41%),13 hommes et 5 femmes.
– Asthénie : 14 cas.
– Troubles sexuels : 10 cas
– Troubles trophiques : 5 cas
– Troubles menstruels : 3 cas
– Galactorrhée : 2 cas spontanés.
Concernant les signes d’hypersécrétion de gonadotrophines, 4 patients avaient des bouffées de chaleur (9,1%), tous porteurs d’adénomes gonadotropes. Il n’a pas été noté de puberté précoce, ni d’hypertrophie des organes génitaux.
BIOLOGIE PRE-OPERATOIRE
Le bilan endocrinien a été étudié chez l’homme, chez la femme ménopausée et la femme en période d’activité génitale :
A/ Chez l’homme
L’insuffisance antéhypophysaire était retrouvée chez 17 patients des 27 contrôlés :
– insuffisance gonadotrope (gonado) : 17 patients (63 %) dont 14 adénomes gonadotropes.
– insuffisances corticotrope (cortico) : 10 cas sur 27 (37%)
– insuffisance thyréotrope (thyréo) : 8 cas sur 27 (29,7)
La classsification histologique est la suivante :
– Gonado + Cortico + Thyréo : 5
– Gonado + Cortico : 5
– Gonado + Thyréo : 3
– Gonado isolée : 4
La prolactinémie était augmentée dans 11 cas (41 %) mais constamment inférieure à 150 ng/ml, et normale dans 16 cas (59%).
Les tableaux III-a et III-b montrent les dosages basals de gonadotrophines et les tests dynamiques chez les adénomes gonadotropes, et chez les autres adénomes non-fonctionnels .
B/ Chez la femme ménopausée
.L’insuffisance antéhypophysaire était retrouvée chez 7 patientes sur les 9 contrôlées (78%), tous des adénomes gonadotropes :
– insuffisance gonadotrope : 7 patientes
– insuffisances corticotrope et thyréotrope : 2 cas sur 9 chacun (22%).
La classification histologique est la suivante :
– Gonado + Cortico : 2
– Goando + Thyréo : 2
– Gonado isolée : 3
Il y avait une hyperprolactinémie chez 8 patientes sur 9 (89%) , inférieure à 150 ng/ml .
Les tableaux IV-a et IV-b montrent les dosages de base de gonadotrophines et les tests dynamiques chez ces femmes ménopausees
C/ chez la femme en période d’activité génitale
L’insuffisance antéhypophysaire était retrouvée chez 4 patientes des 5 contrôlées (80%) , dont 1 adénome gonadotrope :
– insuffisance gonadotrope : 4 patients
– insuffisances corticotrope et thyréotrope : 1 cas correspondant à un panhypopituitarisme.
La classification histologique est la suivante :
– Gonado+ Cortico+Thyréo : 1
– Gonado isolée : 3
La prolactinémie était élevée dans 3 cas / 5 (60%) et normale dans 2 cas (toujours inferieure a 150 ng/ml).
Les tableaux V-a et V-b montrent les dosages de gonadotrophines et les tests dynamiques chez ces femmes en periode d’activite genitale.
Cas particuliers : 2 patients ont une inversion du rapport FSH/LH, normalement >1. Il s’agit d’un homme de 83 ans opéré d’un adénome non-sécrétant et d’une femme de 42 ans opérée d’un adénome corticotrope silencieux, qui ont des chiffres dans la fourchette des valeurs normales.
ANATOMOPATHOLOGIE
La répartition des adénomes était la suivante :
– gonadotrope : 36(81,8%) dont
*FSH : 4 (11,1%)
*FSH : 6 (16,7%)
*Sous-unité – α pur : 1 (2,8%)
– non-sécrétant :5 (11,4%)
– corticotrope : 2 (4,5%)
– plurisécrétant : 1 (2,3%) (FSH,PRL,TSH)
DISCUSSION
Les adénomes hypohysaires, quel qu’en soit le type sont rares. La prévalence des lésions intrasellaires dans la population générale est de 6 à 10 % essentiellement des microdénomes (1). Une étude milanaise (Italie) montrait une prévalence de 199 adénomes hypophysaires par million d’habitants (0,02%) et une incidence annuelle de 15,5 par million; 23% de ces adénomes étaient non-fonctionnels et étaient des macroadénomes dans leur quasi-totalité (in 2). La prévalence des adénomes gonadotropes au sein des adénomes opérés a été mieux appréciée grâce à l’amélioration des techniques immunicytochimiques. Elle se situe après les prolactinomes et les adénomes somatropes, au même niveau ou juste après les adénomes corticotropes ; ils représentent 15 à 20% des adénomes hypohysaires (1).
Le diagnostic est porté entre 50 et 80 ans surtout, ce qui serait dû à l’évolution silencieuse de cette pathologie ne se révélant que par le syndrome tumoral. L’hypersécrétion de gonadotrophines – quand il s’agit d’adénomes gonadotropes – n’étant pas responsable de manifestation clinique caractéristique, sans conséquence hormonale, et sans hypersécrétion prouvée, a pour conséquence une abstention chirurgicale et une surveillance. (1)
L’âge de découverte varie entre la 4ème et le 5ème décennie pour certains auteurs ou entre 45 et 55 ans pour d’autres (1), témoin de la lenteur d’évolution et de la pauvreté des signes. Un cas a été diagnostiqué à l’âge de 4 ans par une puberté précoce (18). Notre étude a observé une moyenne d’âge de 58 ans et demi, légèrement supérieure à la littérature. Cela pourrait s’expliquer par une tolérance des anomalies campimétriques chez nos patients ou seraient simplement dû au hasard.
Notre travail constatait une prédominance masculine tout comme Waterlot (18) et Chanson (3) qui donnent un sex ratio de 2/1. Chez la femme, elle survient pour la majeure partie après la ménopause (4,12).
Les adénomes non-fonctionnels ont exceptionnellementun tableau clinique caractéristique : les signes cliniques n’apparaissent que lorsque la lésion atteint le chiasma (figure 2) témoin d’un syndrome tumoral et/ ou lorsqu’elle perturbe significativement la synthèse des hormones hypophysaires normales entraînant un hypotituitarisme (18) : Le diagnostic est alors posé au stade des complications.
Le syndrome tumoral représente la circonstance de découverte la plus fréquemment retrouvée dans la littérature (1), allant de 44 à 84 %. L’atteinte du champ visuel due à une compression du chiasma optique par un macroadénome est présente dans 40 à 70% (1,18) ; il est le 1er motif de consultation et est souvent négligé au début par le patient et par l’ophtalmologiste, non de manière exceptionnelle. La baisse de l’acuité visuelle, même si elle n’est pas clairement individualisée dans les études est fréquemment retrouvée.
Les troubles de l’oculomotricité sont quasi-exclusivement retrouvés dans les tableaux d’apoplexie pituitaire (1,14) ; notre travail a relevé 2 cas de paralysie oculomotrice sans apoplexie ; dans 1 cas, il y avait un envahissement du sinus caverneux.
Dans notre série, la baisse de l’activité visuelle prédominait sur l’atteinte du champ visuel, peut être due à une négligence de certaines amputations du champ visuel, non-détectées par le malade, ni par le médecin.
Les céphalées s’associent fréquemment aux troubles visuels dans le syndrome tumoral (18).
L’hypersécrétion de gonadotrophines (adénome gonadotrope) est rarement responsable de signes cliniques. Elle entraîne des bouffés de chaleur, une puberté précoce comme il a été rapporté chez un garçon de 4 ans porteur d’un adénome mixte prolactine- FSH-LH.(1,18). Chez l’homme, une augmentation du volume testiculaire, une polyzoospermie ou une gynécomastie, peuvent être exceptionnellement retrouvés. Un volume testiculaire normal avec une élévation de la FSH doit faire éliminer un hypogonadisme périphérique. Chez la femme en période d’activité génitale, une hyperstimulation ovarienne avec hyperplasie endométriale, ovaires polykystiques et hyperoestradiolémie en dehors de tout traitement hormonal a été rapportée chez des femmes (8,11,13) ayant un adénome à FSH : il faut alors évoquer le diagnostic. Chez la femme ménopausée – il faut rappeler que la plupart des adénomes gonadotropes surviennent après la ménopause – l’interprétation clinique reste difficile. (1,18). Dans notre série, le peu de patients présentant des signes cliniques d’hypersécrétion de gonadotrophines confirme le caractère paucisymptomatique des adénomes gonadotropes. Ces signes mérites d’être recherchés avec plus de rigueur par les ophtalmologues et les autres praticiens, permettant peut être de déceler plus tôt une partie de ces adénomes.
Le tableau d’insuffisance antéhypophysaire est plus fréquemment retrouvé que l’hypersécrétion de gonadotrophines dans les adénomes non-fonctionnels. Il est en rapport avec la compression ou la destruction de l’hypophyse saine par la tumeur entraînant une hyponatrémie, une asthénie, des troubles trophiques … Chez l’homme, il peut y avoir des troubles de la libido voire une impuissance dans 25% à 50% des cas. Chez la femme en activité génitale, des troubles menstruels avec infertilité peuvent être retrouvés : 1 cas dans notre série avec grossesse post-chirurgie. L’aménorrhée représenterait 1/5 des circonstances de découverte. A noter que la fertilité peut ne pas être affectée. Ces signes évoluent plusieurs mois avant le diagnostic, et sont souvent reconnus a posterioi par le praticien. Ils doivent être recherchés constamment.
A noter la découverte fortuite de l’adénome, qui représente 15% de la série de l’Hôpital Bicêtre (2). Fainstein Day trouve également 4 a 27% à l’autopsie et 10 à 37 % à l’imagerie.(7), chiffres proches de notre étude, ce qui témoigne de leur sous-estimation.
BIOLOGIE
A/ CHEZ L’HOMME
Evaluation des fonctions hypophysaires
Dans 75% environ de ces macroadénomes, il existe une insuffisance antéhypophysiare (IAH), généralement gonadotrope ; les fonctions corticotropes et thyréotropes sont variablement altérées d’une série à l’autre. Environ 37 à 60 % des adénomes gonadotropes sont silencieux chez l’homme (1) concordant parfaitement avec nos chiffres.
Le tableau VI montre le nombre de patients présentant une IAH (déficit fonctionnel sur au moins une hormone) sur le nombre total de patients ayant un adénome cliniquement non-fonctionnel, explorés en préopératoire.
L’insuffisance gonadotrope est présente dans 70 a 96% des cas dans la litterature (1). Le déficit s’expliquerait soit par un défaut de bio-activité des gonadotrophines sécrétées par la tumeur, soit par lésion directe des cellules gonadotropes ou par compression de la tige pituitaire. Pour Waterlot (18) la testostérone est normale ou abaissée tout comme dans notre série, sauf dans les rares cas d’élévation de LH intacte, que nous n’avions pas.
Concernant l’insuffisance corticotrope, elle est estimée dans la littérature entre 20 et 62%, proches de nos chiffres. ( 1) L’insuffisance thyréotrope est retrouvee chez 18 a 81% denotant une grande variabilité (1)
L’hyperprolactinémie est généralement modérée, inférieure à 150mg/mL (3180 mUI/L) dans 50 à 75 % des cas. Elle correspondrait à une déconnexion hypothalamo-hypophysaire par compression de la tige, responsable d’une interruption du tonus inhibiteur dopaminergique (Prolactine Inhibiting Factor ou PIF) sur la sécrétion de prolactine par les cellules lactotropes de l’hypophyse normale. Les agonistes dopaminergiques n’entrainent pas une diminution du volume tumoral, même si la prolactinémie chute-diagnostic différentiel prolactinome- il faudrait dans ce cas une surveillance régulière du volume tumoral (1,18). Notre série laisse apparaître un taux plus bas chez les hommes.
Dosages de base des gonadotrophines et des sous-unités
FSH basale : chez l’homme les adénomes gonadotropes, qui s’accompagnent d’une hypersécrétion basale de gonadotrophines ou de sous-unités libres, produisent le plus souvent de la FSH. Elle demeure le marqueur sanguin le plus fréquemment retrouvé, autour de 64% (2, 10). Dans l’étude de Chanson (2), cette hypersécrétion de FSH est associée à une hypersécrétion de sous-unités α libres dans 45% des cas, à une hypersécrétion de LH dans 15%, et isolée dans 5%. (1,15). Il existerait une corrélation entre la sécrétion de FSH et le volume de l’adénome (1,12). Dans notre série, cette hypersécrétion ne représentait que 29 % des adénomes gonadotropes, et avait plus tendance à être normale (46%) ou diminuée (33,3%). Ceci s’expliquerait peut être par l’hypogonadisme qui n’est pas sensiblement plus élevé que dans la littérature. Dans les autres adénomes non-fonctionnels (3 non-sécrétants et 1 multisécrétant) nous ne retrouvons pas d’hypersécrétion.
LH basale: Son hypersécrétion est rare. Elle est associée à une hypersécrétion de FSH dans 15 % des adénomes gonadotropes fonctionnels. Elle est généralement associée à la sous-unité α. Il y a une possibilité d’hypersécrétion de LH avec une testostérone normale ou augmentée, mais il existe souvent un hypogonadisme, ce qui amène à poser la question sur la bio-activité de la LH. Pour Waterlot (18), cette élévation de LH est peu fréquente et s’accompagne alors d’une augmentation de la testostérone. Nous n’avons pas rencontré d’hypersécrétion de LH dans notre étude et les valeurs étaient équitablement réparties entre sécrétions normales et abaissées, en dépit d’un taux élevé d’adénome à LH. De plus le taux de testostérone était plus volontiers abaissé (2/3) que normal (1/3), jamais élevé.
Les sous-unites n’ont pas été dosées dans notre série mais sont présents dans l’arsenal diagnostique :
Sous-unité alpha : Elle serait dans plus d’un tiers des cas adénomes gonadotropes chez l’homme, la seule hypersécrétion trouvée dans le plasma. Il serait donc le seul marqueur du caractère gonadotrope de l’adénome cliniquement non fonctionnel. Mais il n’est pas spécifique, car retrouvé chez 10 à 30 % des acromégales, chez des prolactinomes, chez tous les thyréotropes, et exceptionnellement chez les corticotropes.(1,2).) L’hypersécrétion serait présente dans 60 à 65% des adénomes gonadotropes. (18)
Cette sous-unité α n’est pas dosée systématiquement dans le bilan préopératoire ; ces données de la littérature pourraient nous inciter à le faire dorénavant, permettant ainsi de mieux caractériser nos adénomes avant l’intervention, comme le souligne Chanson (3) -d’autant plus qu’à l’immunohistochimie, l’anticorps α-SU est celui qui réagit le plus souvent dans notre série, 31 fois/36 (86%).
LHβ libre : Son hypersécrétion est rare, de 0 à 18%. Elle est moins sensible que la FSH et/ou la sous-unité α (1,2,4,5). Elle n’est pas dosée systhématiquement dans le sang dans notre série ; elle représente avec l’α-SU, l’anticorps le plus réactif à l’immunohistochimie.
HCG : Elle est retrouvée dans 10 à 20 % des cas(1,2). L’ARNm est présent dans les tumeurs hypophysaires.
Les tests dynamiques
La stimulation à la GnRH : 75 à 100% des adénomes gonadotropes avec hypersécrétion basale de FSH réagiraient à ce test. Un tiers répond à la LH. S’ils sont non-fonctionnels, l’interprétation est difficile : réaction de cellules adénomateuses ou de cellules normales persistantes ? (1). Dans notre étude, seuls 6 cas /18 (33,3%) dont 1seul avait une hypersécrétion réagissaient pour la FSH ; il avait 1 réactivité d’un adénome non-sécrétant. Pour la LH, il était paradoxalement plus sensible (72%), sans l’hypersécrétion basale, et était positif pour 1 adénome multisécrétant. Ceci montre le peu d’intérêt de ces tests, peu sensibles et peu spécifiques. De plus, des cas d’apoplexie ont été décrits après ce test.
La réaction paradoxale à la TRH : elle permettrait de démasquer 10 à 20%, des adénomes gonadotropes silencieux sans hypersécrétion, les cellules non-adénomateuses ne répondent pas (17). Elle permettrait tout comme la GnRH une réactivité à la FSH dans 60 à 70 %, la LH dans 20 à 30% ou les sous-unités α et β dans 60% des cas (1,2,4,5,9,18). Elle est aussi peu sensible pour la FSH (8,3%) et la LH (16,7%) dans notre série.
Les tests de freinage
Les stéroïdes sexuels (1,2) : les androgènes seraient capable de freiner l’hypersécrétion de gonadotrophines produite par un adénome gonadotrope dans 50% des cas environ, qu’il s’agisse de FSH ou de LH mais n’ont pas d’action sur la sous-unité α.
Les agonistes de GnRH : Ils entraîneraient une stimulation prolongée de la sécrétion de gonadotrophines ou de la sous-unité α, mais elle est variable et peu fiable. Elle pourrait par ailleurs stimuler la tumeur et entraîner une augmentation des troubles visuels ou une apoplexie (1,18).
Les antagonistes de la Gn RH (1,4) : Ils peuvent entraîner un effondrement du taux de gonadotrophines chez les sujets normaux, mais ne peuvent le faire aussi nettement chez les sujets porteurs d’un adénome gonadotrope. Ils seraient actifs chez 4/5 des patients porteurs d’un adénome gonadotrope avec hypersécrétion de FSH.
La dopamine permettrait un freinage de gonadotrophines secrétées en excès dans 80% des cas (1).
B/ CHEZ LA FEMME MENOPAUSEE
L’interprétation des dosages est difficile en raison d’une augmentation physiologique de gonadotrophines. Le profit de la patiente correspond à une hypersécrétion de FSH et une oestradiolémie basse. Seuls 20 à 30 % des adénomes gonadotropes sont silencieux chez la femme ménopausée. (1,2,18)
Sécrétion basale de gonadotrophines : Un taux basal augmenté de FSH ou de sous-unité α libre, associé à une concentration non-élevée de LH (i.e. des valeurs observées chez les femmes non-ménopausées, donc diminuées dans notre série) en présence d’un macroadénome (où l’on s’attendrait à des taux bas de FSH et LH) oriente le diagnostic d’un adénome gonadotrope (1,2,4,5,10,17). Une baisse des sécrétions de FSH et de LH associées à une augmentation de la sous-unité , rarement rencontrées avec un macroadénome rend très probable également la nature gonadotrope (1,2) d’où la nécessité d’inclure son dosage systématique dans nos études ultérieures.
Dans notre serie, ce que nous avons considéré comme taux normal de FSH (entre 40 et 80 UI/L) et de LH (29 à 80 UI/L) correspond dans certains articles de la littérature à une hypersécrétion. Si nous utilisons l’hypersécrétion de FSH et la sécrétion normale de LH, selon leurs critères, nous aurions trouvé un cas de plus en préopératoire, et aucun autre non-sécrétant, ni corticotrope silencieux. Dans les limites de notre étude, ce test nous semble fiable.
Les tests dynamiques
Pour Daneshdoost (4), le test à la TRH sur LH a permis de détecter 8 fois /13 (61%) un adénome gonadotrope chez les femmes ménopausées, ce qui n’est pas de l’avis de Chanson qui le trouve peu fiable (1).
Dans notre série, ce test à la TRH répondait à la FSH dans les 4 cas dosés, et 1/3 à la LH. Quant au test à la GnRH, il était positif chez tous les patients contrôlées (uniquement des adénomes gonadotropes), ce qui lui confère une certaine sensibilité.
Les tests de freinage (1,15)
Les oestrogènes auraient un effet variable : absence de réactivité, stimulation, freinage. Antagonistes de la GnRH : ces tests pourraient être utiles pour faire la preuve de l’origine adénomateuse de l’hypersécrétion de FSH lorsqu’on suspecte la nature gonadotrope d’un adénome pituitaire chez les femmes ménopausées, si le problème de tolérance de ces produits est réglé.
C/ CHEZ LA FEMME EN PERIODE D’ACTIVITE GENITALE
Seuls 28% de ce groupe seraient vraiment silencieux, mais les séries étudiées dans la littérature sont courtes (1).
Sécrétion basale de gonadotrophines
Le taux de patients présentant une hypersécrétion de FSH est faible, autour de 20% (2, 11) ; il était nul dans notre série. On observe plutôt une augmentation de la sous-unité alpha dans plus de 75%, qui est isolée 2 fois/3, d’où son intérêt dans le bilan préopératoire systématique (2,5,15).
Donc une hypersécrétion de FSH et/ou de LH (1 cas de corticotrope silencieux dans notre série à LH élevé avec inversion du rapport FSH/LH !) devrait faire penser à une péri-ménopause.
Les tests dynamiques
Selon certains auteurs, 60% des femmes répondraient à la TRH (in 1). Le faible effectif dans notre série ne nous permet pas d’être catégorique, mais ces tests apparaissent néanmoins peu fiables comme le suggère certains auteurs (1).
Les tests de freinage
Les oestrogènes auraient un effet variable, tout comme chez la femme ménopausée : absence de réactivité, stimulation, freinage (1,2,15).
D/ PROFIL BIOLOGIQUE DES ADENOMES NON-FONCTIONNELS
En définitif, le tableau biologique chez les patients porteur d’un adénome cliniquement silencieux, et plus particulièrement un adénome gonadotrope montrerait :
Chez l’homme
Une insuffisance anté-hypophysaire dans environ 70% des cas, prédominant sur la fonction gonadotrope, quasi-exclusivement présente. L’hyperprolactinémie est présente dans environ la moitié des cas, toujours inférieure à 150 ng/mL (ou 3180 mUI/L) et ne doit pas être traitée par agoniste dopaminergique ! (éliminer un macroprolactinome qui devrait dans tous les cas être opéré).
Les taux de FSH et la LH peuvent être augmentés, montrant le caractère gonadotrope dans ¼ des cas, mais sont surtout diminués ou normaux (équitablement répartis) en raison de l’insuffisance gonadotrope, d’où la nécessité de doser les sous-unités α et β.
Par contre les tests dynamiques et les tests de freinage, onéreux , de protocoles draconiens au risque d’en modifier les résultats, présentant de risques de complications graves, peu sensibles et peu spécifiques doivent être retirés du bilan préopératoire.
Chez la femme ménopausée
L’insuffisance anté-hypophysaire est présente chez les patientes, avec une insuffisance gonadotrope presque toujours présente où les taux de gonadotropines sont physiologiquement supérieurs aux sujets jeunes mais inférieurs à la norme pour cette catégorie de patientes. La sécrétion élevée de FSH associée à une LH basse permettrait de détecter certains adénomes gonadotropes cliniquement silencieux. Dans le ¼ restante, le dosage de la sous-unité α permettrait de déceler des adénomes gonadotropes. L’hyperprolactinémie, elle, est presque toujours présente. La complexité de la régulation des hormones sexuelles chez les femmes ménopausées nous invite tout de même à faire preuve de circonspection dans l’interprétation de nos résultats.
Chez la femme en période d’activité génitale
L’insuffisance anté-hypophysaire est présente chez 4/5 des patientes, presque toujours gonadotrope, avec des taux bas ou diminués de gonadotrophines et hyperprolactinémie-tout comme les autres adénomes non-fonctionnels – d’où la nécessité de doser la sous-unité α.
ANATOMOPATHOLOGIE
Les adénomes gonadotropes se définissent comme des tumeurs hypophysaires dont l’étude histochimique retrouve en leur sein plus de 5% de cellules gonadotropes immunoréactives, isolées ou associées à d’autres sécrétions. Les adénomes hypophysaires non-fonctionnels vrais sont des tumeurs hypophysaires ne sécrétant aucune hormone ou sous-unité d’hormones hypophysaires.
Nos données concordent avec la litterature (1,2,16) qui trouve plus de 80% de marquage avec une ou plusieurs sous-unités de glycoprotéines, et correspondent à un adénome gonadotrope, le plus souvent, mais il peut s’agir d’un vrai non-secrétant ou d’un corticotrope silencieux (16) le marquage n’intéresse pas l’ensemble des cellules adénomateuses. Les adénomes à sous-unité α
pure, rare, considérés comme gonadotropes ne sont retrouvés qu’une seule fois.
CONCLUSION
Le tableau clinique évocateur des adénomes hypophysaires non- sécrétants étant exceptionnel, il importe par une analyse plus fine, de rechercher ces signes au début : céphalée, baisse de l’acuité visuelle, malheureusement constatées à posteriori. Un scanner cérébral doit être demandé immédiatement. L’insuffisance anté-hypophysaire prédomine sur la fonction gonadotrope. L’hyperprolactinémie, toujours inférieure à 150 ng/mL (ou 3180 mUI/L) doit inciter a élargir les examens lors du bilan biologique avec dosage des sous unités α et β. Les tests dynamiques et de freinages doivent être réalisés de façon exceptionnel.Une collaboration multidisciplinaire est nécessaire pour une prise en charge collégiale efficace.
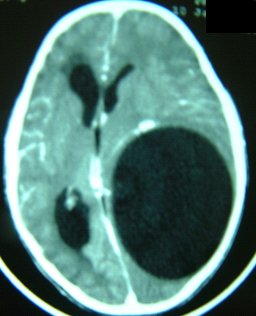
Figure 1
Figure 2
Tableau I : Répartition des patients en fonction de l’âge.
| Age en années |
20-29 |
30-39 |
40-49 |
50-59 |
60-69 |
70-79 |
≥80 |
Total |
| Hommes |
3 |
2 |
2 |
5 |
5 |
9 |
2 |
28 |
| Femmes en période d’activité |
1 |
1 |
4 |
– |
– |
– |
– |
6 |
| Femmes ménopausées |
– |
– |
– |
3 |
5 |
2 |
– |
10 |
Tableau II : Représentation du délai diagnostic.
| Délai (mois) |
1 |
1-3 |
4-6 |
7-9 |
10-12 |
13-24 |
25-48 |
49-120 |
| Nombre de patients |
8 |
13 |
11 |
3 |
4 |
2 |
2 |
1 |
Tableau III-a : Dosage basal de gonadotrophines chez l’homme.
| |
n |
Augmenté |
|
Normal |
|
Diminué |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
Gonado |
Autres |
| FSH (2,5-8,8 UI/I) |
27 |
4 |
0 |
11 |
2 |
8 |
2 |
| LH (3-12 UI/I) |
27 |
0 |
0 |
11 |
1 |
12 |
3 |
| Testostérone (7-24,3nmol/l) |
15 |
0 |
0 |
4 |
0 |
9 |
2 |
Tableau III-b : Tests dynamiques chez l’homme
| |
n |
Augmenté |
|
Normal |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
| GnRH sur FSH |
20 |
6 |
1 |
12 |
1 |
| TRH sur FSH |
14 |
1 |
0 |
11 |
2 |
| GnRH sur LH |
20 |
13 |
1 |
5 |
1 |
| TRH sur LH |
14 |
2 |
0 |
10 |
2 |
Tableau IV-a : Dosage basal de gonadotrophines chez la femme ménopausée
| |
n |
Augmenté |
|
Normal |
|
Diminué |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
Gonado |
Autres |
| FSH (40-80 UI/I) |
9 |
0 |
0 |
2 |
1 |
6 |
0 |
| LH (29-80 UI/I) |
9 |
0 |
0 |
1 |
1 |
7 |
0 |
| Oestradiol (30-130 pmol/l) |
4 |
0 |
0 |
2 |
0 |
2 |
0 |
Tableau IV-b : Tests dynamiques chez la femme ménopausée
| |
n |
Augmenté |
|
Normal |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
| GnRH sur FSH |
7 |
7 |
0 |
0 |
0 |
| TRH sur FSH |
4 |
4 |
0 |
0 |
0 |
| GnRH sur LH |
7 |
7 |
0 |
1 |
0 |
| TRH sur LH |
3 |
1 |
0 |
2 |
0 |
Tableau V-a : Dosage basal de gonadotrophines chez la femme en période d’activité génitale
| |
n |
Augmenté |
|
Normal |
|
Diminué |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
Gonado |
Autres |
| FSH (2,5-8,8 UI/I) |
5 |
0 |
0 |
2 |
2 |
0 |
1 |
| LH (3-12 UI/I) |
5 |
0 |
1 |
0 |
1 |
2 |
1 |
| Oestradiol (30-130 pmol/l) |
3 |
0 |
0 |
0 |
0 |
0 |
3 |
TableauV-b : Tests dynamiques chez la femme en période d’activité génitale.
| |
n |
Normal |
|
Diminué |
|
| |
|
Gonado |
Autres |
Gonado |
Autres |
| GnRH sur FSH |
4 |
0 |
3 |
1 |
0 |
| TRH sur FSH |
3 |
1 |
0 |
1 |
1 |
| GnRH sur LH |
4 |
1 |
3 |
0 |
0 |
| TRH sur LH |
2 |
0 |
1 |
1 |
0 |
Tableau VI : IAH préopératoire dans les adénomes non-fonctionnels- données de la littérature (d’après Chanson,3)
| Auteur |
Année |
Nbre d’IAH |
% |
| Ebersold et al. |
1986 |
61/100 |
61 |
| Arafat et al. |
1986 |
25/26 |
96 |
| Comtois et al. |
1991 |
87/105 |
83 |
| Marazuela et al. |
1994 |
24/35 |
67 |
| Greenman et al. |
1995 |
14/26 |
54 |
| Chanson et al. |
1997 |
25/39 |
64 |
| Notre série |
2005 |
28/41 |
68 |
| Total |
|
264/372 |
71 |
REFERENCES
- CHANSON P., PETROSSIANS P. Les adénomes non fonctionnels 1998 Ed. John Libbey Eurotext 128 p
- CHANSON P., PANTEL J., YOUNG J, BIDART JM, JACQUET P, MISRAHI M, MILGROM E, SCHAISON G. Free luteinizing hormone béta-subunit in normal subjects and patients with pituitary adenomas J. Clin.Endocrinol Métab. 1997; 82:1397-1402
- CHANSON P, BROCHIER S. Non-functionning pituitary adenoma. J Endocrinol Invest 2005;28:93-99
- DANESHDOOST L, and al Recognition of gonadotroph adenomas in women. N. Engl.J.Med.1991;324:589-594
- DANESHDOOST L., GENNARELLI TA, BASHEY HM, SAVINO PJ, SERGOTT RC, BOSLEY TM, SNYDER PJ. Identification of gonadotroph adenomas in men with clinically non fouctioning adenomas by the luteinizing hormone beta-subunit response to thyrotropin releasing hormone J. CLin Endocrinol Métab.1993;77:1352-1355
- DUPUY M., BOULIN L. Imagerie des apoplexies adénomateuses pituitaires Méd. Ther.1999;1:92-97
- FAINSTEIN DAY P, GUITELMAN M, ARTESE R, FISZLEDJER L, CHERVIN A, VITALE NM, STALLDECKER G, DE MIGUEL V, CORNALÓ D, ALFIERI A, SUSANA M, GIL M. Retrospective multicentric study of pituitary incidentalomas. Pituitary.2004;7(3):145-148.
- GHAYURI M, LIU JH. Ovarian hyperstimulation syndrome caused by pituitary gonadotroph adenoma secreting follicle-stimulating hormone Obstet Gynecol. 2007;109:547-549
- GRUSZKA A, KUNERT-RADEK J, PAWLIKOWSKI M. Serum alpha-subunit elevation after TRH administration: a valuable test in presurgical diagnosis of gonadotropinoma ? Endokrynol Pol. 2005;56:14-18
- HANSON PL, AYLWIN SJ, MONSON JP, BURRIN JM. FSH secretion predominates in vivo and in vitro in patients with non-functioning pituitary adenomas Eur J Endocrinol. 2005;152:363-370
- KIHARA M, SUGITA T, NAGAI Y, SAEKI N, TATSUNO I, SEKI K. Ovarian hyperstimulation caused by gonadotroph cell adenoma: a case report and review of the literature Gynecol Endocrinol. 2006;22:110-113
- LAHLOU N. , Le NESTOUR E, CHANSON P, SERET-BEGUE D, BOUCHARD P, ROGER M, WARNET A. Inhibin and follicle-stimulating hormone levels in gonadotroph adenomas : evidence of a positive correlation with tumors volume in men Clin. Endocrinol. 1993;38:301-309
- MOR E, RODI IA, BAYRAK A, PAULSON RJ, SOKOL RZ. Diagnosis of pituitary gonadotroph adenomas in reproductive-aged women. Fertil Steril. 2005;84:757
- NIELSEN EH, LINDHOL MJ, BJERRE P, CHRISTIANSEN JS, HAGEN C, JUUL S, JORGENSEN J, KRUSE A, LAURBERG P. Frequent occurrence of pituitary apoplexy in patients with non-functionning pituitary adenoma. Clin Endocrinol 2006;64:319-322
- OPPENHEIM D.S, KANA A.R., SANGHA JS., KLIBANSHI A. Prevalence of alpha-subunit hypersecretion in patients with pituitary tumors: clinically non functioning and somatotroph adenomas J. Clin. Endocrinol Metab. 1990;70:859-864
- SAHLI R, CHRIST ER, SEILER R, KAPPELER A, VAJTAI I. Clinicopathologic correlations of silent corticotroph adenomas of the pituitary: report of four cases and literature review Pathol Res Pract. 2006;202:457-464.
- SNYDER P.J. Gonodotroph adenomas Melmed S., ed. The pituitary.1995;vol.1Cambridge Blackwell-Science:559-575
- WATERLOT C., CORTET-RUDELLI C, FOSSATI P, DEWAILLY D. Adénomes gonadootropes Rév.Prat.1996;46:1498-1502
- YAMADA S, OHYAMA K, TAGUCHI M, TAKESHITA A, MORITA K, TAKANO K, SANO T. A study of the correlation between morphological findings and biological activities in clinically nonfunctioning pituitary adenomas Neurosurgery. 2007;61:580-584


