CASE REPORT / CAS CLINIQUE
ANOREXIE MENTALE ET MYELINOLYSE CENTROPONTINE ET EXTRAPONTINE
ANOREXIA NERVOSA ASSOCIATED WITH CENTRAL PONTINE MYELINOLYSIS AND EXTRAPONTINE MYELINOLYSIS
- Service de Neurologie, CHU Hassan II, Fès, Maroc
- Service de Réanimation polyvalente CHU Hassan II, Fès, Maroc
E-Mail Contact - EL MIDAOUI Aouatef :
RESUME
Introduction
La myélinolyse centropontine et extrapontine est une complication connue mais rare des hyponatrémies et de leur correction. Elle représente une entité pathologique définie par des arguments cliniques et radiologiques survenant dans un contexte étiologique susceptible d’orienter le diagnostic. L’anorexie mentale est rarement décrite comme responsable d’une hyponatrémie compliquée de myélinolyse centro et extrapontine.
Observation
Nous rapportons l’observation d’une patiente de 19 ans ayant une histoire d’anorexie mentale depuis 4 ans admise pour trouble de conscience associée à une hyponatrémie. Malgré la correction adéquate des troubles hydro-électrolytiques, la patiente a présenté des crises convulsives tonico-cloniques généralisées et une tétraplégie. L’IRM cérébrale a confirmé le diagnostic de la myélinolyse centro et extrapontine. Malgré l’installation d’un tableau clinique particulièrement spectaculaire, l’évolution était marquée par l’amélioration progressive des troubles neurologiques.
Discussion
La myélinolyse centropontine est une complication neurologique rattachée le plus souvent à la correction trop rapide d’une hyponatrémie. Dans le cas rapporté, la correction de l’hyponatrémie ne semble pas être l’agent déclenchant du syndrome, l’hypokaliémie et la dénutrition, en induisant une vulnérabilité particulière des cellules gliales aux variations osmotiques, ont probablement joué un rôle favorisant. Le pronostic de la myélinolyse est diversement apprécié mais dans le cadre de l’anorexie mentale, il semble être moins grave. Toutefois aucune corrélation n’existe entre la gravité du tableau clinique, l’aspect radiologique et l’évolution d’où l’importance d’une surveillance clinique et radiologique étroite surtout durant le premier mois.
Mots clés: Anorexie mentale ; Hyponatrémie ; Myelinolyse centropontine; Myelinolyse extrapontine.
ABSTRACT
Introduction
Central pontine myelinolysis (CPM) and extrapontine myelinolysis (EPM) are demyelinating disorders of central nervous system, more commonly associated with rapid correction of hyponatremia. Several patients with CPM and EMP as a complication of anorexia nervosa have been reported.
Clinical case
We report a case of a 19 year-old woman with a 4 year history of anorexia who presented a disturbance of consciousness, secondary to hyponatremia. She developed a quadriplegia associated with epileptic fits one week after a slow correction of hyponatremia. Central pontine myelinolysis and extrapontine myelinolysis were formally diagnosed by MRI findings. Despite of severe initial symptoms, the evolution was favourable with a quasi complete recovery.
Discussion
Central pontine myelinolysis and extrapontine myelinolysis may occur despite a treatment of hyponatremia conducted according to published guidelines. In our case, the correction of hyponatraemiaI is not the only causal agent of this syndrome; hypokalaemia and denutrition seem to be predisposing factors. The prognosis has been varying in the last decades and it is highly heterogenous with complete recovery reported in some cases to progression and death in others. This prognosis does not seem to be fatal with anorexia nervosa. Thus, it has been observed that the size of the lesion in the CPM and EPM does not correlate with the seriousness of the neurological disorders or the clinical picture course.
Keywords: Anorexia nervosa; Centralpontine myelinolysis; Extrapontine myelinolysis; Hyponatremia.
INTRODUCTION
Initialement décrite par Adams, Victor et Mancall en 1959, la myélinolyse centropontine (MCP) encore appelée syndrome de démyélinisation osmotique, est une complication neurologique rare. Elle correspond à une démyélinisation caractérisée par la destruction des gaines de myéline de la partie centrale de la base de la protubérance anciennement appelée pont, épargnant les neurones. Cette myélinolyse peut s’étendre à d’autres structures cérébrales, définissant la myélinolyse extrapontine (MEP). (1, 27, 33).
Si la MCP peut s’accompagner d’une MEP dans environ 10 % des cas, l’atteinte extrapontine isolée est rare (5, 13, 30). Sa physiopathologie est complexe et demeure mal élucidée, elle est associée à la dénutrition, à l’alcoolisme chronique et elle est souvent la conséquence d’une correction trop rapide d’une hyponatrémie (5, 13, 33). Son traitement est mal codifié et repose essentiellement sur des mesures générales de réanimation, avec des essais thérapeutiques non spécifiques [corticothérapie, Thyrotropin releasing hormone (TRH)] et des résultats incertains (4, 7, 10).
Nous rapportons le cas d’une patiente de 19 ans ayant une histoire d’anorexie mentale depuis 4 ans avec des vomissements chroniques, qui a présenté une myélinolyse centropontine et extrapontique malgré une correction adéquate de l’hyponatrémie.
OBSERVATION
Nous rapportons le cas d’une patiente âgée de 19 ans ayant comme antécédents une gastrite avec des vomissements chroniques depuis 4 ans qui s’est présenté aux urgences pour trouble de conscience sans signes de focalisation avec un score GSC (Glasgow Coma Scale) à 12 (Ouverture des yeux à 3, réponse verbale à 4 et réponse motrice á 5) et altération de l’état général . Une TDM et une ponction lombaire réalisée en urgence étaient normales. Son bilan biologique initial a révélé une hyponatrémie à 110 meq/l, une hypokaliémie à 1,7 meq/l et une hypocalcémie à 71 meq/l. La patiente a eu une correction adéquate de l’hyponatrémie : 7 meq/l le premier jour et 14 meq/l les 2 jours suivants (schéma 1). La kaliémie et la calcémie ont été corrigées en deux jours. Après la normalisation de l’ionogramme, les vomissements ont persisté et la fibroscopie a montré une sophagite sévère et la patiente a présenté une hypokaliémie qui a persisté une semaine malgré une correction orale et parentérale. L’évolution était marquée par la résolution des troubles de la conscience.
Huit jours après son admission, la patiente a présenté une tétraplégie plus marquée à droite, un mutisme et des crises convulsives tonicocloniques généralisées.
L’IRM réalisée a montré un hypersignal centropontique (figure 1) et extrapontique au niveau mésencéphalique, cérébelleux, des noyaux gris centraux notamment le putamen, le noyau caudé et le thalamus et au niveau du cortex temporal; ce qui a permis de poser le diagnostic de la myélinolyse centropontine et extrapontique (figure 2-3-4).
L’interrogatoire avec la famille a révélé des troubles de la conduite alimentaire à type d’anorexie/boulimie, des vomissements initialement provoqués devenus spontanés après chaque repas, un amaigrissement important (poids de la patiente : 27 kg), une aménorrhée secondaire ainsi qu’un trouble de la perception de l’image corporelle sur un fond de personnalité obsessionnelle. Ce tableau était compatible avec le diagnostic d’anorexie mentale.
L’évolution après 3 mois était marquée par une amélioration progressive et nette des signes cliniques: La patiente retrouvait son autonomie, elle marchait seule et son langage est devenu fluent. À l’examen clinique persistaient un syndrome tétrapyramidal non déficitaire et un syndrome cérébelleux. Une IRM cérébrale de contrôle réalisée après 3 mois montrait une évolution favorable des lésions avec un hypersignal T2 plus discret au niveau des noyaux lenticulaires (Figure 5). La patiente a bénéficié d’une prise en charge psychiatrique pour son anorexie mentale et l’évolution était marquée par la disparition des vomissements et une prise de poids de 18 kg.
DISCUSSION
La myélinolyse centropontine (MCP) et extrapontine (MEP) faisant proposer le terme plus général de « osmotic demyelination syndrome » constitue une entité pathologique, définie par la présence de tableaux cliniques variés témoignant d’une démyélinisation du système nerveux central et de signes radiologiques (IRM) typiques faits d’une démyélinisation pontique et extra-pontique (4, 7, 8, 10, 30, 33).
La myélinolyse centropontine a été d’abord rapportée après autopsie chez des éthyliques dénutris puis avec l’avènement de l’IRM, les désordres des électrolytes et notamment la correction rapide de la natrémie dans le cadre d’une hyponatrémie chronique a été incriminée comme facteur causal (1). Actuellement, il est clair que des facteurs additionnels ont un rôle critique dans la prédisposition de la myéline pontique et extrapontique au stress osmotique: l’alcoolisme, les hépatopathies et la transplantation hépatique, et les déficits nutritionnels en particulier au cours d’une anorexie mentale récemment rapportée (3, 21). En effet, plusieurs cas de myélinolyse survenant comme complication de l’anorexie mentale ont été rapportés. Le mécanisme du développement de la myélinolyse est dans ce cas discuté par l’association des troubles électrolytiques et de leur correction rapide. Ces troubles sont attribuables à la malnutrition, aux vomissements, à l’intoxication à l’eau, l’abus des diurétiques et des laxatifs fréquent chez ces patients. (18, 33).
Les études expérimentales suggèrent que l’hyponatrémie chronique en elle-même n’induit pas de MCP et que celle-ci survient surtout en cas de correction trop rapide (14, 26). Ainsi les objectifs thérapeutiques recommandés dans les récents guidelines sont une élévation de la natrémie inférieure à 12 mmol/l dans les 24 premières heures et inférieure à 20 mmol/l dans les 48 heures suivantes (19). Des cas survenant, comme chez notre patient, lors d’un traitement conduit en accord avec les recommandations actuelles ont été décrits, témoignant sans doute d’une susceptibilité individuelle et l’intervention d’autres facteurs étiologiques (13).
Indépendamment de la profondeur et de la cause de l’hyponatrémie initiale, une durée d’évolution supérieure à 48 heures avant traitement semble être un facteur de risque de survenue d’une myélinolyse (13). Ce phénomène est plus fréquent quand le développement de l’hyponatrémie et sa correction surviennent en présence d’une hypokaliémie, de malnutrition ou en cas de situation de stress tel que l’hypoxie, le sepsis ou les brûlures (2). La durée de l’hyponatrémie était difficile à évaluer chez notre patiente puisque l’hyponatrémie peut être bien tolérée si elle s’installe lentement.
Les signes neurologiques révélateurs d’une myélinolyse extrapontine et/ ou centropontine sont généralement différents des signes neurologiques initiaux imputables à l’hyponatrémie et surviennent classiquement de façon retardée après un intervalle libre de 1 à 6 jours après correction de l’hyponatrémie (9, 13). Les symptômes de la myélinolyse peuvent cependant chevaucher ceux de l’hyponatrémie ou apparaître plusieurs mois après la correction de l’hyponatrémie (13, 25).
La myélinolyse centropontine a un large éventail de présentations cliniques et peut même rester silencieuse, de découverte fortuite lors de la réalisation d’une imagerie cérébrale. Classiquement, elle se manifeste par un syndrome pseudo-bulbaire, une tétraparésie spastique. Une myélinolyse étendue du pont peut se traduire par un locked-in syndrome (16, 23). Les lésions qui touchent la partie basse du pont peuvent être responsables d’une paralysie uni ou bilatérale du VI (16, 20).
Des variations de la vigilance peuvent être observées allant de l’obnubilation au coma profond traduisant le plus souvent une extension de la démyélinisation au tegmentum du pont (16).
En cas de MEP, la présentation clinique est dominée par des signes extrapyramidaux (syndrome parkinsonien, dystonie), trouble de comportement et convulsions. (6, 13, 15). Chez notre patiente, le seul signe clinique qui pouvait orienter vers une atteinte extrapontique était les crises convulsives.
La physiopathologie exacte de ce syndrome est mal connue. Norenberg (1983) dans une publication sur le mécanisme pathologique de la MCP, a suggéré que l’augmentation rapide de la natrémie produirait une perturbation osmotique de l’endothélium qui déclencherait la libération locale de facteurs myélinotoxiques dérivés des vaisseaux de la substance grise cérébrale (26). Ashrafian et Davey ont proposé une hypothèse séduisante, faisant de l’apoptose des cellules gliales la cause principale de survenue des lésions de myélinolyse (3). L’apoptose serait due à un état de carence énergétique chronique chez certains patients comme les alcooliques, acutisée par le stress métabolique de l’adaptation du volume cellulaire aux variations de la tonicité plasmatique. La localisation préférentielle de ces phénomènes apoptotiques au niveau du pont peut être expliquée par l’organisation des axones et de la névroglie qui à cet endroit limite l’dème cellulaire et le stockage du glucose, alors que la vascularisation régionale n’est pas optimisée pour répondre aux augmentations des besoins métaboliques. L’hypokaliémie dans ce contexte représente également un «challenge» métabolique puisque la pompe Na+/K+-ATPase, qui permet aux cellules gliales de transporter les osmolytes, doit fonctionner contre un gradient augmenté.
Le scanner cérébral apparaît peu sensible pour la détection des lésions de myélinolyse (13).Une hypodensité médio-protubérantielle, non rehaussée par l’injection de produit de contraste iodé et sans effet de masse sur les structures avoisinantes est parfois trouvée (13, 15). L’IRM cérébrale plus sensible est l’examen de choix qui permet de mettre en évidence des lésions en hyposignal T1 et hypersignal T2 et FLAIR, non rehaussées par l’injection de Gadolinium (8). Dans la MCP ; cette anomalie de signal touche de manière symétrique le centre de la protubérance, épargnant les faisceaux corticospinaux et les régions ventrolatérales du pont (31).
Dans 10 % des cas, d’autres structures du système nerveux central peuvent être affectées par la myélinolyse définissant le terme de myélinolyse extrapontine touchant le cervelet, le thalamus, le putamen, le pallidum, le noyau sous thalamique, le cortex cérébral et la substance blanche sous-corticale (17). Ces anomalies peuvent avoir toutefois une apparition retardée et une IRM normale n’élimine pas le diagnostic (12, 17). Les sites de démyélinisation chez notre patiente étaient typiques : la région centrale de la protubérance, le mésencéphale, le putamen et le noyau caudé ; le thalamus ainsi que le cortex cérébral.
La taille des lésions radiologiques ne semble pas corrélée à la gravité de l’atteinte neurologique initiale, de même qu’il n’existe pas de corrélation entre l’évolution des anomalies radiologiques et la persistance des symptômes. L’étude du liquide céphalorachidien est habituellement normale, mais peut mettre en évidence une élévation de la protéinorachie ou des métabolites des monoamines, dosages non réalisés en pratique courante (13, 25). L’électro-encéphalogramme, non spécifique, montre le plus souvent un ralentissement diffus de l’activité cérébrale (13).
Le traitement est mal codifié et repose essentiellement sur des mesures symptomatiques, telle la correction douce et progressive des troubles hydroélectrolytiques, notamment une correction raisonnée de toute hyponatrémie, sans dépasser une vitesse de correction de 0,5 mmol/l par heure avec un contrôle pluriquotidien de la natrémie (7, 24). Une réinduction douce de l’hyponatrémie a été également proposée (10, 27, 28). Différents protocoles de corticothérapie ont été utilisés avec des résultats très contradictoires, allant d’une récupération quasi totale à un état stationnaire (7). Les tentatives de traitement par l’oxygène hyperbare ont été décevantes. Plus récemment, un traitement par TRH, à la dose de 2 mg/j en intraveineux, de durée variable, a été proposé avec des résultats encourageants (7, 28). Le mode d’action de la TRH sur la myélinolyse n’est pas connu ; des travaux cliniques expérimentaux suggèrent son rôle dans l’amélioration de la vigilance, du débit cérébral régional. Les plasmaphérèses et les immunoglobulines intraveineuses à la dose de 0,4 g/kg/j ont été essayées avec de bons résultats (11).
Le pronostic des syndromes de myélinolyse est diversement apprécié. L’évolution va de la récupération complète au décès en passant par des séquelles neurologiques. Les troubles bulbaires et la tétraparésie spastique sont des séquelles courantes en cas de MCP, alors que les séquelles habituelles de la MEP étant les troubles cognitifs, la dysarthrie et les troubles ataxiques (13, 22).
Cette évolution à long terme n’est corrélée ni à la sévérité initiale, ni à 1’évolution des signes radiologiques (persistance avec amélioration clinique, et vice versa). Dans les études les plus anciennes, des taux de mortalité de 50 à 90 % à six mois ont été rapportés, alors dans les études récentes, le pronostic de la myélinolyse n’est pas aussi sombre. La série de Menger portant sur 34 patients ne relève que deux décès, les autres ayant récupéré complètement pour un tiers, pour un autre tiers avec séquelles modérées et pour le dernier tiers avec séquelles lourdes (22). Cette récupération se fait au prix d’une longue période de rééducation comme en témoigne notre observation.
CONCLUSION
La myélinolyse centropontine et extrapontine peut survenir chez les patients ayant des troubles de conduite alimentaire notamment dans l’anorexie mentale suite à des désordres métaboliques et hydroélectrolytiques secondaires aux vomissements et à la malnutrition
Cette myélinolyse peut engager le pronostic vital et être la cause d’une lourde morbidité mais qui, à l’aide d’une rééducation, peut être réversible. Il faut redouter particulièrement la vitesse de correction des hyponatrémies, qui malgré une attention particulière, peut s’avérer trop rapide. Mais elle n’est pas le seul facteur prédisposant, et l’association à d’autres facteurs comme une hypokaliémie, une dénutrition ou un alcoolisme chronique, doivent inciter à une prudence encore accrue. Il faut alors mettre en balance le pronostic à court terme d’une hyponatrémie même profonde avec celui du stress métabolique induit par une correction encore trop rapide. L’absence d’un traitement spécifique souligne l’intérêt de l’essai de certaines thérapeutiques (corticothérapie, TRH, plasmaphérèse, immunoglobulines intraveineuses).
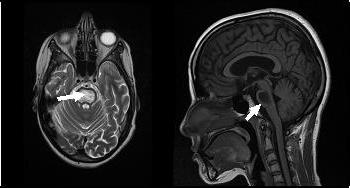
Figure 1
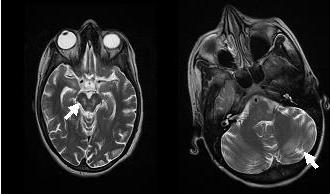
Figure 2
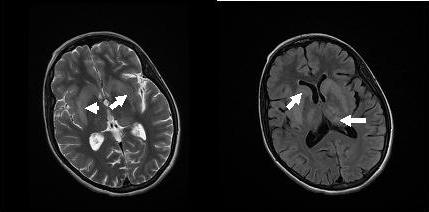
Figure 3
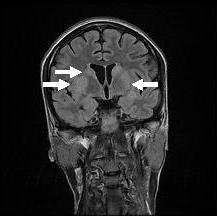
Figure 4
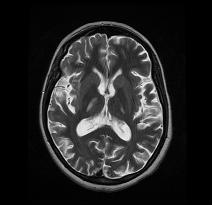
Figure 5
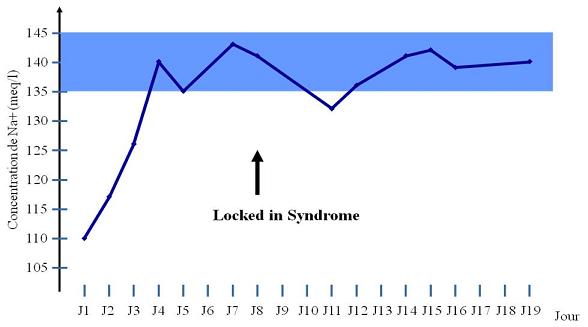
Schéma N°1
| |
Personne 1 |
Personne 2 |
Personne 3 |
| Nom |
B. |
C. |
D. |
| Prenom |
Albert |
Beatrice |
Estelle |
| Pays |
Cote d’Ivoire |
Angleterre |
Japon |
| |
Personne 1 |
Personne 2 |
Personne 3 |
| Nom |
B. |
C. |
D. |
| Prenom |
Albert |
Beatrice |
Estelle |
| Pays |
Cote d’Ivoire |
Angleterre |
Japon |
REFERENCES
- ADAMS RD, VICTOR M, MANCALL EL. Central pontine myelinolysis: a hitherto undescribed disease occuring in alcoholic and malnourished patients. Arch Neural Psychiatr. 1959;81:154-72.
- ADROGUE HJ, MADIAS NE. Hyponatremia. N Engl J Med. 2000;342:1581-9.
- ASHRAFIAN H, DAVEY P. A review of the causes of central pontine myelinolysis: yet another apoptotic illness? Eur J Neurol. 2001;8:103-9.
- BROWN WD. Osmotic demyelination disorders: central pontine and extrapontine myelinolysis. Curr Opin Neurol. 2000;13:691-7.
- CHARRA B, HACHIMI A, GUEDARI H. Myélinolyse extrapontine après correction d’une hyponatrémie. Ann Fr Anesth Reanim. 2006;25:76-7.
- CHATELA J, KATTAH J. Catatonia due to central pontine and extrapontine myelinolysis: case report. J Neurol Neurosurg Psychiatry. 1999;67:692-3.
- CHEMALY R, HALABY G, MOHASSEB G. Extrapontine myelinolysis: treatment with TRH. Rev Neurol. 1998;154:163-5.
- CHUA GC, SITOH YY, LIM CC. MRI finding in osmotic myelinolysis. Clin Radiol. 2002;57:800-6.
- DICKOFF D, RAPPS M, YAHR M. Striatal syndrome following hyponatremia and its rapid correction: a manifestation of extrapontine myelinolysis confirmed by magnetic resonance imaging. Arch Neurol. 1988;45:112-4.
- FABISIAK DB, MURRAY GB, STERN TA. Central pontine myelinolysis manifested by temporary blindness: a possible complication of lithium toxicity. Ann Clin Psychiatry. 2002;14:247-51.
- FINSTERER J, ENGELMAYER E, TMKA E, STISKAL M. Immunoglobulins are effective in pontine myelinolysis. Clin Neuropharmacol. 2000;23:110-3.
- GERVAISE A, PERNIN M, NAULET P, DARBOIS H, GIRODEAU A. Myelinolyse centropontine. Presse Med. 2008;37:1831-1833
- ILLOWSKI KARP B, LAURENO R. Pontine and extrapontine myelinolysis: a neurologic disorder following rapid correction of hyponatremia. Medicine (Baltimore). 1993;72:359-73.
- KLEINSCHMIDT-DE MASTERS BK, NORENBERG MD. Rapid correction of hyponatremia causes demyelination: relation to central pontine myelinolysis. Science. 1981;211:1068-70.
- KOENIG. M, CAMDESSANCHE. J.P, DUBAND.S, CHARMION.S, ANTOINE.J.C, CATHEBRAS. P. Myélinolyse extrapontine d’évolution favorable au cours d’une polyendocrinopathie autoimmune. Rev Med Int. 2005;26:65-68
- KPADE C, DURIEU I, LIMODIN J, PAULIN M, MAGNI C, LEMAIRE J-F. Myélinolyse centropontine révélée par une monoplégie supérieure gauche sans hyponatrémie ni dénutrition. Rev Neurol. 2004;160:5,568-570.
- KUMAR SR, MONE AP, GRAY LC, TROOST BT. Central pontine myelinolysis: delayed changes on neuroimaging. J Neuroimag. 2000;10:169-72.
- LANOTTE R, PERROTIN D, GINIES G. Myélinolyse centropontine et hyponatrémie. Ann Fr Anesth Reanim. 1988,7:339-342.
- LAURENO R, KARP BI. Myelinolysis after correction of hyponatremia. Ann Intern Med. 1997;126(1):57-62.
- MANI R, LAURENO R. Neuro-ophtalmic features of central pontine myelinolysis. In: Smith JL, (ed) Neuro-ophthalmology Now! New York, NY: Field, Rich and associates. 1986,323-327.
- MCCOLL P, KELLY C. A misleading case of central pontine myelinolysis: risk factors for psychiatric patients. Br J Psychiatry. 1992;160:550-2.
- MENGER H, JÖRG J. Outcome of central pontine and extrapontine myelinolysis. J Neurol. 1999;246:7005.
- MESSERT B, ORRISON WW, HAWKINS MJ, QUAGLIERI CE. Central pontine myelinolysis: considerations on etiology, diagnosis and treatment. Neurology. 1979.29:147-160.
- MICHELL AW, BURN DJ, READING PJ. Central pontine myelinolysis temporally related to hypophosphataemia. J Neurol Neurosurg Psychiatry. 2003;74:820-6.
- NAGAMITSU S, MATSUISHI T, YAMASHITA Y, YAMADA S, KATO H. Extrapontine myelinolysis with parkinsonism after rapid correction of hyponatremia: high cerebrospinal fluid level of homovanillic acid and successful dopaminergic treatment. J Neural Transm. 1999;106:949-53.
- NORENBERG MD, PAPENDICK RE. Chronicity of hyponatremia as a factor in experimental myelinolysis. Ann Neurol. 1984;15:544-7.
- OYA S, TSUTSUMI K, UEKI K, KIRINO T. Reinduction of hyponatremia to treat central pontine myelinolysis. Neurology. 2001;57:1931-2.
- RAFAI MA, BOULAAJAJ FZ, FADEL H, HAKIM K, EL MOUTAWAKKIL B, SLASSI I. Myélinolyse centro et extrapontine chez un patient alcoolique sans troubles hydro-électrolytiques. NPG. 2007;7(37):30-33.
- RUIZ.S, NIQUET. L, VERGNE.S, LATHUILE. D, CAMPISTRON. J, ALZIEU.M. Hyponatrémie sévère et myélinolyse centropontine: attention aux cofacteurs! Ann Fr Anesth Reanim. 2009;28:96-99.
- SEISER A, SCHWARZ S, AICHINGER-STEINER MM. Parkinsonism and dystonia in central pontine and extrapontine myelinolysis. J Neurol Neurosurg Psychiatry. 1998;65:119-21.
- SOTO-ARES G, DAÏDONE C, CLARISSE J, PRUVO JP. Imagerie des lésions encéphaliques liées à l’alcool. Feuillets de Radiol. 1998;38:441-62.
- STERNS RH, RIGGS JE, SCHOCHET JR. SS. Osmotic demyelination syndrome following correction of hyponatremia. N Engl J Med. 1986;314:1535-42.
- SUGIMOTO T, MURATA T, OMORI M. Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa. J Neurol Neurosurg Psychiatry. 2003;74:353-5.