
|
|
|
CASE REPORT / CAS CLINIQUE
RHABDOMYOSARCOME PARA VERTEBRAL : CAUSE RARE DE COMPRESSION MEDULLAIRE
PARAVERTEBRAL RHABDOMYOSARCOMA : RARE ETIOLOGY OF SPINAL CORD COMPRESSION
E-Mail Contact - SALAM Siham :
salamsiham@yahoo.fr
RESUME Le rhabdomyosarcome est la tumeur maligne mésenchymateuse la plus fréquente chez l’enfant. Il se voit essentiellement au niveau des extrémités et la sphère ORL. La localisation paravertébrale avec compression médullaire est beaucoup plus rare. Les auteurs rapportent un cas de rhabdomyosarcome paravertébral avec extension endocanalaire et compression médullaire. Il s’agit d’une fille âgée de 6 ans admise pour un tableau de compression médullaire. L’examen clinique retrouve une patiente paraplégique avec niveau sensitif T8, des réflexes ostéo-tendineux abolis et une contracture des muscles paravertébraux. L’IRM médullaire montre un processus tissulaire à point de départ musculaire paravertébral droit, de signal hétérogène avec extension intra-canalaire et compression médullaire. La patiente a eu une laminectomie avec biopsie chirurgicale. L’étude histologique a posé le diagnostic d’un rhabdomyosarcome alvéolaire. La patiente a été traitée par chimiothérapie suivie d’une radiothérapie. L’IRM de contrôle a montré une régression totale du processus tumoral. Après un recul d’une année, la patiente a présenté une récidive locale avec métastases pulmonaires. Malgré cette localisation rare, le rhabdomyosarcome doit être évoqué devant un processus paravertébral avec extension épidurale et compression médullaire chez l’enfant. Mots clés: rhabdomyosarcome, IRM, compression médullaire. ABSTRACT Rhabdomyosarcoma is the most common malignant mesenchymal tumor in children. It is seen mainly in the extremities, head and neck. Paravertebral location with spinal cord compression is much rarer. The authors report a case of paraspinal rhabdomyosarcoma with epidural extension and spinal cord compression. A 6 year-old girl presented with back pain at the level of T8 and paraplegia. Clinical examination revealed paraplegia with a sensory level paraplegic patient with T8, abolished tendon reflexes and spasm of paraspinal muscles. Magnetic resonance imaging (MRI) revealed a paraspinal mass arising from the right paravertebral muscle, in heterogeneous signal with epidural extension and spinal cord compression. The patient had a laminectomy with surgical biopsy. Histological examination confirmed the diagnosis of alveolar rhabdomyosarcoma. The patient was treated with chemotherapy followed by radiotherapy. MRI control showed a complete regression of tumor. After one year, the patient developed a local recurrence with lung metastases. Despite this unusual location, rhabdomyosarcoma should be included in differential diagnosis of a process with paravertebral epidural extension and spinal cord compression in children. Keywords: rhabdomyosarcoma, MRI, spinal cord compression. INTRODUCTION Le rhabdomyosarcome (RMS) est la tumeur maligne des parties molles la plus fréquente chez l’enfant, C’est une tumeur agressive et rapidement métastatique. Il siège essentiellement au niveau des extrémités, la sphère ORL et urogénitale. La localisation paravertébrale avec extension endocanalaire est très rare (6). Nous rapportons un cas de rhabdomyosarcome paravertébral chez une fille de 6 ans révélé par un tableau de compression médullaire avec revue de la littérature. OBSERVATION Il s’agit d’une petite fille âgée de 6 ans sans antécédent pathologique particulier, qui s’est présentée pour une paraplégie survenue 48 heures avant son admission. Les parents rapportent la notion d’une paraparésie avec des troubles sphinctériens qui remontent à 1 mois. L’examen clinique retrouve une patiente paraplégique avec niveau sensitif T8, des réflexes ostéo-tendineux abolis et une contracture des muscles paravertébraux. L’imagerie par résonance magnétique (IRM) médullaire montre un processus tissulaire à point de départ musculaire paravertébral droit, de signal hétérogène, en hyposignal T1 et en discret hypersignal T2 par rapport aux structures musculaires (fig.n°1). Il présente une extension intra-canalaire à travers les foramens de conjugaison en regard de T9-T10-T11-T12 et L1, et exerce une compression du cordon médullaire. Il s’étend également en arrière à travers le plan musculaire en regard des apophyses épineuses. L’injection de gadolinium montre une prise de contraste nette et hétérogène. Il existe aussi des anomalies de signal vertébrales sous forme d’un hypersignal T2 et d’un rehaussement par le gadolinium témoignant d’un envahissement vertébral par contiguïté (fig.n°2,3). La patiente a eu une laminectomie avec biopsie chirurgicale intéressant le processus tumoral et une vertèbre en regard. L’étude histologique des prélèvements de la biopsie a mis en évidence une prolifération tumorale maligne faite de cellules disposées en travées souvent écrasées et étirées (8). Les cellules avaient des noyaux allongés, étirés, écrasés et hyperchromatiques. Le diagnostic d’un rhabdomyosarcome alvéolaire paravertébral avec extension intracanalaire a été retenu devant une desmine et l’anti-myogénine très positives (fig.n°4). La patiente a été traitée par chimiothérapie première suivie d’une radiothérapie. Après 2 mois, l’évolution était marquée par la régression de la paraplégie et des troubles sphinctériens. L’IRM de contrôle a montré une régression totale du processus tumoral (fig.n°5). Après un recul d’un an, la patiente a présenté une récidive locale prévertébrale en regard de T8-T9-T10 et T11 sous forme d’une masse tissulaire prévertébrale bien limitée avec métastases pulmonaires (fig.n°6). DISCUSSION Le rhabdomyosarcome représente 67% des tumeurs mésenchymateuses malignes et 10% des tumeurs solides chez l’enfant (2). Le pic d’incidence se situe entre l’âge de 2 et 5 ans. Un second pic d’incidence est présent à l’adolescence entre 15 et 19 ans (8). Cette tumeur est caractérisée par une fréquence plus marquée chez le garçon (sex ratio à 1,6). Son origine est la cellule embryonnaire mésenchymateuse, ce qui explique qu’il puisse se retrouver partout dans l’organisme: tête et le cou (43%), la sphère urogénitale (21%), les extrémités (18%), le tronc et le rétropéritoine (18%). Notre observation se distingue par la localisation paravertébrale avec extension intra-canalaire qui est très rare. Fountas et al sont les premiers à rapporter une localisation para vertébrale avec extension endocanalaire du rhabdomyosarcome chez un homme de 47 ans (3). Histologiquement, le RMS se traduit par une prolifération tumorale maligne de cellules à différenciation morphologique et/ou phénotypique musculaire striée. Les cellules caractéristiques de cette tumeur sont les rhabdomyoblastes, cellules légèrement allongées avec des stries croisées intracellulaires et un cytoplasme éosinophile (8). Ces caractéristiques sont des signes de maturité myoblastique. Schématiquement, on distingue : -Le RMS embryonnaire qui constitue la forme la plus fréquente de pronostic intermédiaire, avec une survie globale de 66 % à 5 ans (2). Dans ce type particulier, on isole deux sous-types : le RMS botryoïde et le RMS à cellules fusiformes. -Le RMS alvéolaire représente 20 à 25 % des RMS, plus fréquent au niveau des membres et du tronc (60 %). Cette forme est de mauvais pronostic, souvent métastatique au moment du diagnostic, avec une survie globale à 54 % dans les formes localisées (1,8). -Le RMS indifférencié dont la présence de marqueurs myogéniques (desmine et/ou myoglobine) et l’utilisation de marqueurs immuno-histochimiques comme la Myo-D1 et la Myf-4 permettent de confirmer le caractère musculaire et de poser le diagnostic de RMS. Cette forme est de mauvais pronostic avec une survie globale à 5 ans de 40 % (6,8). L’étude en biologie moléculaire permet de rechercher sur la tumeur -par reverse trans-criptase-polymerase chain reaction (rt-PCR)- les translocations (2;13)(q35;q14) et (1;13)(p36;q14) qui se voit respectivement dans 55 et 22% des rhabdomyosarcomes alvéolaires permettant d’établir des éléments pronostiques. Ces transcrits ne sont pas retrouvés dans la forme embryonnaire (8). Notre patiente avait un rhabdomyosarcome de type alvéolaire. Cliniquement, le rhabdomyosarcome paravertébral se manifeste par des douleurs dorsolombaires intermittentes, des difficultés à la marche, des troubles sphinctériens type incontinence urinaire ou rétention aigue d’urine, une paraparésie et / ou paraplégie, parfois associé à un niveau sensitif (1,4). Au scanner, il s’agit fréquemment d’une simple augmentation de volume, de densité souvent identique à celle du muscle normal. Parfois, la lésion est hypodense et mal définie avant injection de produit de contraste, sauf pour le rhabdomyosarcome embryonnaire. D’éventuelles zones nécrotiques peuvent être rencontrées, sans spécificité. Des calcifications peuvent être visualisées ainsi qu’une destruction corticale (4,9). Dans notre observation, il n’y avait pas de calcifications. L’IRM montre en T1 une lésion tissulaire en iso ou hyposignal par rapport aux structures musculaires de voisinage. Le rehaussement tumoral après injection de gadolinium attire l’attention (9). En T2, la lésion est en hypersignal franc. La lésion se développe aux dépens des muscles para vertébraux et pénètre le canal médullaire à travers les foramens de conjugaison, refoule le fourreau dural et la moelle, qui est comprimée. Parfois, on peut aussi noter des anomalies de signal au niveau des corps vertébraux en rapport avec leur envahissement (4). Notre patiente avait des anomalies de signal vertébrales témoignant d’un envahissement par contiguïté. Le diagnostic doit être évoqué de principe chez l’enfant devant toute lésion solide infiltrante des tissus mous. L’IRM affirme le diagnostic de tumeur solide des tissus mous et réalise un bilan d’extension locorégionale précis et guide la biopsie. Cette dernière est nécessaire pour poser le diagnostic de rhabdomyosarcome. L’extension se fait par contiguïté et à distance. Le rhabdomyosarcome est une tumeur agressive avec une possibilité de métastases au niveau des poumons, l’os, et le cerveau (2,5,10). Le diagnostic différentiel d’un rhabdomyosarcome paravertébral chez l’enfant peut se poser avec : -Un sarcome d’Ewing vertébral: dans ce cas, le contingent tumoral dans les parties molles peut être important dans les localisations rachidiennes, avec une atteinte osseuse plus discrète (4). -Un neuroblastome médian avec extension endocanalaire: le dosage des catécholamines urinaires permet d’orienter le diagnostic. -Un neurofibrome peut présenter cette topographie à cet âge, le plus souvent dans le cadre d’une neurofibromatose. L’infiltration des parties molles postérieures évoquerait une dégénérescence en neurofibrosarcome (7). -Les localisations osseuses et notamment rachidiennes sont possibles dans les lymphomes non hodgkiniens. Le contingent tumoral dans les parties molles est possible, mais plus exceptionnel (4). Le traitement du rhabdomyosarcome associe chimiothérapie, radiothérapie et chirurgie (11,12). Le pronostic dépend du type histologique (botryoïde :80% de survie à 5 ans, embryonnaire: 50%, pléomorphe:35%, alvéolaire; 15%); du site (génito-urinaire: 80% de survie à 5 ans, rétro péritonéale; 12%); la taille (< 3 cm: 51% de survie à 5 ans, >5 cm: 30%); la stadification; le traitement (chirurgie radicale: 52% contre 29% pour la chirurgie partielle; ainsi que l’association chimio-radiothérapie: 54% contre la chimiothérapie seule: 26% de survie à 5 ans) (1,11). CONCLUSION Le rhabdomyosarcome doit être évoqué devant un processus tumoral des parties molles paravertébrales avec extension épidurale et compression médullaire chez l’enfant (3). Le diagnostic est confirmé par la biopsie. Le traitement associe une chimiothérapie complétée par radiothérapie. Le pronostic dépend du type histologique: le type alvéolaire est de mauvais pronostic (2). Figures: 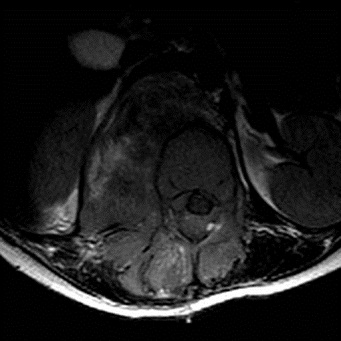 Fig n°1 : Coupe axiale T1. Processus tissulaire à point de départ musculaire paravertébral droit, de signal hétérogène avec extension intra-canalaire. 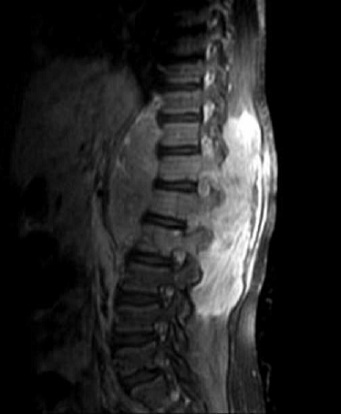 Fig n°2 : Coupe sagittale T2. Extension intracanalaire extradurale en regard de T11-L1avec hypersignal des corps vertébraux témoignant de leur envahissement. 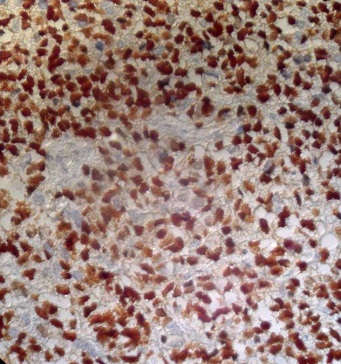 Fig n°4 : Examen immunohistochimique, anticorps anti-myogénie (Clone 5FD, Dako), grossissement x20 : Les cellules tumorales expriment l’anticorps anti-myogénine (expression nucléaire). 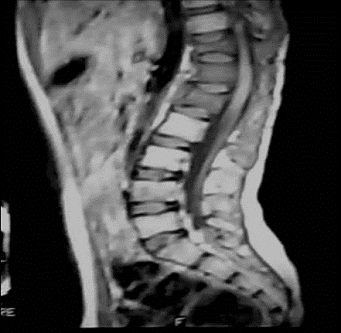 Fig n° 5 : IRM de contrôle en coupe sagittale T2 montre la régression du processus tumoral. 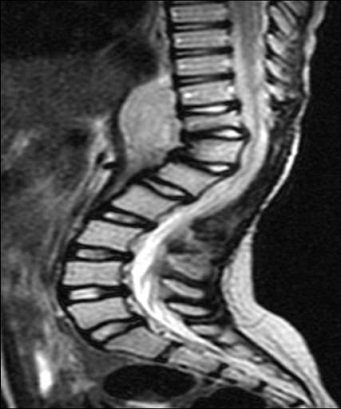 Fig n° 6 : IRM de contrôle en coupe sagittale T2 montre la récidive prévertébrale du processus tumoral en regard de T10-L2. BIBLIOGRAPHIE
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647