CLINICAL STUDIES / ETUDES CLINIQUES
LA MALADIE DE NEURO-WILSON – A PROPOS DE SEPT CAS ET REVUE DE LA LITTERATURE
NEURO-WILSON DISEASE - ABOUT SEVEN CASES AND REVIEW OF THE LITERATURE
- Service de Neurologie, CHU Hassan II, Fès, Maroc
- Service de Pédiatrie, CHU Hassaan II, Fès, Maroc
- Service de Radiologie, CHU Hassan II, Fès, Maroc
E-Mail Contact - EL MACHKOUR Meriem :
RESUME
Description
La maladie de Wilson est une toxicose cuprique autosomique récessive dont les manifestations cliniques sont dominées par les signes neuropsychiatriques et hépatiques.
Objectif
L’objectif de notre travail est de faire le point sur les aspects génétique, diagnostique et thérapeutique du Neuro-Wilson.
Méthodes
Nous avons procédé à l’étude d’une série de sept cas colligés au service de Neurologie et de Pédiatrie du CHU Hassan II de Fès.
Résultats
Tous nos patients présentaient des signes neurologiques évocateurs avec ou sans symptôme extra-neurologique. Ils ont eu des examens paracliniques faits de Numération Formule Sanguine, bilan hépatique, bilan rénal, bilan cuprique, imagerie cérébrale, échographie abdominale et fibroscopie digestive haute. Le diagnostic positif de la maladie de Wilson a été retenu devant des arguments cliniques, biologiques et radiologiques. Trois de nos malades ont été mis sous D-pénicillamine et quatre sous sulfate de zinc. L’enquête familiale à la recherche de cas similaires a été réalisée par l’examen clinique de la fratrie de quatre malades de la série.
Conclusion
Lorsqu’elle n’est pas traitée, l’évolution de la maladie de Wilson est toujours fatale. Le traitement repose sur les chélateurs du cuivre, les sels de zinc et la transplantation hépatique. Le pronostic de la maladie de Wilson apparaît d’autant meilleur que les atteintes neurologique et hépatique sont moins prononcées.
Mots-clés : Maladie de Wilson, manifestations neurologiques, génétique, Bilan cuprique, Anneau de Keyser-Fleischer, D-pénicillamine, Sulfate de zinc
SUMMARY
Description
Wilson disease is an autosomal recessive disorder of copper overlap, dominated by neuropsychiatric and hepatic symptoms.
The aim of this study is to review the genetic aspects, diagnosis and treatment of Neuro-Wilson.
Methods
We report seven cases collected in the department of Neurology and Pediatrics CHU Hassan II of Fez.
Results
All patients had neurological signs with or without extra-neurological symptoms. They had complete blood count, liver function, renal balance, copper balance, brain imaging, abdominal ultrasound and upper gastrointestinal endoscopy. The diagnosis of Wilson’s disease was based on clinical, biological and radiological results. Three patients were treated with D-penicillamin and the others received the zinc. The family survey in search of similar cases was carried out by clinical examination of siblings of four patients.
Conclusion
When left untreated, the evolution of Wilson’s disease is always fatal. Treatment is based on the chelating copper, zinc salts and liver transplantation [7].The prognosis of Wilson’s disease appears even better than the neurological and liver symptoms are not pronounced.
Keywords: Wilson disease, neurological manifestations, cupric balance, Keyser-Fleischer ring, genetics, D-penicillamin, zinc salts.
INTRODUCTION
La maladie de Wilson ou « dégénérescence hépato-lenticulaire » est une affection génétique rare, de transmission autosomique récessive, caractérisée par une accumulation tissulaire de cuivre libre, essentiellement dans le foie, le cerveau et l’il. Elle résulte de mutations du gène de Wilson, localisé sur le chromosome 13 et codant pour la protéine ATP7B qui assure le transport du cuivre dans l’hépatocyte et donc son élimination dans la bile [57].
Le diagnostic de maladie de Wilson peut être difficile à établir du fait de l’hétérogénéité des signes cliniques et du manque de spécificité des paramètres biologiques. Mais, fait rare pour une maladie génétique, il existe un traitement efficace. Toutefois, tout retard dans le diagnostic expose le patient à des atteintes irréversibles. Or dans les formes neurologiques, un délai moyen de deux ans persiste encore actuellement entre les premiers symptômes et le diagnostic de la maladie [48].
MATERIELS ET METHODES
Dans ce travail, nous étudions une série de sept cas colligés au service de Neurologie et de Pédiatrie du centre hospitalo-universitaire Hassan II de Fès, dans le but de réévaluer cette pathologie sur le plan clinique, paraclinique et thérapeutique.
Tous les malades ayant des symptômes neurologiques évocateurs avec ou sans symptôme extra-neurologique ont été inclus dans cette étude.
Les sept malades ont eu des examens paracliniques comprenant :
– Numération formule sanguine
– Bilan hépatique
– Bilan rénal
– Bilan cuprique
– Imagerie cérébrale
– Echographie abdominale et fibroscopie digestive haute.
Le diagnostic positif de la maladie de Wilson a été retenu devant des arguments cliniques, biologiques et radiologiques.
Sur le plan thérapeutique, trois de nos malades ont été mis sous D-pénicillamine et quatre Sous sulfate de zinc. Dans les deux cas le traitement a été entrepris de façon progressive au cours de l’hospitalisation avec dose d’entretien gardé à la sortie de l’hôpital avec une surveillance clinique rapprochée.
Vu le caractère génétique et héréditaire de cette pathologie, l’enquête familiale à la recherche de cas similaires a été réalisée par l’examen clinique de la fratrie de quatre malades de la série, cependant les autres fratries n’ont pas été examinées par non coopération de la famille.
OBSERVATIONS
Cas N°1
Patiente de 18 ans, issue d’un mariage consanguin de premier degré, deuxième d’une fratrie de huit, ayant comme antécédent un épisode d’ictère et une aménorrhée primaire, admise pour une apraxie de la marche avec troubles de la déglutition apparus à l’âge de 17 ans, compliqués six mois plus tard d’une dysarthrie puis hypersialorrhée et mutisme. L’examen retrouve, en plus, une vivacité des réflexes ostéo-tendineux aux membres inférieurs, une abolition du réflexe nauséeux et une apraxie d’habillage. L’examen ophtalmologique à la lampe à fente a révélé un anneau de Kayser-Fleischer bilatéral. Le bilan biologique montre une thrombopénie à 85 mille par millimètre cube, un taux d’hématocrite abaissé à 2% et un taux de prothrombine abaissé à 32%. Le bilan cuprique est perturbé avec une cuprémie basse à 0.8 mg/l et une céruléoplasmine effondrée inférieure à 0.07g/l. L’imagerie par résonnance magnétique (IRM) cérébrale montre un hypersignal bilatéral et symétrique en séquence pondérée T2 des noyaux gris centraux en particulier les putamens et les noyaux caudés (Fig. 1). L’échographie abdominale objective un foie hétérogène de contours irréguliers avec hypertrophie du lobe gauche, sans splénomégalie, ni dilatation du tronc porte. La fibroscopie-oeso-gastroduodénale (FOGD) a montré la présence de trois cordons variqueux stade II au tiers inférieur de l’sophage. Un traitement à base de D-pénicillamine a été instauré à doses croissantes arrivant à 1g/j, associé à un régime alimentaire pauvre en cuivre et un traitement préventif des varices sophagiennes à base de béta-bloquant. L’évolution a été marquée par la régression des signes neurologiques avec persistance de l’anneau de Kayser-Fleischer.
Cas N°2
Enfant de 10 ans, issu d’un mariage consanguin, ayant comme antécédents deux surs décédées suite à la maladie de Wilson, admis pour dystonie des quatre membres remontant à trois mois, compliquée de dysphagie et de syndrome cérébelleux avec dysmétrie et dysarthrie. L’examen ophtalmologique à la lampe à fente a révélé un anneau de Kayser-Fleischer bilatéral. Le bilan biologique a montré une thrombopénie à 78 mille par millimètre cube, un taux de prothrombine abaissé à 84% et une cytolyse hépatique. Le bilan cuprique était perturbé avec une cuprémie basse à 0.32 mg/l et une céruléoplasmine effondrée inférieure à 0.1g/l. La tomodensitométrie cérébrale a montré une hypodensité des deux putamens et une discrète calcification des deux pallidums. L’échographie abdominale a mis en évidence une hypertension portale avec foie hétérogène. Le traitement avec D-pénicillamine à raison de 250 mg/j a été instauré. Deux mois plus tard, il a été remplacé par le sulfate de zinc, pour des raisons de disponibilité. L’évolution a été marquée par une régression modérée des signes cliniques. Dans le cadre de l’enquête familiale, l’examen clinique de la fratrie ne montre pas d’anomalies.
Cas N°3
Jeune de 17 ans, issu d’un mariage consanguin de premier degré, sans antécédents pathologiques notables, admis pour troubles du comportement, des crises de rire avec hypersialorrhée, dysphagie, trouble du langage, troubles de la marche avec apparition progressive d’un retard intellectuel. L’examen a trouvé un syndrome tétrapyramidal et une hypertonie généralisée avec phénomène de roux dentée. L’examen ophtalmologique à la lampe à fente a révélé un anneau de Kayser-Fleischer bilatéral. Le reste de l’examen somatique note une splénomégalie. Le bilan biologique montre une anémie modérée (Hb= 10.3g /dl), hypochrome (CCMH= 30.5g /dl), normocytaire (VGM= 84µmcube) et une thrombopénie à 87 mille par millimètre cube. Le bilan cuprique était perturbé avec une cuprémie basse à 0.30 mg/l, une céruléoplasmine effondrée inférieure à 0.1g/l et une cuprurie de 24h élevée à 1324µg/24h (Normale inférieure à 50µg/24h ou inf. à 0.8 µmol/24h). L’IRM cérébrale a montré un hyposignal en T1 et un hypersignal en T2 des deux putamens (Fig 2), des deux locus niger, des deux capsules internes, du mésencéphale et du pons, respectant les noyaux rouges. L’échographie abdominale a mis en évidence un foie hétérogène de contours irréguliers, avec une splénomégalie faisant évoquer une hypertension portale sur foie de cirrhose. La FOGD a montré deux cordons variqueux stade II au niveau du tiers inférieur de l’sophage. Le traitement avec D-pénicillamine (CUPRIPEN 250 mg) a été instauré à doses croissantes, arrivant à 2cp/j associé à un traitement préventif de rupture des varices sophagiennes (Avlocardyl 40mg 1/2cp/j). Un an plus tard, il a été remplacé par le sulfate de zinc (ZINKASKIN 45mg 1cp*2/j) pour des raisons de disponibilité. L’évolution a été marquée par une amélioration totale des troubles de la déglutition et une amélioration considérable des autres signes cliniques. Chez la fratrie l’examen clinique a été strictement normal.
Cas 4
Patiente de 17 ans, ayant comme antécédent un épisode d’ictère à l’âge de 5 ans, une aménorrhée primaire et deux surs décédées suite à la maladie de Wilson, admise pour troubles de la marche, un syndrome extra-pyramidal akinéto-rigide et une diminution progressive du rendement scolaire, remontant à trois mois. L’examen abdominal a retrouvé une splénomégalie. L’examen ophtalmologique à la lampe à fente a révélé un anneau de Kayser-Fleischer bilatéral. Le bilan biologique a montré une anémie modérée (Hb= 9.6g /dl), normochrome (CCMH= 32.5g /dl), microcytaire (VGM= 74µmcube). Le bilan cuprique a montré une cuprémie et céruléoplasmine basse avec cuprurie de 24h augmentée. L’IRM a montré un hypersignal bilatéral et symétrique en séquence pondérée T2 des noyaux gris centraux, du mésencéphale et du tegmentum de façon bilatérale et symétrique avec respect des deux noyaux rouges. On a noté également la présence d’une lésion nodulaire centimétrique cortico-sous-corticale pariétale droite, en hyposignal T1, hypersignal T2, en faveur d’un dépôt paramagnétique. L’échographie abdominale objective une volumineuse splénomégalie, un foie hétérogène de contours irréguliers avec un épanchement intra-péritonéal minime. La FOGD n’a pas montré d’anomalies. Un traitement à base de sulfate de zinc (ZINASKIN 45mg) a été instauré à raison d’un comprimé trois fois par jour, avec excellente tolérance. L’évolution a été marquée par une stabilisation de la symptomatologie. Sous traitement, la patiente a présenté des troubles psychiatriques à type d’agressivité et de désinhibition, ayant répondu au neuroleptique (HALDOL).
Cas N°5
Patient de 18 ans, quatrième d’une fratrie de huit, admis pour dystonie des membres inférieurs plus marqué à gauche avec irritation tétrapyramidale évoluant depuis un an. Le bilan cuprique a été perturbé avec une cuprémie basse à 8.6 µmol/l et une céruléoplasmine effondrée inférieure à 0.14g/l. L’IRM cérébrale a montré un hypersignal T2 bilatéral et symétrique des bras postérieurs des capsules internes et des pédoncules cérébraux. Un traitement à base de sulfate de zinc (ZINASKIN 45mg 1cp*2/j) associé à un myorelaxant (Baclofène) ont été instaurés. L’évolution a été marquée par une aggravation progressive de la dystonie empêchant la marche, l’habillage et l’alimentation autonomes.
Cas N°6
Enfant âgé de 13 ans, admis pour dysarthrie avec trouble de la marche et tremblement depuis 1 an associé à une hypersialorrhée, épistaxis récidivant et fléchissement du rendement scolaire. L’examen a trouvé une amimie, une bouche entrouverte donnant un aspect de sourire permanent, un syndrome extrapyramidal fait de dysarthrie, rigidité axiale et tremblement de repos ainsi qu’une splénomégalie à un travers de doigt. L’examen ophtalmologique à la lampe à fente a révélé un anneau de Kayser-Fleischer bilatéral. Le bilan biologique a montré une thrombopénie à 6700 par millimètre cube et un taux de prothrombine abaissé à 56%. Le bilan cuprique est perturbé avec une cuprémie basse à 0.38 mg/l, une céruléoplasmine basse inférieure à 0.1g/l et une cuprurie élevée à 175 µg par 24 heures (N<100). L'IRM cérébrale a montré un hyper signal T2 et FLAIR des 2 putamens. L'échographie abdominale a objectivé un aspect en faveur d'une HTP sur fois de cirrhose. La fibroscopie-oeso-gastroduodénale (FOGD) a montré la présence de varices sophagiennes stade 2 à 3 avec gastropathie hypertensive modérée. L'enfant a été mis alors sous D-pénicillamine avec un régime sans cuivre. L'évolution a été marquée par une amélioration neurologique notamment la marche et la parole après 6 mois de traitement. Actuellement, il est sous Trolovol 3cp/j avec un recule d'un an et demi. Une enquête familiale a été réalisée chez la fratrie qui s'est révélé négative.
Cas N7
Enfant âgé de 12 ans, 3ème d’une fratrie de 4, ayant comme ATCD un frère âgé de 18 ans suivi en neurologie pour dysarthrie tremblement et syndrome hémorragique, admis pour asthénie avec syndrome oedémato-ascitique. Le début des troubles remontait à 1 an avant son hospitalisation par la survenue d’un syndrome hémorragique fait d’épisodes d’épistaxis, de gingivorragies et de melæna associé à une dysarthrie et hypersialorrhée. L’examen a noté une splénomégalie arrivant jusqu’à l’ombilic, une circulation veineuse collatérale, sans hépatomégalie. L’examen neurologique a trouvé un syndrome extrapyramidal avec dysarthrie et voie monotone et rigidité axiale. L’examen ophtalmologique à la lampe à fente révèle un anneau de Kayser-Fleischer bilatéral. Le bilan biologique a montré une thrombopénie à 77 milles par millimètre cube, un taux de prothrombine abaissé à 54%. Le bilan cuprique été perturbé avec une cuprémie basse à 0.11mg/l et une céruléoplasmine effondrée inférieure à 0.1g/l. La cuprurie est basse à 153µg/24h (N<100). L'IRM cérébrale a montré un hyper signal T2 et FLAIR des 2 putamens avec dilatation quadri-ventriculaire et légère atrophie du tronc et des hémisphères cérébelleux. L'échographie abdominale a mis en évidence une importante splénomégalie homogène et un foie diminué de taille discrètement inhomogène sans nodules. La FOGD a montré des varices oesophagiennes stade 1 et 2 avec une gastrite hypertensive. Le traitement avec D-pénicillamine à raison de 250 mg/j a été instauré. Deux mois plus tard, il a été remplacé par le sulfate de zinc pour des raisons de disponibilité. L'évolution a été marquée par une régression modérée des signes cliniques. Dans le cadre de l'enquête familiale, l'examen clinique de la fratrie n'a pas montré pas d'anomalies. L'enfant a été mis sous sulfate de zinc en attendant la D-pénicillamine : Zinaskin 1 cp 2/j avec AVLOCARDYL CP 40 mg ½ cp /j. L'évolution après 4 mois est restée stationnaire.
DISCUSSION
L’analyse des résultats de cette étude concerne les données cliniques, biologiques, et celles de l’imagerie. Nous étudierons également les options thérapeutiques disponibles pour stabiliser la maladie et éviter les dommages liés au cuivre sous réserve d’une bonne observance thérapeutique.
Notre étude a intéressé sept malades ; cinq garçons et deux filles, dont l’âge moyen est de 16 ans avec des extrêmes allant de 10 ans à 18 ans, en effet la maladie de Wilson est une affection de l’enfant, de l’adolescent et de l’adulte jeune. La majorité des cas débute entre 5 et 35 ans, en moyenne vers 17 ans [22] [26] [41]. Le diagnostic de la maladie de Wilson doit être suspecté en neurologie devant tout syndrome extrapyramidal avant l’âge de 50 ans. Il n’y a pas de prédominance de sexe [41] [33] comme l’attestent les résultats de notre série.
La notion de consanguinité du premier degré, fréquente dans notre pays, suggère fortement le rôle favorisant de la consanguinité dans la maladie de Wilson qui est une affection autosomique récessive [20] comme on le note dans trois cas de la série (Les parents sont cousins germains dans les cas (1, 2, 3), néanmoins les formes non familiales, comme celles retrouvées chez 4 de nos patients, ont été décrites dans plusieurs travaux [5] [9] [11] [23]. L’interrogatoire fait dégager certains antécédents, à savoir un épisode d’ictère pendant le jeune âge chez deux malades, deux patients ayant deux surs décédées suite à la maladie de Wilson et l’antécédent de syndrome hémorragique chez un patient. L’existence d’un antécédent de la maladie de Wilson dans la fratrie ou d’une consanguinité parentale est un bon élément d’orientation diagnostique.
Le dépistage familial révèle le plus souvent des cas asymptomatiques chez qui une thérapie adaptée permet parfois même d’échapper à cette maladie. Une avancée dans ce domaine a été rapportée par une équipe japonaise qui recommande le dépistage dès l’âge de trois ans par un anticorps spécifique l’holocéruléoplasmine [58].
Plusieurs étapes ont marqué l’étude génétique de la maladie de Wilson. D’abord le gène a été localisé sur le chromosome 13 en 1985, grâce à une étude de liaison menée dans une fratrie arabo-juive [28]. Puis le gène a été identifié en 1993 grâce au travail de trois équipes différentes [3] [17] [47]. Enfin, grâce au développement de divers marqueurs l’intervalle dans lequel se trouvait le gène a pu être précisé en position 914 du bras long du chromosome 13 (locus 13q 14.3), le gène s’étend sur 80 Kb d’ADN génomique avec une région codante de 4.1 Kb qui comprend 21 exons [45], avec une transcription de l’ARN m d’environ 7.5 Kb qui comprend des régions flanquantes non traduites [43]. En 1995, le produit du gène fut définitivement identifié et nommé protéine ATP7B qui est une ATP ase de transport du cuivre. Le gène a été appelé ATP 7B, il est exprimé essentiellement dans le foie, le cerveau et les reins [56]. La protéine ATP7B est défectueuse voire absente. Le cuivre n’atteint donc ni es canalicules biliaires ni le site de synthèse de la céruloplasmine. II en découle une diminution de l’excrétion biliaire du cuivre hépatique et un effondrement de la céruloplasmine qui est rapidement dégradée en raison de l’absence d’incorporation du cuivre. La balance cuprique est donc positive. Depuis son clonage, plus de 300 mutations ont été identifiées mais certaines sont extrêmement rares [43]. mutations les plus fréquemment rencontrées sont his 714gln [1]. La mutation his1069Gln de l’exon 14 est fréquente dans la population européenne. Cette forme, considérée comme pathognomonique de la maladie, est corrélée le plus souvent à des formes neurologiques tardives. Les mutations liées à l’exon 8 seraient plutôt corrélées aux formes hépatiques [24]. Récemment une étude analytique Taiwanaise a montré que la plupart des mutations ont été détectées sur les exons 8 ; 11 ; 12 ; 13 ; 16 ; 17 et 18 [39].
Le délai moyen du diagnostic de la maladie dans notre série est de 9 mois comparé à celui de 2,45 ans dans la série de Bono.W et al et 8 ans dans la série de Walsche et Yealland [53]. Il est très important que le diagnostic soit fait précocement, afin de pouvoir traiter le plus tôt possible [54].
L’atteinte neurologique de la maladie de Wilson existe chez environ 40-50% des patients, elle s’installe de façon insidieuse et s’aggrave progressivement. Plus rarement, l’évolution est marquée par des phases d’amélioration transitoires.
Les signes neurologiques de la maladie sont inauguraux chez 76% des patients [16] 71.4% dans la série de Bono.W [10] et 80% dans notre série.
Les manifestations neurologiques sont motrices et témoignent de l’atteinte des noyaux gris centraux et du tronc cérébral. Les manifestations les plus fréquentes sont le tremblement (80%), la dysarthrie (56%) de nature extrapyramidale, associés à une hypersalivation et un aspect de grimace sardonique. Le tableau neurologique peut comporter aussi un syndrome parkinsonien (45% à 55%) qui associe un syndrome dystonique et un syndrome akinéto-rigide [38], le syndrome pseudobulbaire (20%) avec fausse routes et labilités émotionnelle, les troubles de la marche (30%), les troubles de tonus (40%) et l’apraxie prendront des aspects particuliers en fonction de la forme clinique réalisée [7] [31].
Dans notre série, les signes neurologiques sont présents dans tous les cas, en citant les symptômes par ordre de prédominance : troubles de la marche survenus chez 80% des patients, une marche spastique avec des mouvements dystoniques a été observée chez 40% des patients, la dysphagie et le trouble de déglutition existaient chez 60% des patients; la dysphagie s’est associée à une abolition de réflexe nauséeux due à l’atteinte du nerf glosso-pharyngien dans un cas.
Le syndrome extrapyramidal présent dans 60% des cas, occasionne une dysarthrie avec une voix monocorde, trouble de langage avec élocution difficile et manque de mots, dans un cas l’examen clinique a trouvé un syndrome extrapyramidal akinéto-rigide.
L’hypertonie a été observée chez 40% des patients, elle est de type pyramidal généralisé occasionnant une marche spastique, soit de type extrapyramidal avec phénomène de la roue dentée.
Les mouvements dystoniques ont été observés dans 40% des cas et sont plus marqués aux extrémités (mains et pieds).
D’autres signes ont été notés chez les malades de la série; un syndrome pyramidal fait de trépidations épileptoïdes bilatérales dans un cas, un trouble de la coordination d’origine cérébelleuse dans un cas et des mouvements anormaux à type de myoclonies et de torticolis spasmodique chez un malade. Ces résultats sont identiques à ce qui est rapporté dans la littérature [31] [38].
Les troubles psychiatriques sont probablement sous estimés et sont inauguraux dans 14 à 20% des cas, 19% des cas dans la série de Bono et al. Il peut s’agir de troubles de la personnalité ou du comportement; labilité émotionnelle, impulsivité, agressivité, désinhibition troubles de l’humeur surtout sur un mode dépressif [2] [7] [34] [50]. L’amélioration de l’état psychiatrique peut survenir avec la réduction de l’excès de cuivre mais la prescription des psychotropes peut s’avérer nécessaire [29]. Dans un cas de notre série, on note une euphorie, un trouble de comportement et un désintérêt de l’activité scolaire avec recours à un traitement adéquat.
L’atteinte hépatique symptomatique ou non est très fréquente dans la maladie de Wilson et le mode de révélation est variable. Dans notre série elle était présente chez 80% des patients contre 40% dans la série de Walshe et Yealland et 85.7% dans celle de Bono.W et al. Cliniquement, on a constaté une splénomégalie dans 60% des cas sans épisode d’hémorragie digestive haute. L’échographie abdominale a objectivé un aspect d’hypertension portale chez 60% des malades. La fibroscopie digestive haute a mis en évidence des cordons variqueux stade II au 1/3 inférieur de l’sophage dans 40% des cas, chez qui un traitement à base de bétabloquant a été administré pour prévenir la progression et la rupture des varices sophagiennes. Une élévation des transaminases a été notée dans un cas (cas 2), l’élévation des transaminases est habituellement inférieure à 10 fois les valeurs normales, contrairement à ce qui est observé dans les autres types d’hépatite [8].
Les manifestations ophtalmologiques sont dominées par la présence de l’anneau cornéen de Kayser Fleischer, qui est rare avant l’âge de sept ans [25]; il reflète la surcharge en cuivre de la membrane de Descemet, visible à la lampe à fente, coloré en vert, brun ou doré. Il est quasi-constant en cas d’atteinte neuropsychiatrique. Dans notre série, il est retrouvé de façon bilatérale dans 80% des cas. Il a été décrit de façon exceptionnelle en dehors de la maladie, dans certains cas de cholestase très prolongée. Willeit et al et Demirkan et al ont rapporté deux observations de Neuro-Wilson sans manifestations ophtalmologiques comme l’est le cas chez un de nos patients [56]. La formation ou non de l’anneau de Kayser-Fleischer est influencé par le phénotype de la mutation génétique, notamment la mutation H 1070 Q [49] [54].
Les manifestations hématologiques consistent en une anémie hémolytique à test de Coombs négatif [37] dont le mécanisme est assimilé aux hémolyses chez les cirrhotiques, dont le caractère est à la fois corpusculaire et extra-corpusculaire. Parfois l’anémie est en rapport avec les anomalies du métabolisme du cuivre [21]. L’anémie hémolytique est rencontrée chez un de nos patients et la thrombopénie chez trois de nos patients. En effet, la survenue d’une anémie hémolytique aigu associée ou non à une thrombopénie et/ou des signes d’insuffisance hépatocellulaire voire une acidose tubulaire doit faire évoquer, en l’absence de diagnostic évident, la possibilité d’une maladie de Wilson [40].
Les manifestations endocriniennes décrites au cours de la maladie de Wilson sont l’aménorrhée, les avortements à répétition, l’hyperparathyroïdie, et l’intolérance au glucose. Dans notre série, on note une aménorrhée dans deux cas et une gynécomastie dans un cas.
Les manifestations rénales dont la physiopathologie est basée sur la perte rénale d’acides aminés avec défaut d’acidification rénale représentent 4% de la série de Bono.W et al et 3% d’une série japonaise [19]. Dans notre série, aucun cas d’atteinte rénale n’a été retrouvé.
Les manifestations cardiaques, souvent électrocardiographiques, sont présentes chez presque un tiers des malades. Les troubles du rythme sont rares, mais peuvent être sévères arrivant jusqu’à la fibrillation ventriculaire. Aucune atteinte cardiaque n’a été retrouvée dans notre série, ce qui a permis de les mettre sous bétabloquants comme traitement préventif primaire de varices sophagiennes.
D’autres manifestations, en particuliers ostéo-articulaires [19] [34] et cutanées [18] peuvent se voir dans la maladie de Wilson mais n’ont pas été rapportées chez les malades de notre série.
L’exploration biologique du métabolisme cuprique se fait par le dosage de la céruléoplasmine, du cuivre sérique, du cuivre urinaire sur les urines de 24heures et du cuivre hépatique après une biopsie. Le taux de la céruléoplasmine est effondré chez environ 80% des patients. Dans 10 à 15% des cas, son taux sera intermédiaire et approche la normale chez 5 à 10% [38]. Par ailleurs, jusqu’à 20% des porteurs hétérozygotes ont un taux bas de céruléoplasmine même s’ils ne vont pas développer la maladie de Wilson [32]. Le taux de céruléoplasmine dans notre série était effondré dans tous les cas avec un taux moyen inférieur à 0.1 g/l et des extrêmes de 0.07g/l et 0.14g/l pour une valeur de référence de 0.22 à 0.61g/l. Le taux de céruléoplasmine est également effondré dans deux autres maladies génétiques du métabolisme du cuivre : la maladie de Menkes et l’acéruléoplasminémie congénitale [27]. Le taux de céruléoplasmine peut donc constituer un facteur de suspicion de la maladie de Wilson et un taux inférieur à 20mg/dl est très en faveur du diagnostic.
Le cuivre total est diminué de façon corolaire au taux de céruléoplasmine, en revanche, le cuivre libre sérique est augmenté mais peut être normal ou augmenté [46]. Il est diminué dans tous les cas de notre série avec un taux moyen à 0.35mg/l pour une valeur normale de 0.73 à 2mg/l.
Chez les patients symptomatiques, le taux du cuivre urinaire est systématiquement élevé (supérieur à 100µg/24h) [51] [52]. Une élévation du cuivre se voit également en cas de cholestase hépatique. Un taux de cuivre urinaire inférieur à 50 µg/24h chez un patient systématiquement et en l’absence d’insuffisance rénale, exclut pratiquement le diagnostic de la maladie de Wilson [2]. La cuprurie de 24h a été dosée chez deux de nos patients et était très élevée avec un taux vers 1300µg/h.
Cette triade biologique caractéristique de la maladie de Wilson permet de poser le diagnostic et de démarrer un traitement. Cependant, lorsque les résultats des dosages sont douteux, on aura le recours à la mesure du cuivre sur un fragment de biopsie hépatique, qui n’a pas été faite chez les malades de notre série. A l’exception d’une pathologie hépatique obstructive, le taux de cuivre hépatique déterminé par biopsie hépatique permet de poser le diagnostic de maladie de Wilson. En général, chez les sujets symptomatiques ou asymptomatiques, le taux du cuivre dans le foie est supérieur à 250µg/g du tissu sec.
Dans la maladie de Menkès, le taux du cuivre hépatique est normal et dans l’acéruloplasminémie congénitale, il y a une surcharge du foie en fer. Ainsi la biopsie hépatique permet un diagnostic différentiel avec les autres maladies génétiques du métabolisme du cuivre [27] [6] et permet également de diagnostiquer une cirrhose hépatique.
La tomodensitométrie cérébrale, et au mieux l’imagerie par résonance magnétique, ont un apport important pour l’estimation de la sévérité de l’encéphale. Les lésions les plus fréquentes sont représentées par des hyposignaux en T1 et des hypersignaux en T2 et Flair, le plus souvent ces lésions sont multiples, symétriques et elles touchent les noyaux lenticulaires, le thalamus, la substance blanche et le noyau caudé. [4] [35] [36] [42]. Tous les malades de notre série ont bénéficié d’une imagerie cérébrale montrant des lésions focales représentées sur les séquences pondérées d’IRM par des hyposignaux en T1 et des hypersignaux en T2 et Flair.
Lorsqu’elle n’est pas traitée, l’évolution de la maladie de Wilson est toujours fatale. Le traitement repose sur les chélateurs du cuivre, les sels de zinc et la transplantation hépatique [15]. Les patients de notre série ont reçu un traitement pharmacologique avec un régime diététique pauvre en cuivre. Chez quatre d’entre eux, on a démarré par un traitement progressif en D-Pénicillamine substitué dans trois cas par du sulfate de zinc en raison de sa indisponibilité au Maroc. Les trois autres patients ont reçu d’emblée du sulfate de zinc. L’efficacité a été satisfaisante dans 80% des cas avec stabilisation voire amélioration des signes neurologiques.
Deux séries de cas rapportées dans la littérature [54] montrent qu’un traitement avec D-Pénicillamine permet d’obtenir une durée de survie voisine de celle de la population générale. Sous D-Pénicillamine, la majorité des patients se voit améliorée d’abord biologiquement puis cliniquement 3 à 6 mois après le début du traitement. De part son ancienneté et sa large utilisation, la D-Pénicillamine reste le traitement de référence de la maladie de Wilson malgré les effets secondaires qu’il peut engendrer notamment l’aggravation du tableau neurologique au début du traitement, qui serait expliquer par une mobilisation trop rapide du cuivre vers le plasma et sa redistribution préférentielle vers le cerveau. Dans notre étude aucun effet secondaire n’a été observé.
Le zinc a été approuvé aux USA par la FDA en 1997 comme traitement de la maladie de Wilson [12]. Il est vite devenu aux USA le traitement de choix dans le traitement d’entretien, en traitement pré-symptomatique [15] et dans les formes pédiatriques. Ceci est en rapport avec sa lenteur d’action et sa non toxicité. L’association Trientine/Zinc est une bonne option en traitement initial des formes hépatiques décompensées [3]. L’association Zinc/TIAM en cours d’essai parait très prometteuse [13] [14].
La transplantation hépatique est indiquée en cas d’atteinte hépatique grave, et/ou en cas de signes neurologiques ou neuropsychiatriques sévères échappant au traitement médical [30]. Cependant, certains auteurs, considèrent l’atteinte neurologique comme facteur de mauvais pronostic de survie post-transplantation [22].
CONCLUSION
Le pronostic de la maladie de Wilson dépend de la précocité du diagnostic positif et de la rapidité du démarrage d’un traitement chélateur de cuivre avant l’installation de lésions neurologique et hépatique irréversibles. L’idéal étant d’affirmer le diagnostic au stade présymptomatique de l’affection.
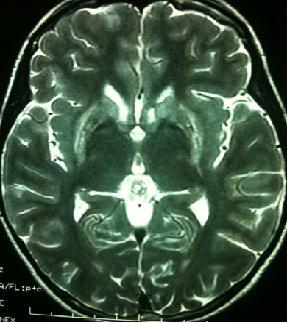
Séquence 1: Séquence pondérée T2 en coupes sagittal montrant un hypersignal bilatéral et symétrique des deux noyaux lenticulaires notamment les putamens et des deux noyaux caudés.
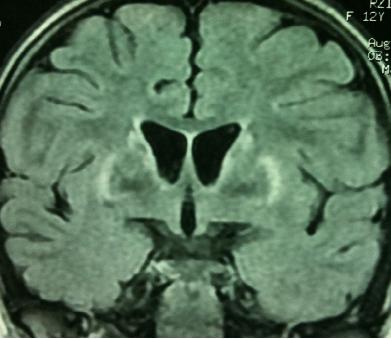
Séquence 2: Séquence pondérée T2 Flair en coupes axial montrant un hypersignal bilatéral et symétrique des deux putamens
REFERENCES
- ANJALI B. et al. Identification et analysis of mutations in the Wilson disease Gene (ATP 7H): population frequencies, genotype-phenotype correlation, and functional analyses.Am. J.Hum. Genet.1997;61:317-328.
- ARDELEA JABY D, BROUKER TH, CAILLIEZ M. Maladie de Wilson un cas et revus de la littérature. Immunoanal Boil Spec. 2001;16: 317-75.
- ASKARI F.K., GREENSON J., DICK R.D, et al. Treatment of Wilson’s disease with Zinc. XVIII. Initial treatment oh the hepatic decompensation with Trientine and Zinc.J. Lab. Clin. Med. 2003;142(6): 385-90.
- ATLAS SW. Wilson disease. Atlas SW, editor, MRI of the brain and spine. New-York : Raven Press.1991. p. 599-602.
- BACRI D.Le traitement de la maladie de Wilson. A propos de 34 cas.Ann Med Int. 1990 ; 131 :23-7.
- BASQUIN M. Hystérie, Schizophrénie, maladie de Wilson. Revue Neuropsychiatrique infantile.1975 ; 23 : 195-200.
- BENHAMLAA T, TIROUCHEA Y.D, ABOUAB-GERMAIN B A, THEODOR F.Mode d’entrée psychiatrique dans la mladie de Wilson : A propos d’un cas à début tardif. L’encéphale 2007;33:924-32.
- BERMAN DH, LEVENTHAL RI, GAVALER JS, CAARDOFF EM, VAN THIEL DH.Clinical differentiation of fulminant Wilsonien hepatitis from other causes of hepatic failure.Gastroenterology.1991;100:1129-34.
- BICKEL H.Maladie de Wilson. Dégénéréscence hépao-lenticulaire.Intenist.1966;7: 27-33.
- BONO W, MOUTIE O, BENOMAR A, AIDI S, EL ALAOUI FARIS M, YAHYAOUI M, et al.La maladie de Wilson. Etude génétique, thérapeutique et évolutive de 21 cas.Revue de Médecine interne 2002 ; 23 : 419-31.
- BOUDIN G, PEPIN B.Dégénéréscence hépato-lentculaire. Masson et cie ed, Paris.1959.
- BREWER G.J.Recognition, diagnosis, and management of Wilson’s disease. Proc. Soc. Exp. Biol. Med., 2000;223(1): 39-4.
- BREWER G.J, ASKARI F, LORINCZ M.T, et al. Treatment of Wilson disease with ammonium tetrathiomolybdate : IV. Comparaison of tetrathiomolybdate and trientine in a double-blind study of treatment of the nneurology presentation of Wilson’s disease.Arch. Neurol.2006;63(4):521-7.
- BREWER G.J, HEDERAP, KLUIN K.J et al.Treatment of Wilson disease with ammonium tetrathiomolybdate : III. Initial therapy in a total of 55 neurologically affected patients and follow-up with Zinc therapy.Arch. Neurol.2003;60(3) :379-85.
- BREWER G.J, TURKAY A, YUZBASIYAN-GURKAN V.Development of neurologic symptoms in a patient with symptomtic Wilson’s disease treated with penicillamine therapy.Arch. Neurology.1994;51(3): 304-5.
- BREWER G.J, YUSBASIYN-GURKAN V.Wilson disease.Medicine 1992;71:139-64.
- BULL P.C, THOMAS G.R, ROMMENS J.M,et al.The Wilson disease gene is a putative copper transporting P-type ATP ase similar to the Menkes gene.Nat. Genet.1993;5: 327- 37.
- CHU NS, HUNG TP.Geographic variations in Wilson’s disease. J Neurol Sci.1993;117:1-7.
- CUTHBERT JA. Wilson’s disease. Update of a systemic disorder with protean manifestations. In gastrointestinal disorders and systemic disease, part 1. Gastroenterol clin. 1998;27 :655-81.
- DALLAIRE L, HURET JL.Génétique Formelle et autres modes de transmission. Atlas Genet cytogenet Oncol Heamato 2002.
- DEBRAY J, KROULIK M,BLANCHON R.Les désordres hématologiques au cours de la maladie de Wilson (A propos de deux obervations personnelles).Ann. Med. Interne, juin-juillet.1971 ;122 n°6-7, 737-42.
- DEISS A. Maladie de WILSON.cécil U, Ed.Traité de médecine, 1ére édition.1997, p : 1131-2.
- DENNY-BROWN D.Maladie de Wilson (Dégénérescence hépato-lenticulaire). Evolution des conceptions cliniques.Revus Neuropsychiatr.1964; 27: 362-75.
- DHAWAN A, FERENCI P., GUUBEL A, et al.Genes and metals: a deadly combination.Acta. Gastroenterol, Belg. 2005, 68 (1): 26-32.
- DHIDAHA K, El FILALI F,NAAMANE A A,HADJ,KHALIFA H, AQUARONC R.Maladie de Wilson : étude clinique et biologique moléculaire.Immuno-analyse et biologie spécialisée.2007;22 : 373-6.
- DURAND F., BENHAMOU J.P.La maladie de Wilson. EMC (Paris) 7037.A10, 1992.
- ECHANIZ-LAGUNA A, TRANCHANT CH, WARTER JM.Maladie du cuivre et de la céruléoplasmine : données physiopathologiques et génétiques actuelles.Sem Hop Paris. 1997;73(21-22) :708-12.
- FRYDMAN M, BONNE-TAMIER B, FARRER LA,et al. Assignment of the gene for Wilson disease to chromosome13: linkage to the esterase D Locus.Proc. Nat, Acad. Sci.1985;82:1819-21.
- GARNIER H, DIEDRICH N, PILLOY W. et al. Forme tardive de la présentation psychiatrique de la maldie de Wilson, avec mouvements stéréotypés pseudo-compulsifs. Corrélations neuro-radiologiques. Revue Neurol., 1997;153(2) :124-8.
- GEISSLER I, HEINELANN K, ROHM S, et al.Liver transplantation for hepatic and neurological Wilson’s disease.Transplant. Proc.2003;35:1445-6.
- GHIKA J, VINGERHOETS f, MAEDER P, et al.La maladie de Wilson.Encycl.Méd.Chir. (Elsevier, Paris)-Neurologie Volume 1, Issue 4 : 481-511.
- GIBBS K, WALSCHE JM.A study of the ceruloplasmine concentrations found in 75 patients with Wilson’s disease, Their Kinships and various control groups, Q J Med.1979;48:447-63.
- GILL H.H, SHANKARANK.Wilson’s Disease: varied hepatic presentations. India. J. Gstroenterol. 1994;3 (3): 95-8.
- GOSS JA, STRIBLING R, MARTIN P.Adult liver transplantation for metabolic liver disease. Clin liver Dis.1998;21: 187- 210.
- GRIMM G,PRAYER L,ODER W, et al.Comparison of functional and structural brain disturbance in Wilson’s disease.Neurology.1991; 41 : 272-6.
- HISTOSHI S, IWATA M,YOSHIKAWA K.Mid-brain pathology of Wilson’s disease : MRI analysis and three cases.J Neurol Neursurg Psychiatry.1991 ; 54 : 624-6.
- HOAGLAND HC, GOLDSTAAIN NP.Hemtologic (cytopenic) manifestations of wilson’s disease (hepatolenticular-degeneration).Mayo clin Proc.1978;53:478-500.
- HOLTZMAN NA, NUGHTON MA, IBER FL, GAUMNITZ BM.Ceruleoplasmin in Wilson’s disease. J Clin Invest.1967;46:993-1002.
- LEI W, CHANG-HAI T, YUHSIN T, CHIN-MOO H, CHENG-CHUN L, FUU-JEN T.Mutation analysis of Taiwanese Wilson disease patients Biochemicaal and biophysical research communications. 2006;3;734-8.
- MICHEL M, LAFAURIE M, NOEL V, PICO L, BASTIE A,GODEAU B, SCHAEFFERA.Anémie hémolytique révélatrice d’une maladie de Wilson. A propos de deux observations.Revue de Médecine interne. 2001;22:280-3.
- MIKOL J, VITAAL C, WASSEF M, CHAPPUIS P, POUPON J, LECHARPENTIER M ET al.Extensive cortico-subcortical lesions in Wilson’s Disease: clinico-patholpgical study of two cases. Acta Neuropthol. 2005;110: 451-8.
- MIRONOV A.MRI in Wilson’s disease of the brain.Neuroradiology.1991;33:598-600.
- MISRAHI M, HADCHOUEL M.Physiopathologie et génétique de la maladie de Wilson.Hépato-gastro.1997;6(4):473-81.
- MEDICI V et al.Wilson disease : A practical approch o diagnosis, treatment and follow-up. Digestive and liver disease. 2007;39 : 601-9.
- NAGASKA H, INOUE I, INUI A, KOMATSU H, SOGO T, MURAYAMA K, et al.Relaionship between oxidative stress and antioxidant systems in the liver of patients with Wilson disease: hepaic manifestation in Wilson disease s consequence of augmented oxidative stress.Pediatr Res.2006; 60: 472-7.
- O’REILL S,WEBER PM,OSWALD M,SHIPLEY L.Abnormlities of the physiology of copper in Wilson’s disease. III. The excretion of copper. Arch Neurol 1971;25:28-32.
- PETRUKHIN K, FIESCHER S.G, PIRATSU M, et al. Mapping, cloning and genetic characterization of the region containing the Wilson disease gene.Nat. Genet.1993;5:338-43.
- PRASHANTH LK, TALY AB, SINHA S, ARUNO-DAYA GR, SWAMY HS. Wilson’s disease: diagnosis errors and clinical implications. J Neurol Neurosurg. 2004;75:907-9.
- TANZY R.E, PETRUKHIN K, CHERNOV I, et al.The Wilson disease gene is a coper transporting ATPase with homology to the Menkes disease gene. Nat.Genet.1993;5:344-50.
- TARDIF K.Unusual diagnosis among violent patients. Psychiatr clin North Am.1998;21:567-76.
- TISON F,ROUANET F, NEAU-CRANSAC M, CARLES J, COUZIGOUS P.Outcome of liver translantation in Wilson’s disease : a demonstration case.Parkinsonism and relatedDisorder.1996;2:131-5.
- TULAY E. et al.Wilson Disease Manifested primarily as amenorrhea and accompanying Thrombocyopenia.Journal of adolescent health.2002;31:378 -80.
- WALSCHE JM. Wilson’s disease in Vinken PJ, Bruyn GW, Klawans HL, editors.Handbook of clinical Neurology, vol. 49. Amsterdam : Elsevier Science.1986. P: 223-388.
- WALSCHE J.M.Hepatic Wilson’s disease : initial treatment and long-term management.Curr. Treat. Options. Gastroenterol.2005;8(6): 467-72.
- WILLEIT J,KIECHEL SG.Wilson’s disease with neurologica impairement but no Kayser-Fleischer rings [letter]. Lancet. 1991; 337:1426.
- WILLIAMS FJB, WALSCHE JM.Wilson’s disease: An analysis of the cranial computerized appearances found in 60 patients and the changes in response to treatment with chelating agents. Brain.1981; 104: 735-52.
- WOIMANT F, CHAINE P, FAVROLE P, MIKOL J, CHAPPUIS P.La maladie de Wilson.Rev Neurol (Paris).2006 ; 162 : 6-7, 773-81.
- YAMGUCHI Y.Mass screening for Wilson’s disease: results and recommandations.Pediatr int.1999; 41: 405-8