CLINICAL STUDIES / ETUDES CLINIQUES
LES OLIGODENDROGLIOMES: ETUDE RETROSPECTIVE DE 15 CAS
OLIGODENDROGLIOMAS: A RETROSPECTIVE STUDY OF 15 CASES
- Laboratoire d’Anatomie et de Cytologie Pathologiques, hôpital universitaire, Farhat Hached, 4000, Sousse, Tunisie
- Service de Neurochirurgie, hôpital universitaire Sahloul, 4054, Sousse, Tunisie
E-Mail Contact - ABDELKRIM Soumaya Ben :
ABSTRACT
Aims
To assess clinicopathological features and prognosis factors of oligodendrogliomas in the center of Tunisia.
Patients and Methods
Our retrospective study included 15 cases of oligodendrogliomas diagnosed between 1987 and 2007 at the Department of Pathology at Farhat Hached hospital (Sousse, Tunisia). The clinical, radiological and pathological features as well as treatment modalities and patient’s outcome were recorded. A histo-radiologic grade was assessed based on 2 criteria: endothelial hyperplasia at the pathologic examination and radiological enhancement.
Results
Oligodendrogliomas account for 2.5% of all tumors of the central nervous system diagnosed during the period of the study and 15.4% of glial tumors. According to the WHO classification, the 15 cases were divided into 10 pure oligodendrogliomas (8 grade II tumors and 2 grade III) and 5 oligoastrocytomas (one grade II tumor and 4 grade III). According to the histo-radiologic grade, the series included 6 grade A, 8 grade B and 1 grade AB tumor. Overall survival at 5 and 10 years were respectively 46.6% and 13.2%. On univariate analysis, significant association was seen between survival and atypia (p=0.03), endothelial hyperplasia (p=0.01), an index of proliferation > 5% (p=0.02) and a histo-radiologic grade B (p=0.02).
Conclusion
Our study, although it interests only a small number of cases, supports the use of the histo-radiologic grade which allows avoiding the difficulties related to the sampling of the tumors.
Key words: oligodendroglioma, histo-radiologic grade, prognosis, pathology
INTRODUCTION
Les oligodendrogliomes sont des tumeurs rares du système nerveux central. Les facteurs pronostiques sont encore mal définis. Le caractère subjectif du grading histologique de l’OMS est en partie responsable de la méconnaissance des aspects évolutifs de ces tumeurs. Pour pallier au problème de subjectivité, une nouvelle classification a été proposée en 1997 par Dumas-Duport et al [1], intégrant les données de la clinique et de l’imagerie (grading histo-radiologique). L’objectif de notre travail était d’exposer à travers une revue de la littérature les particularités clinicopathologiques, radiologiques et les facteurs pronostiques des oligodendrogliomes dans la région du Centre Tunisien.
PATIENTS ET METHODES
Notre étude rétrospective a inclus 15 cas d’oligodendrogliomes cérébraux diagnostiqués dans le laboratoire d’Anatomie et de Cytologie Pathologiques de Sousse (Tunisie) sur une période de 21 ans (1987-2007). Nous avons recueilli les données cliniques, radiologiques, thérapeutiques et évolutives. Le type histologique et le grade selon la classification de l’OMS 2007 ont été précisés. Le grading histo-radiologique a été établi pour chaque cas intégrant deux critères, un critère histologique: présence ou absence d’hyperplasie endothéliale et un critère radiologique: présence ou absence de prise de contraste. Une étude immunohistochimique a été réalisée, utilisant l’anticorps MIB 1 (évalué par l’anticorps anti Ki-67, dilution 1/50, DAKO) afin d’évaluer la fraction de prolifération; une valeur seuil de 5% a été retenue. Les taux de survie ont été calculés à partir de la date de diagnostic histologique selon la méthode de Kaplan-Meier. Le test statistique de Log-Rank a été utilisé pour l’étude comparative des facteurs pronostiques. Le seuil de signification statistique a été fixé à 5%.
RESULTATS
L’oligodendrogliome représente 2,5% de l’ensemble des tumeurs du système nerveux central diagnostiquées durant la période d’étude et 15,4% des tumeurs gliales. L’âge moyen au moment du diagnostic était de 34,7 ans (extrêmes: 8 – 61 ans), 67% des patients étaient âgés de 20 à 45 ans. Le sex-ratio était de 0,36 (4 hommes/11 femmes). Les circonstances de découverte étaient dominées par l’hypertension intracrânienne, rencontrée dans 93,3% des cas. Le délai moyen entre l’apparition des signes annonciateurs de la maladie et la date du diagnostic était de 36,8 mois (extrêmes: 2 mois – 15 ans).
L’examen clinique montrait un déficit moteur chez sept patients, un dème papillaire au fond d’il dans trois cas, une paralysie du nerf VI dans trois cas et un déficit sensitif dans deux cas. L’examen clinique était normal dans 3 cas.
Une tomodensitométrie (TDM) cérébrale a été pratiquée dans tous les cas, couplée à l’imagerie par résonnance magnétique (IRM) dans sept cas. La tumeur était spontanément hypodense dans 60% des cas, une prise de contraste était notée dans 8 cas (53,8%) (Figure1 :a,b). Les calcifications étaient présentes dans 8 cas (53,8%). A l’IRM, la tumeur était en hyposignal en T1 dans 6 cas et en hypersignal en T2 dans tous les cas; un rehaussement après injection de produit de contraste était noté dans 5 cas (Figure1 :c,d,e). Tous les oligodendrogliomes étaient de localisation supratentorielle. Ces tumeurs siégeaient dans le lobe frontal dans 6 cas (40%), au niveau temporal dans 1 cas (6,6%), au niveau pariétal dans 3 cas (20%) et étaient multifocales dans 5 cas (33,3%).
La relecture histologique avait permis de retenir le diagnostic d’oligodendrogliome dans tous les cas. Elle avait révélé 10 cas d’oligodendrogliomes purs et 5 cas d’oligoastrocytome. Les atypies cytonucléaires étaient notées dans 6 cas (40%). Plus que 5 mitoses par 10 champs au fort grossissement étaient notées dans 8 cas (53,3%). L’hyperplasie endothéliale était relevée dans 9 cas (60%) (Figure2). La nécrose tumorale était observée dans 7 cas (46,6%) et les calcifications dans 10 cas (66,6%). Selon le grading OMS 2007, parmi les 10 cas d’oligodendrogliomes purs, 8 étaient de grade II (Figure3) et 2 de grade III; les 5 cas d’oligoastrocytomes se répartissaient en un cas de grade II et 4 de grade III. Conformément au grading histo-radiologique de Daumas-Duport et coll. [1], 6 cas étaient classés en grade A (40%), 8 cas en grade B (53,4%) et un cas en grade AB (6,6%).
L’étude immunohistochimique de la fraction de prolifération par l’anticorps anti-ki67, réalisée dans 13 cas, a révélé un marquage de moins de 5% des cellules dans 6 cas (46%) (Figure4) (4 cas d’oligodendrogliome pur de grade II, un cas d’oligoastrocytome de grade II et un cas d’oligoastrocytome de grade III) et ≥ 5% dans 7 cas (54%) (2 cas d’oligodendrogliome pur de grade III, 3 cas d’oligoastrocytome de grade III et un cas d’oligodendrogliome pur de grade II).
L’exérèse chirurgicale était proposée en première intention chez tous les patients, elle était jugée macroscopiquement complète dans 11 cas; 7 patients ont bénéficié d’une radiothérapie externe, indiquée devant une exérèse chirurgicale partielle, un haut grade histologique ou devant la survenue d’une récidive. Aucun patient n’a reçu de chimiothérapie.
Le suivi moyen des patients a été de 45,6 mois (8-132). Sept tumeurs ont récidivé localement après 32 mois en moyenne (5-54), aucune récidive métastatique n’a été retrouvée. Les taux de survie globale à cinq et à dix ans étaient respectivement de 46,6 % et 13,2 %. En analyse univariée, et sous réserve du nombre limité des cas de la série, le délai diagnostique > 12 mois et la prise de contraste à l’imagerie étaient corrélés significativement à un mauvais pronostic (p=0,03 et p=0,01 respectivement). En revanche, il n’y avait pas de corrélation entre la survie globale et l’âge, le sexe, la qualité d’exérèse chirurgicale et le type de traitement complémentaire. L’étude de la survie en fonction de certains facteurs histologiques avait montré que seules l’hyperplasie endothéliale, les atypies cytonucléaires et une fraction de prolifération ≥ 5% étaient corrélées à un mauvais pronostic (p=0,01, p=0,03 et p=0,02 respectivement). Les autres paramètres histologiques analysés (type et grade histologiques, index mitotique, nécrose et calcifications) n’avaient pas influencé significativement la survie. Le grade histo-radiologique B était significativement corrélé à un pronostic péjoratif (p=0,02).
DISCUSSION
Les oligodendrogliomes sont des tumeurs rares du système nerveux central, nous rapportons une série de 15 oligodendrogliomes cérébraux qui représentaient 2,5% de l’ensemble des tumeurs du système nerveux central conformément à ce qui a été rapporté dans la littérature [2]. Cette rareté est souvent expliquée par le fait que la fréquence réelle de ces tumeurs était sous-estimée, surtout dans leur forme infiltrante pure, induisant une gliose astrocytaire importante à cause de laquelle ces tumeurs seraient interprétées selon l’OMS, comme des astrocytomes fibrillaires [3]. Les oligodendrogliomes se développent à tout âge mais avec une nette prédominance entre la 4ème et la 6ème décade de la vie [4, 5, 6]. Dans notre série, on a noté un rajeunissement de notre population par rapport à certaines séries ce qui pourrait être expliqué par le nombre limité des cas. Il n’y a pas de différence significative entre les deux sexes dans la littérature [7, 8]. Dans notre série on a trouvé une nette prédominance féminine (sex-ratio: 0,36), ce résultat reste à confirmer par des séries plus larges. La crise convulsive est le symptôme le plus souvent révélateur [4, 8, 9, 10], il n’a été retrouvé que chez 4 de nos patients alors que l’hypertension intracrânienne était le principal mode de révélation (93,3%).
Les oligodendrogliomes sont caractérisés par un polymorphisme tomodensitométrique avec le plus souvent un aspect de lésion hypodense [11, 12]. Ceci est conforme avec les résultats de notre série. A l’IRM, l’oligodendrogliome se présente comme une masse hypointense en T1 et hyperintense en T2 [13]. Il en est de même dans notre série. La prise de contraste après injection de gadolinium est inconstante, peu marquée et hétérogène [13, 14]. Dans notre étude, le rehaussement a été constaté dans 5 parmi les 7 patients qui ont bénéficié de l’IRM. L’IRM parait utile pour déterminer le rapport avec les structures de voisinage et contrairement à la TDM, le problème de prise de contraste en cas de calcification majeure ne se pose pas [15].
Histologiquement, les oligodendrogliomes ne peuvent être identifiés, le plus souvent, que par leurs caractéristiques nucléaires qui sont dans l’ensemble proches de celles des oligodendrocytes normaux. Une composante astrocytaire peut être étroitement mêlée aux oligodendrocytes ou former des foyers distincts. Les oligodendrogliomes dont la composante astrocytaire ne présente pas les caractéristiques d’une gliose réactionnelle sont classés, selon l’OMS, en « oligo-astrocytomes ». Les oligodendrogliomes et les oligoastrocytomes sont classés, selon l’OMS 2007, en grade II et en grade III selon la présence ou pas de foyers d’anaplasie. Les critères histologiques pour différencier les tumeurs de grade II et III sont peu spécifiques pour que le grading puisse être reproductible [16]. Des atypies cytonucléaires marquées et d’occasionnelles mitoses restent compatibles avec un grade II. En revanche, selon les termes très subjectifs employés dans cette classification, une activité mitotique « significative », une prolifération microvasculaire « marquée », ainsi qu’une nécrose « possible » indiquent une progression vers un grade III. C’est ainsi que la classification de l’OMS ne tient pas compte de deux caractéristiques majeures de ces tumeurs: leur structure infiltrante et leur aspect hétérogène [17, 18]. Ceci explique en partie la valeur pronostique inconstante de ce grading dans les oligodendrogliomes. Dans notre étude, conformément à l’OMS, pour les 10 oligodendrogliomes purs, 8 ont été classés en grade II et 2 en grade III; pour les 5 oligo-astrocytomes, 1 a été classé en grade II et les 4 autres en grade III.
Grâce à l’étude des biopsies stéréotaxiques en corrélation avec l’imagerie, en 1997, Daumas-Duport et coll. [1] ont établi un grading mixte: histologique et radiologique. Il repose sur 2 critères: l’hyperplasie des cellules endothéliales et la prise de contraste à l’imagerie. Deux grades de malignité sont ainsi définis: le grade A caractérisé par l’absence d’hyperplasie endothéliale et de prise de contraste et le grade B caractérisé par la présence d’une hyperplasie endothéliale et/ou de prise de contraste. La tumeur qui ne montre pas de prise de contraste mais présente une discrète hyperplasie endothéliale est classée A/B. Ce grading présente le double avantage d’être doublement reproductible et de pallier aux problèmes liés à la représentativité des prélèvements. Il nécessite une étroite collaboration entre le neurochirurgien, le radiologue et le pathologiste en assurant une meilleure délimitation de la tumeur par l’examen radiologique afin d’optimiser la résection tumorale et en réalisant des prélèvements histologiques dans les zones de prise de contraste afin d’améliorer le grading histopronostique. En conséquence, le scanner et/ou l’IRM doivent être utilisés par l’anatomopathologiste en tant qu’équivalent de l’examen macroscopique; l’imagerie permet notamment d’apprécier la représentativité des prélèvements: c’est ainsi, s’il n’est pas observé de microangiogenèse évidente et que la tumeur prend le contraste, il peut en être induit qu’une composante de tissu tumoral n’a pas été intéressée par les prélèvements permettant d’éviter une sous-estimation du degré de malignité tumorale. Dans notre étude une corrélation entre la prise de contraste à la TDM et/ou à l’IRM et la présence d’une hyperplasie endothéliale a été noté dans 8 cas parmi les 9 présentant une hyperplasie endothéliale (2 cas d’oligodendrogliome pur de grade II, 2 cas d’oligodendrogliome pur de grade III et 4 cas d’oligoastrocytome de grade III). Conformément au grading historadiologique de Daumas-Duport et coll [1], on a trouvé 6 cas de grade A (40%), 8 cas de grade B (53,4%) et un cas de grade A/B (6,6%).
Le traitement de base des oligodendrogliomes est la chirurgie qui doit être aussi large que possible. Toutes localisations confondues, la résection macroscopique complète est obtenue dans 45 à 83% [19-23]. Dans notre étude, 11 cas (73,3%) ont pu bénéficier d’une exérèse complète. Les oligodendrogliomes sont considérés comme des tumeurs radiosensibles [24, 25]. La radiothérapie est indiquée en cas d’exérèse partielle, de tumeur de grade III, de récidive ou de métastase [9, 25, 26]. Dans notre série, la radiothérapie a été indiquée devant une exérèse chirurgicale partielle dans 2 cas, un grade III dans 3 cas et la survenue d’une récidive dans 2 cas. Les oligodendrogliomes sont réputés particulièrement chimiosensibles par rapport aux autres gliomes [27, 28]. Dans notre série, aucun patient n’a bénéficié de la chimiothérapie.
La plupart des auteurs affirment que l’oligodendrogliome est une tumeur d’évolution lente avec une survie moyenne allant de 36 mois à 102 mois [29, 30]; dans notre étude, elle était de 45,6 mois. La survie globale à 5 et 10 ans varie respectivement de 45 à 80% [31, 32] et de 24 à 55% [32, 9] selon les séries. Elle était respectivement de 46,6% et 13,2% dans notre étude. Les critères pronostiques des oligodendrogliomes connus à ce jour restent discutés. L’absence de prise de contraste semble être un facteur de bon pronostic très important [33-37]. Dans notre étude aussi, la prise de contraste au scanner et l’IRM était corrélée à un mauvais pronostic (p=0,01). Concernant le grade histologique de l’OMS, beaucoup d’auteurs ont mis en évidence un meilleur pronostic des tumeurs de grade II par rapport aux tumeurs de grade III [9, 13, 14, 38-40]; inversement, d’autres n’ont pas démontré de corrélation entre le grade et la survie [31, 10, 41, 42]. Ces discordances seraient expliquées par l’absence de critères objectifs permettant le grading [42]. Dans notre étude, le grade histologique de l’OMS n’a pas d’influence sur la survie (p=0,11). Actuellement, la classification histo-radiologique est d’intérêt pronostique majeur; un grade B est de mauvais pronostic [36]. Ceci a été retrouvé dans notre série. L’activité mitotique, les atypies cytonucléaires et la nécrose tumorale seraient pour certains auteurs des facteurs de mauvais pronostic [13, 43-47]; dans notre étude, seules les atypies sont corrélées à un mauvais pronostic (p=0,03).
Plusieurs auteurs ont confirmé la valeur pronostique de la fraction de prolifération, évaluée par l’anticorps MIB1 (anti ki-67) [48, 49]. Dans notre étude, conformément à la littérature, nous avons constaté qu’une expression de l’anti Ki67 ≥ 5% est corrélée à une survie courte (p=0,02). D’autre facteurs pronostiques ont été rapportés dans la littérature, comme l’âge et la qualité de l’exérèse [32, 38, 50, 51].
CONCLUSION
Nos résultats tendent à confirmer la valeur pronostique de certains paramètres, notamment radiologiques (prise de contraste) et anatomopathologiques et insistent sur l’utilité d’un grading plus précis incluant des critères objectifs, reproductibles et quantifiables. Une confrontation anatomo-radiologique paraît nécessaire et d’un intérêt pronostique majeur dans le grading des oligodendrogliomes.
Conflit d’intérêt: aucun.
Tableau I. Caractéristiques clinico-pathologiques de la population d’étude.
| Age des patients (ans) |
|
| Moyenne |
34,7 |
| Extrêmes |
8 – 61 |
| Sexe |
|
| Hommes |
4 |
| Femmes |
11 |
| Circonstances de découverte |
|
| Hypertension intracrânienne |
14 |
| Convulsions |
4 |
| Déficit moteur |
4 |
| Troubles du comportement |
3 |
| Délai diagnostique |
|
| Moyenne |
6 mois |
| Extrêmes |
2 mois – 15 ans |
| Caractéristiques anatomopathologiques |
|
| Atypies |
|
| Présentes |
6 |
| absentes |
9 |
| Mitoses |
|
| 1 – 5 |
3 |
| ≥ 5 |
8 |
| Absentes |
4 |
| Nécrose |
|
| Présentes |
7 |
| Absentes |
8 |
| Calcifications |
|
| Présentes |
10 |
| Absentes |
5 |
| Hyperplasie endothéliale |
|
| Présente |
9 |
| Absente |
6 |
| Type histologique |
|
| Oligodendrogliome pur |
10 |
| Oligoastrocytome |
5 |
Tableau II. Corrélation entre les différents paramètres et la survie globale (test de Log-Rank, seuil de signification: p≤0,05)
| Paramètres histologiques |
Grade OMS (II ou III) |
p=0,11 |
|
Type histologique |
p=0,09 |
|
Atypies cytonucléaires (présentes/absentes) |
p=0,03 |
|
Index mitotique (<5/≥5) |
p=0,17 |
|
Hyperplasie endothéliale (présente/absente) |
p=0,01 |
|
Nécrose (présente/absente) |
p=0,77 |
|
Calcifications (présentes/absentes) |
p=0,23 |
|
Fraction de prolifération (<5/≥5) |
p=0,02 |
| Paramètres cliniques et radiologiques |
Age (≤40/>40 ans) |
p=0,16 |
|
Sexe |
p=0,33 |
|
Délai de diagnostic (≤1 an/>1 an) |
p=0,04 |
|
Prise de contraste (présente/absente) |
p=0,01 |
| Paramètres thérapeutiques |
Exérèse chirurgicale (complète/partielle) |
p=0,31 |
|
Radiothérapie (faite/non faite) |
p=0,92 |
| Grade histo-radiologique |
Grades (A/B/AB) |
p=0,02 |
Légendes de figures:
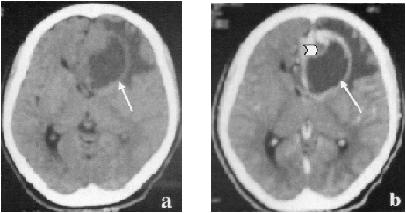 Figure 1a, 1b -TDM: tumeur hypodense entourée d’un dème (a), après injection prise de contraste en anneau (flèche) et nodulaire (tête de flèche) (b)
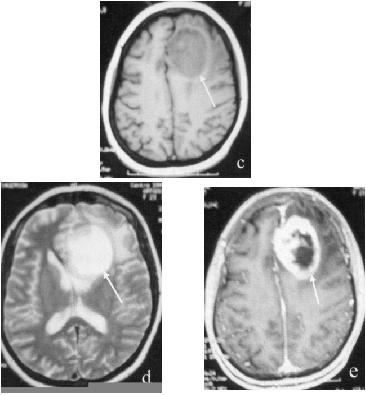 Figure 1c, 1d, 1e -IRM : tumeur en isosignal en T1 (c), hypersignal en T2(d) et avec prise de contraste après injection (e)
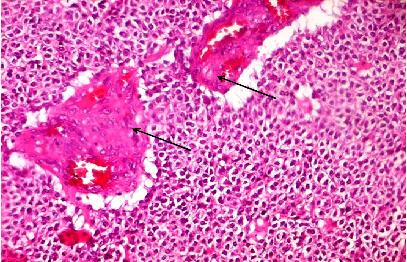 Figure2
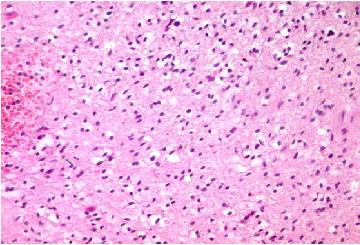 Figure 3
 Figure 4
REFERENCES
- DAUMAS-DUPORT C, TUCKER ML, KOLLES H, CERVERA P, BEUVON F, VARLET P, et al. Oligodendrogliomas. Part II: A new grading system based on morphological and imaging criteria. J Neurooncol 1997;34(1):61-78.
- JACOB R, JYOTHIRMAYI R, DALAL Y, NAMBIAR U, RAJAN B, NAIR MK. Oligodendroglioma: clinical profile and treatment results. Neurol India 2002;50(4):462-6.
- FIGARELLA-BRANGER D, COLIN C, COULIBALY B, QUILICHINI B, MAUES DE PAULA A, FERNANDEZ C, et al. Histological and molecular classification of gliomas. Rev Neurol (Paris) 2008;164(6-7):505-15.
- NIJJAR TS, SIMPSON WJ, GADALLA T, MCCARTNEY M. Oligodendroglioma. The Princess Margaret Hospital experience (1958-1984). Cancer 1993;71(12):4002-6.
- BULLARD DE, RAWLINGS CE 3RD, PHILLIPS B, COX EB, SCHOLD SC JR, BURGER P, et al. Oligodendroglioma. An analysis of the value of radiation therapy. Cancer 1987;60(9):2179-88.
- HASHIMOTO N, MURAKAMI M, TAKAHASHI Y, FUJIMOTO M, INAZAWA J, MINEURA K. Correlation between genetic alteration and long-term clinical outcome of patients with oligodendroglial tumors, with identification of a consistent region of deletion on chromosome arm 1p.Cancer 2003;97(9):2254-61.
- SANSON M, AGUIRRE-CRUZ L, CARTALAT-CAREL S, HOANG-XUAN K. Oligodendrogliomas: an update on basic and clinical research. Curr Neurol Neurosci Rep 2003;3(3):223-8.
- WILKINSON IM, ANDERSON JR, HOLMES AE. Oligodendroglioma: an analysis of 42 cases. J Neurol Neurosurg Psychiatry 1987;50(3):304-12.
- CELLI P, NOFRONE I, PALMA L, CANTORE G, FORTUNA A. Cerebral oligodendroglioma: prognostic factors and life history. Neurosurgery 1994;35(6):1018-34.
- OLSON JD, RIEDEL E, DEANGELIS LM. Long-term outcome of low-grade oligodendroglioma and mixed glioma. Neurology 2000;54(7):1442-8.
- YEH SA, LEE TC, CHEN HJ, LUI CC, SUN LM, WANG CJ, et al. Treatment outcomes and prognostic factors of patients with supratentorial low-grade oligodendroglioma. Int J Radiat Oncol Biol Phys 2002;54(5):1405-9.
- REEDY DP, BAY JW, HAHN JF. Role of radiation therapy in the treatment of cerebral oligodendroglioma: an analysis of 57 cases and a literature review. Neurosurgery 1983;13(5):499-503.
- PRAYSON RA, MOHAN DS, SONG P, Suh JH. Clinicopathologic study of forty-four histologically pure supratentorial oligodendrogliomas. Ann Diagn Pathol 2000;4(4):218-27.
- SHAW EG, SCHEITHAUER BW, O’FALLON JR, DAVIS DH. Mixed oligoastrocytomas: a survival and prognostic factor analysis. Neurosurgery 1994;34(4):577-82.
- SHUMAN WP, GRIFFIN BR, HAYNOR DR, JONES DC, JOHNSON JS, CROMWELL LD, et al. The utility of MR in planning the radiation therapy of oligodendroglioma. AJR Am J Roentgenol 1987;148(3):595-600.
- LOUIS DN, OHGAKI H, WIESTLER OD, CAVENEE WK, BURGER PC, JOUVET A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007;114(2):97-109.
- COONS SW, JOHNSON PC, SCHEITHAUER BW, YATES AJ, PEARL DK. Improving diagnostic accuracy and interobserver concordance in the classification and grading of primary gliomas. Cancer 1997;79(7):1381-93.
- MITTLER MA, WALTERS BC, STOPA EG. Observer reliability in histological grading of astrocytoma stereotactic biopsies. J Neurosurg 1996;85(6):1091-4.
- EARNEST F 3RD, KERNOHAN JW, CRAIG WM. Oligodendrogliomas; a review of 200 cases. Arch Neurol Psychiatry 1950;63(6):964-76.
- BAUMAN GS, INO Y, UEKI K, ZLATESCU MC, FISHER BJ, MACDONALD DR, et al. Allelic loss of chromosome 1p and radiotherapy plus chemotherapy in patients with oligodendrogliomas. Int J Radiat Oncol Biol Phys 2000;48(3):825-30.
- DEHGHANI F, SCHACHENMAYR W, LAUN A, KORF HW. Prognostic implication of histopathological, immunohistochemical and clinical features of oligodendrogliomas: a study of 89 cases. Acta Neuropathol 1998;95(5):493-504
- HORRAX G, WU WQ. Postoperative survival of patients with intracranial oligodendroglioma with special reference to radical tumor removal; a study of 26 patients. J Neurosurg 1951;8(5):473-9.
- JEREMIC B, SHIBAMOTO Y, GRUIJICIC D, MILICIC B, STOJANOVIC M, NIKOLIC N, et al. Combined treatment modality for anaplastic oligodendroglioma: a phase II study. J Neurooncol 1999;43(2):179-85.
- VAN DEN BENT MJ, RENI M, GATTA G, VECHT C. Oligodendroglioma. Crit Rev Oncol Hematol 2008;66(3):262-72.
- LO SS, CHO KH, HALL WA, HERNANDEZ WL, KOSSOW RJ, LEE CK, et al. Does the extent of surgery have an impact on the survival of patients who receive postoperative radiation therapy for supratentorial low-grade gliomas? Int J Cancer. 2001;96 Suppl:71-8.
- NAUGLE DK, DUNCAN TD, GRICE GP. Oligoastrocytoma. Radiographics 2004;24(2):598-600.
- VAN DEN BENT MJ. Chemotherapy of oligodendroglial tumours: current developments. Forum (Genova) 2000;10(2):108-18.
- STEWART LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 2002;359(9311):1011-8.
- SUN ZM, GENKA S, SHITARA N, AKANUMA A, TAKAKURA K. Factors possibly influencing the prognosis of oligodendroglioma. Neurosurgery 1988;22(5):886-91.
- NIEDER C. Glioma treatment, radionecrosis, and growth factors. In regard to Levin et al., IJROBP 2002;53:58-66. Int J Radiat Oncol Biol Phys 2003;55(3):849.
- KROS JM, PIETERMAN H, VAN EDEN CG, AVEZAAT CJ. Oligodendroglioma: the Rotterdam-Dijkzigt experience. Neurosurgery 1994;34(6):959-66.
- DEVAUX B, TURAK B, ROUJEAU T, PAGE P, CIOLOCA C, RICCI AC, et al. Oligodendrogliomes supratentoriels de l’adulte. Traitement chirurgical : indications et techniques. Neurochirurgie 2005;51(3-4-C2): 353-367.
- MACDONALD DR, O’BRIEN RA, GILBERT JJ, CAIRNCROSS JG. Metastatic anaplastic oligodendroglioma. Neurology 1989;39(12):1593-6.
- KYRITSIS AP, YUNG WK, BRUNER J, GLEASON MJ, LEVIN VA. The treatment of anaplastic oligodendrogliomas and mixed gliomas. Neurosurgery 1993;32(3):365-70.
- WALLNER KE, GONZALES M, SHELINE GE. Treatment of oligodendrogliomas with or without postoperative irradiation. J Neurosurg 1988;68(5):684-8.
- VAQUERO J, ZURITA M, MORALES C, COCA S. Prognostic significance of tumor-enhancement and angiogenesis in oligodendroglioma. Acta Neurol Scand 2002;106(1):19-23.
- SHELINE GE, BOLDREY E, KARLSBERG P, PHILLIPS TL. Therapeutic considerations in tumors affecting the central nervous system: oligodendrogliomas. Radiology 1964;82:84-9.
- LEBRUN C, FONTAINE D, RAMAIOLI A, VANDENBOS F, CHANALET S, LONJON M, et al; Nice Brain Tumor Study Group. Long-term outcome of oligodendrogliomas. Neurology. 2004;62(10):1783-7.
- ALLAM A, RADWI A, EL WESHI A, HASSOUNAH M. Oligodendroglioma: an analysis of prognostic factors and treatment results. Am J Clin Oncol 2000;23(2):170-5.
- SHAW E, ARUSELL R, SCHEITHAUER B, O’FALLON J, O’NEILL B, DINAPOLI R, et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol 2002;20(9):2267-76.
- FERRARESI S, SERVELLO D, DE LORENZI L, ALLEGRANZA A. Familial frontal lobe oligodendroglioma. Case report. J Neurosurg Sci 1989;33(4):317-8.
- DAUMAS-DUPORT C, VARLET P, TUCKER ML, BEUVON F, CERVERA P, CHODKIEWICZ JP. Oligodendrogliomas. Part I: Patterns of growth, histological diagnosis, clinical and imaging correlations: a study of 153 cases. J Neurooncol 1997;34(1):37-59.
- WILKINSON IM, ANDERSON JR, HOLMES AE. Oligodendroglioma: an analysis of 42 cases. J Neurol Neurosurg Psychiatry 1987;50(3):304-12.
- BURGER PC, RAWLINGS CE, COX EB, MCLENDON RE, SCHOLD SC JR, BULLARD DE. Clinicopathologic correlations in the oligodendroglioma. Cancer 1987;59(7):1345-52.
- Smith MT, Ludwig CL, Godfrey AD, Armbrustmacher VW. Grading of oligodendrogliomas. Cancer 1983;52(11):2107-14.
- HAMLAT A, SAIKALI S, CHAPERON J, CARSIN-NICOL B, CALVE ML, LESIMPLE T, et al. Proposal of a scoring scale as a survival predictor in intracranial oligodendrogliomas. J Neurooncol 2006;79(2):159-68.
- MANSUY L, ALLEGRE G, GOURGON J, TOMMASI M, THIERRY A. Analyse d’une série opératoire de 49 oligodendrogliomes avec 3 localisations infratentorielles. Neurochirugie 1967;13(6):679-700.
- BURGER PC. What is an oligodendroglioma? Brain Pathol. 2002;12(2):257-9.
- INO Y, BETENSKY RA, ZLATESCU MC, SASAKI H, MACDONALD DR, Stemmer-Rachamimov AO, et al. Molecular subtypes of anaplastic oligodendroglioma: implications for patient management at diagnosis. Clin Cancer Res 2001;7(4):839-45.
- MØRK SJ, HALVORSEN TB, LINDEGAARD KF, EIDE GE. Oligodendroglioma. Histologic evaluation and prognosis. J Neuropathol Exp Neurol 1986;45(1):65-78.
- ZUSTOVICH F, DELLA PUPPA A, SCIENZA R, ANSELMI P, FURLAN C, CARTEI G. Metastatic oligodendrogliomas: a review of the literature and case report.Acta Neurochir (Wien) 2008;150(7):699-702;
|
|