CASE REPORT / CAS CLINIQUE
LA MALADIE DE VON-HIPPEL LINDAU DANS UNE FAMILLE TOGOLAISE
VON-HIPPEL LINDAU DISEASE. A TOGOLESE FAMILY CASE
- Clinique neurologique, CHU Sylvanus Olympio, Lomé, Togo
- Service de Santé des Armées, Lomé, Togo
- Service de neurologie, CHU du Campus, Lomé, Togo
- Service d’ophtalmologie, CHU Sylvanus Olympio, Lomé, Togo
- Service de médecine interne, CHU Sylvanus Olympio , Lomé, Togo
- Service de neurochirurgie, Hôpital Cantonal, Genève, Suisse
- Laboratoire de Diagnostic Moléculaire B, Département de Médecine Génétique et de Laboratoire, Centre Médical Universitaire, Genève, Suisse
E-Mail Contact - BELO Mofou :
RESUME
La maladie de Von Hippel Lindau(VHL) est une affection héréditaire autosomique dominante dont l’expression phénotypique est variable et multiviscérale. Le diagnostic nécessite des arguments cliniques et un plateau technique de pointe. nous rapportons les résultats d’une enquête au sein d’une famille togolaise à partir de deux observations cliniques. Ces observations mettent en exergue les difficultés de la pratique médicale en Afrique subsaharienne liées à un plateau technique inexistant.
SUMMARY
Von Hippel-Lindau syndrome is an inherited disorder characterized by the formation of tumors and fluid-filled sacs (cysts) in many different parts of the body. The diagnose of this affection need a clinical and technical update materials. From two observations, we report outcome of a Togolese family.
INTRODUCTION
La maladie de Von Hippel Lindau(VHL) est une affection héréditaire autosomique dominante dont l’expression phénotypique est variable et multiviscérale. Elle est caractérisée par le développement de tumeurs vasculaires (« hémangioblastomes ») touchant avant tout le cervelet (à l’origine de céphalées, de nausées et de vomissements traduisant une hypertension intracrânienne), la moelle épinière et la rétine [15]. Il s’y associe des tumeurs des reins, du pancréas, des surrénales, à l’origine des phéochromocytomes, et du sac endo lymphatique de l’oreille interne à l’origine des cystadénomes du ligament large et de l’épididyme [16]. La découverte d’un hémangioblastome rétinien ou du système nerveux doit faire rechercher une lésion viscérale et vice-versa. Un diagnostic précoce est important non seulement pour le malade, mais cela permet aussi de rechercher l’affection dans la famille de ce malade .Elle touche les deux sexes et atteint environ 1 personne sur 40.000 [2].
OBSERVATION N°1
Mlle A.K.M., de race Noire, togolaise célibataire de 33 ans exerce une activité de commerce et a des antécédents familiaux de décès paternel jeune d’une HTA difficilement contrôlable. Elle est 5e d’une fratrie de 15 enfants dont 6 décédés de cause inconnue. Les antécédents personnels sont représentés par : un phéochromocytome surrénalien bilatéral avec résection en 1984 et 1990 à l’hôpital cantonal de Genève, une hystérectomie subtotale en 2006 à Lomé pour multiples fibromyomes utérins, des séquelles d’onchocercose oculaire bilatérale, une rétinopathie hypertensive, une insuffisance surrénalienne lente et un diabète cortico induit. Elle est sous metformine et hydrocortisone. Elle a consulté pour faiblesse progressive des deux membres inférieurs en avril 2004 pour difficultés croissantes à la marche, et sensation de faiblesse des membres inférieurs prédominant à droite associé à des troubles de la miction (doit appuyer sur la vessie pour uriner) et de constipation. L’examen clinique retrouvait : un état de conscience normal, une bonne orientation spatio-temporelle, une force musculaire aux membres inférieurs cotée à 4/5 sur tous les groupes musculaires, un niveau sensitif supérieur à D11, une hyper réflexie du membre supérieur droit, une hyper réflexie rotulienne et achiléenne, signe de Babinski bilatéral, une diffusion des régions réflexogènes rotuliennes droites et un clonus achilléen bilatéral. Il n’y avait pas d’incontinence urinaire. Devant ces signes une IRM a été faite à Lomé, révélant de multiples lésions intradurales et extramédullaires, motivant son transfert à l’hôpital Cantonal de Genève en neurochirurgie pour une prise en charge spécialisée. A l’ HUG Cantonal, l’IRM cérébrale et spinale ne notait pas de lésion intracérébrale. En T1 (figure 1) les lésions étaient hypointenses avec important réseau vasculaire associé. En T2, l’examen spinal a mis en évidence trois (03) lésions intracanalaires extramédullaires situées aux niveaux C5-C7 (figure 2), D9-D10 (figure 3), D12-L1 (figure 4), comprimant la moelle surtout au niveau D9-D10 prenant fortement le contraste et hyperintenses (figure 5), La scintigraphie au MIBG montrait de multiples masses hypervasculaires, intraspinales avec absence de captation au niveau des masses connues intraspinales, en 24 heures après injection. L’angiographie médullaire montrait une lésion cervicale vascularisée par des branches directes de l’artère vertébrale droite, cervicale profonde droite et cervicale ascendante droite. La lésion présente des shunts rapides et un drainage veineux à partir des veines médullaires et para spinales. Cette lésion pouvait être embolisée par voie endovasculaire. La lésion thoracique était vascularisée par des branches spinales méningées D12 droite, D11 droite, radiculo-médullaire postérieure gauche, D8 gauche. La lésion thoraco-lombaire était vascularisée par une branche méningée D11 gauche et une radiculo-médullaire antérieure L2 gauche. Le test génétique a permis de retrouver une mutation hétérozygote dans l’exon 1 du gène VHL : mutation p.Tyr98Cys déjà rapportée. Finallement, le diagnostic d’une compression médullaire cervicale C5-C7, dorsale D9-D10 et dorso-lombaire D12-L1 par des hémangioblastomes a été retenu.
Il a été réalisé une embolisation de la lésion cervicale suivie d’une résection macroscopiquement totale des trois hémangioblastomes postéro-latéraux droits après une laminotomie ostéoplastique thoraco-lombaire ; le plus gros en position inférieure D12-L1, mesurant 31 mm) Une ablation également macroscopiquement totale d’un hémangioblastome supérieur situé en D9-D10, antéro-latéralement à la moelle du côté gauche a été également réalisé. L’évolution immédiate a été marquée par une paraplégie ASIA C avec niveau sensitif supérieur D7 et des troubles sphinctériens urinaires. Un traitement anti-cholinergique avait permis de retrouver une miction normale et une physiothérapie intensive avait permis de retrouver une marche avec cannes (périmètre de marche 500 mètres) en 20 jours. L’évolution ultérieure était favorable et avait permis la mise sous cortisone 25 mg et Fluorohydrocortisone 0.05 mg par jour, à vie. L’examen ophtalmologique a été normal. On a noté une absence de tumeur thoraco-abdomino-pelvienne à la TDM et une MAPA en faveur d’une HTA limite et labile. L’IRM cérébrale était normale.
Le test génétique a permis de retrouver une mutation hétérozygote dans l’exon 1 du gène VHL : mutation p.Tyr98Cys déjà rapportée.
OBSERVATION N°2
Mr A.K., de race Noire Togolais, 21 ans célibataires sans enfants, étudiant en économie, aux antécédents familiaux de décès paternel jeune d’une HTA difficilement contrôlable, douzième d’une fratrie de 15 enfants dont 6 sont décédés de cause inconnue et également le frère cadet de la patiente 1, de mère différente. Les antécédent personnels sont les suivants : un phéochromocytome surrénalien droit et tumeur retro cave droite reséqués en 1988 ; un accident vasculaire hémorragique (AVCH) capsulo lenticulaire droit en 1999 avec pour séquelle une hémiparésie gauche proportionnelle et rétinopathie hypertensive, non classée. Il a consulté pour masse abdominale et une HTA. Le début remontait au mois de janvier 2001, par le développement rapidement progressif d’une masse abdominale associée à une HTA difficilement contrôlable. L’examen clinique révélait : un bon état général, les conjonctives étaient colorées anictériques, une absence d’dème des membres inférieurs. Une cicatrice abdominale médiane indolore, un abdomen souple, indolore, sans hépatosplénomégalie ni adénopathies palpables. Les bruits intestinaux étaient normaux. On pouvait palper une masse, ferme, indolore localisée dans la loge rénale droite. une suspicion de récidive de phéochromocytome a été évoquée et le patient a été transféré à l’hôpital cantonal de Genève pour une prise en charge spécialisée. Les examens para cliniques (réalisé à HUG cantonal) ont montré : TH = 10,1 g/L ; hématocrite = 29.7% ; glycémie, natrémie, kaliémie, chlorémie, urémie, créatininémie et protéinémie normaux. La biologie urinaire retrouvait: noradrénaline = 8 404nmol/j (28xNormale) et vanilmandelate = 84 umol/j (3xNormale) élevées. L’adrénaline, la dopamine et les métanéphrines étaient normaux. Le sodium, le potassium, le calcium, les phosphates, et l’urée urinaires étaient également dans les normes. La radiographie du thorax était normale. L’IRM cérébrale visualisait des séquelles de ramollissement hémorragique capsulo-lenticulaire droit avec discrète dégénerescence valérienne et atrophie sous-corticale en regard. La TDM thoraco abdominale montrait une importante masse surrénalienne droite avec absence de la glande surrénale gauche. On notait également la présence d’une masse rétrovésicale. La scintigraphie au MIBG mettait en évidence d’une récidive plurifocale d’un phéochromocytome (1 en projection de la loge surrénalienne droite, 2 foyers péri-aortiques, 1rétrovésical). La Tomoscintigraphie PET avait permis de mettre en évidence 02 masses, hypermétaboliques, correspondant aux localisations les plus captantes à la scintigraphie à la MIBG à savoir: la région surrénalienne droite et para rectale gauche. Le caractère nettement hyper métabolique de ces foyers ne permettait pas, sur la base de l’expérience de ce traceur dans cette indication, de prédire la présence ou à l’absence de malignité. A l’ECG on retrouvait une hypertrophie ventriculaire gauche avec indice de Sokolow positif, une onde T inversée en D III, AVR et AVF et un segment ST ascendant de V1 à V2. L’échographie cardiaque était normale. L’examen ophtalmologique observait une rétinopathie hypertensive.
Le diagnostic d’une récidive de phéochromocytome avec un foyer surrénalien droit, 02 foyers paraspinaux et 01 foyer rétrovésical a été retenu. Il a été institué un traitement alpha-bloquant puis beta bloquant contre l’HTA, suivi d’une exérèse complète des tumeurs, le 13 mars 2001, par voie chirurgicale thoraco-abdominale. L’évolution a été favorable, sans complications. Le patient a été mis sous cortisone 25mg et Fluorohydrocortisone 0.05 mg par jour, à vie. Au cours du suivi ultérieur, on a noté un examen ophtalmologique normal, une absence de tumeur thoraco- abdomino-pelvienne et la MAPA a révélé une HTA limite et labile. L’enquête familiale faite dans des conditions très difficiles nous a néanmoins permis de dresser l’arbre généalogique (figure 6).
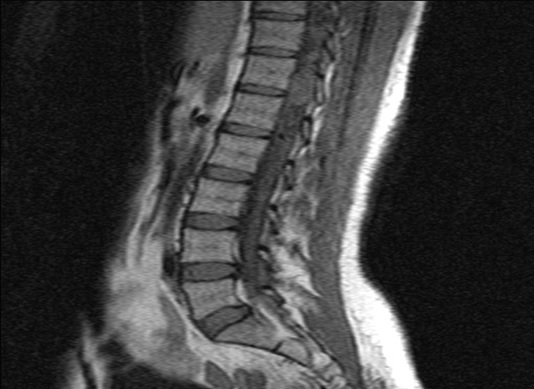 Figure 1
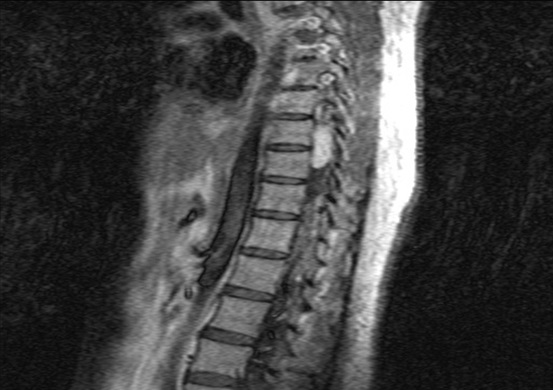 Figure 2
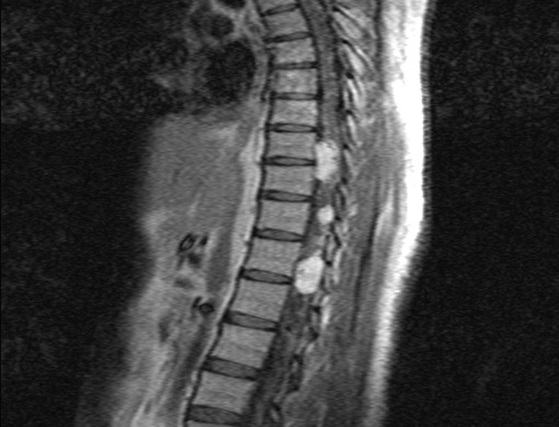 Figure 3
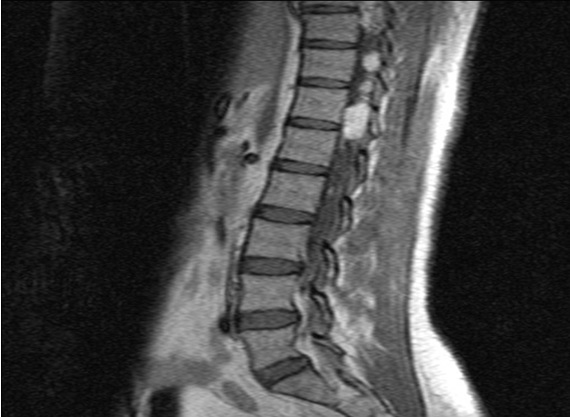 Figure 4
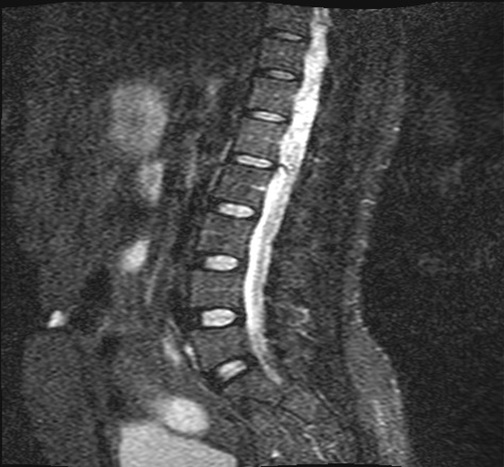 Figure 5
DISCUSSION
Notre observation a reposé sur l’anamnèse familiale, l’histoire de la maladie des deux membres traités et l’examen clinique du reste de la famille. Nos conclusions ne peuvent pas être affirmatives quant à la réalité de la mutation chez les autres membres de la famille. Nielsen SM et al avaient effectué une étude similaire à partir de l’anamnèse familiale, du test génétique et de la caractérisation phénotypique de chaque membre [11]. Notre observation est la première du genre à propos de la maladie de VHL décrite au Togo. L’âge de découverte de la maladie était en moyenne de 29 ans, parce que c’est à la deuxième manifestation de la maladie (récidive de phéochromocytome pour l’un et HB spinal pour l’autre) que le diagnostic a été évoqué.
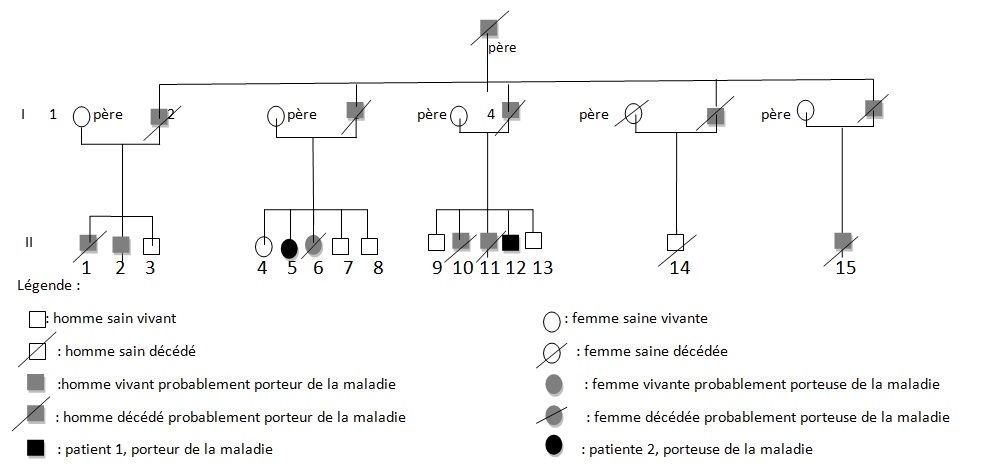 Figure 6
Le délai du diagnostic après les premiers signes de la maladie est estimé à une moyenne de 18.5 ans. Nous avons noté une égalité d’atteinte entre femme et homme, ce qui ne nous permet pas de tirer une conclusion car le nombre de patients de notre étude n’était pas significatif. Pavesi et al avaient retrouvé 35% de femmes atteintes pour 65% d’hommes au sein d’un groupe de 20 patients étudiés [14]. Nos patients étaient de race noire et de nationalité togolaise, à notre connaissance, seul un cas africain a été décrit par Naidoo en 1998 en Afrique du Sud, à propos d’une femme atteinte de multiples HB découverts au cours de la surveillance d’une grossesse [9]. Des cas de maladie de VHL ont été décrits dans les autres races surtout blanche. Les deux patients de notre observation avaient pour première manifestation un phéochromocytome découvert à un âge moyen de 10.5 ans superposable aux résultats d’Hammond et al avec à un âge moyen de 13 ans [5]. Notre patiente numéro 1 avait une atteinte bilatérale des surrénales. Notre patient numéro 2 a développé une récidive de phéochromocytome avec localisation extra surrénale à 21 ans soit 13 ans plus tard et l’autre, de multiples HB spinaux qui ont été découverts à l’âge de 37 ans soit 24 ans après le phéochromocytome. Ces évènements rappellent les études d’Opocher G et Schiavi F qui concluaient que la première cause de phéochromocytome associée aux paragangliomes est la maladie de VHL [13]. Nous n’avons retrouvé que deux types de lésions à savoir, dans l’ordre, le phéochromocytome et l’HB spinal. Nakaji S et al décrivaient le cas d’un patient de 40 ans porteur d’une mutation du VHL et également porteur de multiples tumeurs du pancréas et d’une tumeur rénale [13]. Il semblerait que parmi les lésions les plus fréquentes figurent les HB avec diverses localisations; ainsi en témoigne la présence d’HB spinal, retrouvé chez la patiente numéro 1. Il n’est pas rare que ces HB se présentent en de multiples foyers d’atteintes comme ceux observés chez notre patiente (cervical, dorsal, et dorsolombaire). Pavesi et al retrouvaient cervelet (42%), spinaux (38%), SNC (18%) et sac endolymphatique (2%) [14]. Les modes d’expression de la maladie sont multiples. Notre enquête familiale avait permis de retrouver que tous les 06 membres de la famille, que nous avons examiné, étaient porteurs d’une HTA plus ou moins labile, sans tumeur TAP avec une anamnèse familiale retrouvant une notion de HTA sévère ayant conduit au décès de 06 /16 membres de la famille. Le test génétique est le seul examen permettant d’affirmer l’existence de la maladie. Il aurait du être pratiqué chez notre patiente numéro 1 dès la découverte du phéochromocytome bilatéral. Cependant, la pratique du test génétique n’est pas systématique. A la suite de la deuxième atteinte, spinale, un test génétique a été réalisé chez notre patiente numéro 1, qui avait retrouvé une mutation du gène VHL rapportée comme étant une mutation p.Tyr98Cys décrite par Gallou [3]. Les autres modifications du gène ont été récapitulées par Nordstrom-O’brien [12]. A ce jour, nos patients âgés de 40 ans pour la patiente numéro 1 et de 31ans pour le numéro 2, sont vivants. Les deux présentent des séquelles neurologiques liées aux manifestions de la maladie, graves pour le patiente numéro 1 et minime pour l’autre. En ce qui concerne le risque de développer de nouvelles lésions à partir de 60 ans, Pavesi et al[14], ont trouvé pour l’HB du cervelet 84%, pour l’HB de la rétine 70%, et pour le cancer rénal de 69%. La moyenne d’âge de survie pour ces patients atteints de la maladie de VHL était de 49 ans, le cancer rénal étant la première cause de décès [14]. Nos deux patients ont eu une surrénalectomie bilatérale par laparoscopie en Suisse pour phéochromocytomes non malins. Le deuxième patient avait développé une récidive à 21 ans (soit 13 ans après) avec localisations extra-surrénales et surrénale controlatérale. Les deux patients sont cortico-dépendants et la permière patiente a développé un diabète cortico-induit. Pour Benhammou et al après 36 surrénalectomie, 11% des patients ont développés une récidive au même endroit, 11% récidivaient sur la surrénale controlatérale et seul 11% des patients étaient devenus cortico-dépendants, avec une médiane de survie de 9,25 ans [13]. La première patiente a été prise en charge en neurochirurgie pour des hémangioblastomes (développés 24 ans après le phéochromocytome) spinaux avec des séquelles une paraparésie, sans récidives. Pavesi et al [14] relevaient que 5% des patients après une intervention neurochirurgicae n’avaient pas eu une résection complète (confirmation par IRM), 75% avaient eu une amélioration de leur état neurologique, 20% avaient été stabilisés et 5% avaient eu une aggravation [14]. Une alternative à la chirurgie serait la radiochirurgie stéréotaxique, mais les résultats restent discutés [14]. Nos deux patients n’ont effectué aucune visite médicale dans le cadre du suivi de leur maladie, ceci pourrait être dû au fait qu’un plan de surveillance n’avait pas été établi à l’avance et à un manque de moyens financiers. Lammens et al ont noté que 1/4 à 1/3 des patients ne respectait pas le plan du suivi médical proposé [6]. De nos deux patients aucun n’a eu des enfants à la suite du conseil génétique effectué au cours du traitement de leurs phéochromocytomes en Suisse. Lytras A et Tolis G [7] ont décrit l’existence des troubles de la reproduction chez les patients VHL, notamment dus à des kystes du mésosalpinx, des cystadénomes du ligament large et des calcifications des cellules de Sertoli. Les autres membres de la famille, bien qu’étant au courant des risques de transmission, ont des enfants et des petits-enfants, pour lesquels il serait pertinent de réaliser une enquête.
CONCLUSION
Notre travail a porté sur l’observation clinique de deux cas de la maladie révélés par un phéochromocytome et associé à une enquête familiale. Ce travail relève les difficultés auxquelles les recherches sont confrontées en Afrique en raison de l’ignorance des populations (connaissance partielle de l’histoire familiale par les membres de la famille, absence de dossier médical bien tenu en possession des patients concernés), du manque de moyens financiers et de l’absence de moyens d’investigations (tests génétiques, IRM, dosage des catécholamines urinaires, audiométrie). Il nous a également permis de réaliser que des cas africains de la maladie de Von Hippel Lindau existent, et une investigation plus approfondie de la famille pourrait permettre d’envisager une prévention des complications possibles et une élaboration d’un canevas de suivi plus adapté. Cette étude devrait être complétée par d’autres études prospectives pour déterminer une prévalence au sein de la population africaine et togolaise en particulier. Ce travail devrait être complété par d’autres études prospectives sur la prévalence réelle des maladies génétiques au Togo.
REFERENCES
- BENHAMMOU JN, BORIS RS, Pacak K, PINTO PA, LINEHAN WM, BRATSLAVSKY G. Functional and oncologic outcomes of partial adrenalectomy for pheochromocytoma in patients with von Hippel-Lindau syndrome after at least 5 years of followup. J Urol. 2010;184(5):1855-9.
- EVANS DG, HOWARD E, GIBLIN C, CLANCY T, SPENCER H, HUSON SM, Lalloo F. Birth incidence and prevalence of tumor-prone syndromes: estimates from a UK family genetic register service. Am J Med Genet A. 2010; 152A (2):327-32.
- GALLOU C, CHAUVEAU D, RICHARD S, JOLY D et al. Genotype-phenotype correlation in von Hippel-Lindau families with renal lesions. Hum Mutat. 2004; 24(3):215-24.
- HAASE VH. The VHL tumor suppressor in development and disease: functional studies in mice by conditional gene targeting. Semin Cell Dev Biol 2005 16(4-5):564-574
- HAMMOND PJ, MURPHY D, CARACHI R, DAVIDSON DF, McINTOSH D. CHILDHOOD phaeochromocytoma and paraganglioma: 100% incidence of genetic mutations and 100% survival. J Pediatr Surg. 2010; 45(2):383-6.
- LAMMENS CR, AARONSON NK, HES FJ, LINKS TP et al. Compliance with periodic surveillance for Von-Hippel-Lindau disease. Genet Med. 2011;13(6):519-27.
- LYTRAS A, TOLIS G. Reproductive disturbances in multiple neuroendocrine tumor syndromes. Endocr Relat Cancer. 2009;16(4):1125-38.
- MOSS JM, CHOI CY, ADLER JR JR, SOLTYS SG, GIBBS IC, CHANG SD. Stereotactic radiosurgical treatment of cranial and spinal hemangioblastomas. Neurosurgery. 2009;65(1):79-85;
- NAIDOO K, BHIGJEE AI. Multiple cerebellar haemangioblastomas symptomatic during pregnancy. Br J Neurosurg. 1998;12(3):281-4.
- NAKAJI S, HIRATA N, KOBAYASHI M, SAITO J. Case of von Hippel-Lindau disease diagnosed by detection of multiple pancreatic endocrine tumors and renal tumor 13 years after bilateral adrenalectomy. Nihon Shokakibyo Gakkai Zasshi. 2010; 107(12):1978-87.
- NIELSEN SM, RUBINSTEIN WS, THULL DL, ARMSTRONG MJ, FEINGOLD E, YIP L, TISHERMAN SA, CARTY SE. Long-term outcomes, branch-specific expressivity, and disease-related mortality in von Hippel-Lindau type 2A. Fam Cancer. 2011 Dec; 10(4):701-07
- NORDSTROM-O’BRIEN M, VAN DER LUIJT RB, VAN ROOIJEN E, VAN DEN OUWELAND AM, MAJOOR-KRAKAUER DF, LOLKEMA MP, VAN BRUSSEL A, VOEST EE, GILES RH. Genetic analysis of von Hippel-Lindau disease. Hum Mutat. 2010 May; 31(5):521-37.
- OPOCHER G, SCHIAVI F. Genetics of pheochromocytomas and paragangliomas. Best Pract Res Clin Endocrinol Metab. 2010; 24(6):943-56.
- PAVESI G, FELETTI A, BERLUCCHI S, OPOCHER G,MARTELLA M, MURGIA A, SCIENZA R. Neurosurgical treatment of von Hippel-Lindau-associated hemangioblastomas: benefits, risks and outcome. J Neurosurg Sci. 2008 Jun; 52(2):29-36.
- RICHARD S, GRAFF J,LINDAU J, RESCHE F. Von Hippel-Lindau disease. Lancet 2004; 363 :1231-4.
- VORTMEYER AO, FALKE EA, GLA’SKER S, LI J, Oldfield EH. Nervous system involvement in von Hippel-Lindau disease: pathology and mechanisms. Acta Neuropathol 2013; 125:333-350
|
|