
|
|
|
CLINICAL STUDIES / ETUDES CLINIQUES
MYASTHENIE AUTO-IMMUNE : DIAGNOSTIC ET PRISE EN CHARGE. A PROPOS DE SIX CAS AU BENIN ET AU GABON
MYASTHENIA AUTOIMMUNE: DIAGNOSIS AND MANAGEMENT. ABOUT SIX CASES IN BENIN AND GABON
E-Mail Contact - GNONLONFOUN Dieudonné :
dignon2002@yahoo.fr
RESUME La myasthénie est une maladie auto-immune qui se caractérise par une faiblesse musculaire fluctuante, s’aggravant à l’effort et s’améliorant au repos, mettant en jeu le pronostic vital. Le polymorphisme clinique de cette affection rend souvent le diagnostic clinique difficile. Aussi le dosage des anticorps anti récepteur d’acétylcholine (AC anti Rach) et l’ENMG sont les principaux outils du diagnostic. Les auteurs rapportent 6 cas de myasthénie pour mettre en relief les difficultés de diagnostic et de prise en charge en Afrique sub-saharienne. Mots clés : Ac anti-Rach, Myasthénie, électromyogramme, Afrique ABSTRACT Myasthenia is a life threatening autoimmune disease presenting varying degrees of muscle weakness becoming worse during effort and released by rest. Its clinical polymorphism makes difficult the diagnosis. The anti-AChR antibodies testing and EMNG are the main diagnostic tools. Keywords: Anti-AChR antibodies, Myasthenia, Electromyogram, Africa INTRODUCTION La myasthénie est une affection de la jonction neuromusculaire caractérisée par une fatigabilité, une faiblesse musculaire intéressant les muscles oculomoteurs, bulbaires, squelettiques s’aggravant à l’effort et cédant au repos [3]. Il s’agit d’une maladie neurologique auto-immune pouvant menacer le pronostic vital par l’atteinte des muscles respiratoires [14]. L’observation de 6 cas nous permet de faire ressortir les caractéristiques cliniques, la difficulté de diagnostic et de prise en charge de cette affection dans nos régions nécessitant le plus souvent le recours aux évacuations sanitaires. OBSERVATIONS Cas 1 Il s’agit d’un homme de 55 ans sans antécédents particuliers qui présente une fatigabilité musculaire depuis quatre ans. Il a consulté en Médecine générale, puis en médecine interne sans qu’aucune cause à cette asthénie n’ait été retrouvée. Il s’y est associé un ptosis de l’il gauche motivant une consultation en ophtalmologie où le fond d’il et le champ visuel réalisés étaient sans anomalie. Quatre à cinq mois plus tard, le patient a signalé des troubles de la déglutition et de la mastication qui l’ont conduit en ORL. C’est devant la persistance des symptômes, qu’il a été vu en Neurologie au CNHU-HKM de Cotonou où l’examen physique retrouvait une fatigabilité musculaire plutôt à l’effort avec une amélioration sensible au repos, un ptosis de l’il gauche, des troubles de la déglutition et une tétraparésie. l’ENMG à la recherche de décrément par stimulation répétitive à 3c/s a mis en évidence un décrément significatif à 73% sur les muscles proximaux (couple nerfs facial-orbiculaire) et distaux (couple nerf médian-court adducteur du pouce) [figure n°1]. La myasthénie a été retenue et le score myasthénique était à 70/100. Les Ac anti Rach étaient présents à 2,7 nmol/l (N< 0,2 nmol/l), la tomodensitométrie thoracique a noté la présence d'un thymome [figure n°2]. Le bilan immunologique à la recherche d'Ac antinucléaires, antiDNA natif était négatif par contre on note une hyperthyroïdie avec un taux de T3 à 20,4 pmol/l et une thyréostimuline (TSH) normale. Nous avons conclu à une myasthénie généralisée auto-immune associée à une hyperthyroïdie. Le patient a été hospitalisé et a bénéficié d'un traitement à base d'anticholinestérasiques Ambénomyum (mytelase* 10mg un comprimé toutes les six heures et un antithyroidien de synthèse le Neomercazole 5 mg 1 comprimé toutes les 6 heures pendant 2mois puis 5 mg pendant 10 mois pour la prise en charge de l'hyperthyroïdie. L'évolution en cours d'hospitalisation était favorable et il est sorti vingt-cinq jours après de l'hôpital. L'exérèse chirurgicale du thymome n'a pas été réalisée faute d'un plateau technique adéquat. Mais l'inobservance du traitement liée à la fois aux difficultés financières du patient et aux ruptures de l'anticholinesthérasique en officine, entraîne des rechutes fréquentes nécessitant de nouvelles hospitalisations. Cas 2 Homme de 36 ans drépanocytaire homozygote SS admis pour une fatigabilité musculaire à l’effort évoluant depuis 4 ans associée à un ptosis de l’il gauche. Après un long parcours de soins (Tradi-praticien, Médecin généraliste, ophtalmologiste…) sans diagnostic et prise en charge précis, il fut envoyé dans la Clinique Universitaire de Neurologie du CNHU-HKM de Cotonou. Son examen neurologique objective, un ptosis de l’il gauche et une tétraparésie avec une force musculaire quottée à 4/5 à prédominance proximale. L’ENMG était normal, en particulier ne montrait pas de décrément. Le taux d’Ac anti-RAch était positif à 0,8 nmol/l (N< 0,2 nmol/l). La tomodensitométrie thoracique ne mettait pas en relief une anomalie thymique. Le bilan immunologique (anticorps antinucléaire, anti DNA natif, T4 T3, TSH) était sans particularité. Le diagnostic de myasthénie généralisée auto-immune sur terrain de drépanocytose a été posé. Le score myasthénique était coté à 85/100. Il a été hospitalisé et a reçu la Pyridostigmine (mestinon* 60mg) à la posologie de 1 comprimé toutes les 4 heures. L'évolution en cours d'hospitalisation a été favorable mais des rechutes sont fréquentes du fait de la non disponibilité du produit. Cas 3 Homme de 33 ans sans antécédents particuliers qui présentait depuis un mois une chute bilatérale des paupières et fatigabilité musculaire à l’effort. Très tôt, le tableau clinique s’est complété par une dysphonie, des troubles de la mastication et de la déglutition. Dans ce contexte, il a été vu à la clinique universitaire de neurologie du CNHU-HKM de Cotonou, où l’examen retrouvait un score myasthénique à 70/100. L’ENMG n’a malheureusement pas été réalisé devant les difficultés techniques. Le taux des Ac anti-RACH était à 0.6 nmol/l (N< 0,2 nmol/l). On notait la présence d'un thymome à la TDM thoracique. Le bilan immunologique était normal. Le diagnostic d'une myasthénie généralisée d'origine auto-immune a été retenu et un traitement à base d'Ambénomyum (mytelase* 10 mg) a été prescrit à la posologie d'un comprimé toutes les six heures. Devant la persistance des signes, l'Ambénomyum a été remplacé par la Pyridostigmine avec amélioration des symptômes. Il a bénéficié d'une évacuation dans un pays à technologie avancée où il a bénéficié d'une exérèse du thymome et des cures d'immunoglobuline IV à la dose de 0,4mg/kg/j pendant 5 jours. L'évolution clinique est favorable et il est régulièrement suivi. Cas 4 Homme de 64 ans sans antécédents particuliers est reçu dans le service de neurologie du CHU de Libreville pour un ptosis fluctuant associé à une diplopie fluctuante évoluant depuis 15 ans. Plusieurs consultations en ophtalmologie n’ont rien révélé de particulier sur le plan oculaire. A l’examen neurologique, le test au glaçon et la manuvre de Mary Walker étaient positifs. Il n’y avait pas de troubles de la déglutition et de la mastication, ni de déficit moteur. L’ENMG couple nerf facial-orbiculaires des paupièresréalisé en l’absence de jitter était normal. Seuls les Ac anti-Rach étaient positifs à 0,7 nmol/l (N< 0,2 nmol/l). La TDM thoracique n'objectivait pas d'anomalie thymique. Le bilan immunologique (anticorps antinucléaire, anti DNA natif, T4 T3, TSH) était sans particularité. Le diagnostic de myasthénie oculaire pure a été posé et le patient fut mis sous Pyridostigmine (mestinon *60mg) un comprimé par jour trois par jour avec une évolution clinique favorable. Cas 5 Patiente de 21 ans, étudiante sans antécédents particuliers présente un ptosis de l’il droit qui évoluait depuis deux semaines motivant une consultation chez un ophtalmologue où une corticothérapie per os a été instituée à la dose de 40 mg par jour. Devant la persistance des symptômes, associés à une fatigabilité musculaire à l’effort, elle consulte en Neurologie au CHU de Libreville. L’examen retrouve un score myasthénique à 65/100 avec un ptosis de l’il droit, des difficultés respiratoires, une voie nasonnée, des troubles de la déglutition et la mastication et une tétraparésie. L’ENMG réalisé sur le couple nerf médian/le court abducteur du pouce et le nerf facial/orbiculaire des paupières était normal. Un taux élevé d’Ac anti-RAch était à 100 nmol/l (N< 0,2 nmol/l) était noté. Le dosage des anticorps anti-MUSK était négatif, la TDM Thoracique a mis en évidence une masse homogène bien limitée au niveau du médiastin antérieur, rehaussée après injection de produit de contraste faisant évoquer un thymome. Le bilan immunologique (anticorps antinucléaire, anti DNA natif, T4 T3, TSH) normal. En dépit de la normalité (absence de décrément) de l'ENMG une myasthénie généralisée aigue d'évolution rapide a été retenue (Stade III de la Classification d'OSSERMAN). Elle a bénéficié de plusieurs protocoles thérapeutiques sans succès devant des difficultés respiratoires et l'aggravation des troubles de la déglutition. D'abord les anticholinestérasiques soit mestinon 60 mg un comprimé toutes les six heures puis une corticothérapie à base de methylprednisolone 250 mg dans 250 ml de sérum salé isotonique pendant cinq jours et enfin quatre séances de plasmaphérèse pour la poussée, elle a continué avec mestinon 1 comprimé toutes les 6 heures on a assisté à une régression des symptômes pendant deux semaines puis recrudescence des signes respiratoires et des troubles de la déglutition. Une évacuation sanitaire à l'étranger a été réalisée en urgence, et l'ENMG au jitter mettait en évidence un décrément à 47 %. Elle bénéficia d'une thymomectomie, d'un traitement à base d'immunosuppresseur (Azathioprine IMUREL*) à la posologie d'un comprimé par jour puis relais de mestinon 60mg un comprimé par jour. L'évolution clinique a été favorable et elle a repris ses activités. Cas 6 Jeune femme de 18 ans, élève aux antécédents maternels d’hyperthyroïdie consulte le service de neurologie du CHUL pour une fatigabilité musculaire à l’effort associée à un ptosis bilatéral prédominant à droite. Ces symptômes évoluaient depuis 2 mois. L’examen retrouve un score myasthénique à 85/100 avec un ptosis bilatéral et une tétraparésie. L’ENMG mettait pas en évidence des décréments. Les anticorps anti-RAch et MUSK étaient négatifs, la TDM thoracique ne montrait pas d’anomalie thymique et le bilan immunologique (anticorps antinucléaire, anti DNA natif, T4 T3, TSH) était sans anomalie. La myasthénie généralisée d’extension progressive sans atteinte respiratoire (Stade IIA d’OSSERMAN) a été évoquée et elle a bénéficié de plusieurs protocoles thérapeutiques. Le mytelase 10mg un comprimé toutes les six heures associé à des bolus de methylprednisolone 250 mg dans 250 ml de sérum salé isotonique pendant cinq jours ont permis une amélioration clinique de quelques semaines. Devant l’aggravation des signes avec apparition de dysphagie sans fausse route, de dysphonie (Stade IIB d’OSSERMAN), elle a bénéficié de 4 séances de plasmaphérèse réalisée par technique de centrifugation pendant une semaine (le premier et deuxième jour de la semaine, puis le quatrième jour et le dernier jour de la semaine) avec la collaboration du centre de transfusion sanguine. En effet, 400 ml sang total était prélevé par voie veineuse périphérique. La patiente recevait une perfusion de macromolécules pour éviter le choc a vacuo. La poche était ensuite transférée au laboratoire pour centrifugation. Le plasma du patient contenant les anticorps était retiré puis il lui était transfusé du plasma frais congelé (PFC) et son propre culot globulaire. La surveillance de la pression artérielle et du pouls étaient surveillés pendant la séance et un bilan biologique de contrôle 24 heures après chaque séance (NFS, ionogramme sanguin, protidémie, calcémie et bilan de coagulation). Cette plasmaphérèse a eu des effets spectaculaires dès les premiers jours mais une réapparition des signes après 2 semaines a été notée. L’évacuation sanitaire a été envisagée devant l’aggravation du score myasthénique passé de 85/100 à 60/100 et l’âge de la patiente. A l’étranger le dosage des Ac anti-RAch étaient positifs à 10 nmol/l (N< 0,2 nmol/l) et l'ENMG ne montrait pas de décrément. Elle est actuellement sous immunosuppresseur Azathioprine (Imurel) un comprimé par jour et 6 comprimés de Mytélase par jour soit 2 comprimés toutes les 8 heures. Elle bénéficie tous les mois des bolus de methylprednisolone 250mg dans 250 ml de sérum salé isotonique pendant 3 jours. L'évolution est en dent de scie elle s'améliore après la corticothérapie puis trois semaines plus tard on assiste à une poussée. DISCUSSION L’analyse de nos cas relève une errance diagnostique pouvant s’étaler sur plusieurs années. Les patients consultent plusieurs médecins sans que le diagnostic ne soit établi. (Cas 1, 2 et 4). Il s’agit généralement de non neurologues, peu outillés pour le diagnostic de cette affection rare. Dans tous nos cas, dès la consultation en neurologie, le diagnostic a été évoqué et confirmé en dépit du plateau technique limité. Dans notre série, il y avait 4 hommes pour 2 femmes. Les femmes avaient moins de 25 ans. La littérature indique que la myasthénie débute à tout âge, de 6 mois à plus de 80 ans mais affecte surtout les adultes de moins de 40 ans, en majorité des femmes [6, 8, 9]. Deux hommes avaient plus de cinquante ans. Les hommes dans les formes plus tardives, à partir de la sixième décennie deviennent majoritaires. Ce constat explique la prédominance masculine dans notre série. Dans notre milieu d’exercice, pauvre en examen paraclinique, la clinique reste le principal outil de diagnostic. En effet, les premières manifestations sont purement oculaires, prenant la forme d’un ptosis et /ou d’une diplopie. Ces manifestations ont été observées chez l’ensemble de nos patients. Ainsi, Ojini et collaborateurs à Lagos dans leur étude ont retrouvé une incidence élevée de manifestations oculaires soit 85,1% pour le ptosis et 37 % pour la diplopie [24]. Heckmann et coll. montrent que les sujets noirs étaient plus susceptibles que les blancs de développer une ophtalmoplégie et un ptosis complets [12]. Après un an d’évolution, chez 80 à 90 % des patients, d’autres territoires sont affectés tels que les muscles pharyngolaryngés, les muscles des membres comme observés chez nos patients excepté le cas 4. Par contre l’atteinte des muscles respiratoires et les troubles sévères de la déglutition caractérisant les formes graves (20 à 30 % des patients dans la littérature) ont été observées chez deux de nos patients [10, 11]. L’ENMG, examen électrophysiologique clé du diagnostic de la myasthénie, a été réalisé chez 5 patients sur 6. Il objective un décrément dans 2 cas. Le décrément était très marqué (73%) chez un seul sujet. L’autre sur fibre unique au niveau de la paupière après une évacuation sanitaire a montré un décrément à 47%. Il semble que la technique utilisée, et plus particulièrement le choix des couples nerf-muscle exploré, fasse considérablement varier la sensibilité de cet examen [18, 23] En effet, il est décrit 8 couple nerfs-muscles(fibulaire-tibial,antérieur,radial-anconé,spinal-trapeze,facial-nasale ou le facial-orbiculaire des paupières, les muscles du plancher buccal en cas de trouble de la phonation ou de la déglutition et les couples médian-court adducteur du pouce ou nerf cubital court abducteur du cinq doigt).Le choix des couples répond à notre pratique quotidienne, les couples nerfs facial-orbiculaire des paupières ou nerf médian -court adducteur, même si les couples nerf radial- muscle Ancône et nerf spinal-trapèze sont classiquement les plus sensibles[23], même si pas utilisé dans notre étude mais d’autres auteurs ont utilisé les même couples nerfs-muscles que dans notre pratique quotidienne notamment la stimulation du nerf facial/muscle nasal ils pensent que c’est une technique facilement réalisable, non douloureux et fiable dans ses réponses, il est donc recommandé en première intention dans les myasthénies oculaires et même dans les myasthénies généralisées [17], la négativité du test serait peut-être dû à d’autre paramètres. L’absence dans notre milieu d’exercice de l’étude par le Jitter qui permet une évaluation fine de la transmission neuromusculaire au niveau de l’unité motrice pourrait expliquer les faux négatifs [23]. Il se pose le problème de disponibilité du matériel (ENMG) et l’absence de ressource humaine qualifiée, nous obligeant à procéder à l’évacuation des patients dans des pays à technologies plus avancée. La normalité de l’ENMG ne doit pas exclure le diagnostic de la myasthénie. L’ENMG a été réalisé sur les couples nerfs médian/court adducteur du pouce le nerf facial/orbiculaire des paupières dans la littérature le choix du couple nerf-muscle peut considérablement faire varier la sensibilité de cet examen mais en pratique 8 nerfs- muscles sont explorés y compris ce que nous avons choisi pour explorer. Dans notre série, l’ENMG était normal chez trois patients présentant pourtant une myasthénie généralisée séropositive. En effet, le dosage des Ac anti-RAch a été réalisé chez les 6 patients. Ils étaient positifs chez la plupart de nos patients avec une patiente présentant un fort taux à 100nmol/l. Leur positivité dénote d’une myasthénie séropositive. Mais des cas de myasthénie séronégative sont également rapportés (cas 6) [1, 2, 4]. La négativité des Ac anti-RAch induit souvent la recherche des Ac anti-MUSK [8, 9]. Dans les myasthénies généralisées, les AC anti -Rach sont présents dans 80% des cas et absents dans 20% des cas [6;5]. Un thymome peut y être associé dans 20 a` 30 % des cas. En effet nous avons noté la présence de thymome chez 3 de nos patients. Le rôle du thymus et du système immunitaire cellulaire T dans l’initiation et la modulation de la production des Ac anti-RACH est encore discuté mais semble important [12]. La myasthénie chez les patients avec thymome est, selon plusieurs auteurs, plus sévère que chez les patients sans thymome [14,15,19,22]. L’association de la myasthénie à d’autres pathologies auto-immunes a été retrouvée dans la littérature [12]. Aussi avons-nous pu retrouver un cas d’hyperthyroïdie familiale et une hyperthyroïdie chez un patient avec un taux de T3 à 20,4pmol/l et un taux de TSH normal. L’association myasthénie et hyperthyroïdie est bien connue et a été retrouvée dans de nombreux pays en Amérique et aussi en Afrique du Nord [1, 2]. La littérature suggère un rôle possible des facteurs génétiques dans le développement des maladies auto-immunes et peut-être aussi dans l’association myasthénie et dysthyroïdie [24]. Le protocole de prise en charge utilisé au Benin et au Gabon est en accord avec l’arbre décisionnel de la myasthénie, même s’il manque une logistique pour la gestion au quotidien entre le retard du diagnostic et le plateau technique inadéquat [5]. Traitement a consisté à la mise sous anticholinestérasiques soit Pyridostigmine bromure (mestinon 60 mg) ou ambenonium bromure (mytelase 10 mg) avec une augmentation progressive des doses selon les cas pour atteindre une dose minimale efficace afin d’éviter les effets secondaires muscariniques. En effet, les anticholinestérasiques sont le traitement de première intention de la myasthénie. Ils augmentent la quantité d’acétylcholine au niveau de la plaque motrice et sont efficaces dans toutes les formes de la myasthénie [24]. Devant la persistance des troubles de la déglutition ou de la fatigabilité musculaire à l’effort, on a eu recours à une cure de corticothérapie tous les mois dans certains cas, d’abord en bolus pendant 3 jours à la dose de 250 mg dans du sérum isotonique à faire passer en 30 minutes en association avec le traitement adjuvant (Albendazole 400mg en prise unique, supplémentation en calcium et en potassium et un protecteur gastrique). Puis un relais avec la corticothérapie par voie per os à 0,5 ou 1 mg/kg a été effectuée du fait des rechutes fréquemment observées. Une initiation de traitement à base d’immunosuppresseur (Azathioprine) a été proposée devant la persistance des signes sous l’association anticholinestérasiques et corticothérapie en bolus avec une nette amélioration clinique. Selon de nombreuses études, le traitement à base d’immunosuppresseur est utilisé pour diminuer les anticorps pathogènes [7,17,24]. L’évolution sous ce traitement était favorable chez 3 patients au cours de leur hospitalisation. Mais des rechutes étaient fréquentes du fait de manque de moyens financiers pour faire face à l’achat d’anticholinestérasiques. Une patiente myasthénique porteuse d’un thymome devant la persistance des symptômes avait bénéficié de 4 séances de plasmaphérèse puis d’une évacuation sanitaire pour une thymomectomie avec une évolution clinique favorable. Des études ont relevé que dans la majorité des cas, plusieurs séances de plasmaphérèse sont nécessaires afin d’éliminer la macromolécule pathogène. Après la séance de plasmaphérèse, la concentration de macromolécule (la plupart des cas, une immunoglobuline) va à nouveau monter, tout d’abord à cause d’un effet rebond dû à un shift de la molécule de l’espace interstitiel, puis par la néosynthèse de l’immunoglobuline via les lymphocytes-B, d’où l’importance d’un traitement cytotoxique adjuvant. Certains auteurs ont trouvé que l’adjonction d’immunosuppresseur est indispensable afin de prévenir la remontée rapide des Ac anti-RACH, d’autres par contre suggèrent que les échanges plasmatiques rendent les lymphocytes plus sensibles à l’action des immunosuppresseurs. Ainsi, il pourrait y avoir une synergie entre les échanges plasmatiques et les immunosuppresseurs. Après trois séances plasmaphérèse, on diminue la charge corporelle totale d’IgG de 70%, d’IgM de 80% et il faudra environ cinq séances pour éliminer 95% des immunoglobulines [13,16,21]. La plasmaphérèse a une grande rapidité d’action et permet de diminuer la séquestration des anticorps anti- RACH avec un délai d’action de 12 jours [7,10]. Le bénéfice de la thymomectomie devant une myasthénie est prouvée dans la littérature. En effet, le thymome est souvent associé dans 10 à 15% des myasthénies et il existe une association positive dans la plupart des études entre la thymomectomie et l’amélioration de la myasthénie [23,12]. Cette observation est faite dans notre série. Certaines caractéristiques phénotypiques de la myasthénie en fonction des différences raciales pourraient expliquer l’issue du traitement. Les facteurs biologiques pourraient être incriminée d’où la nécessité d’étudier ces facteurs pour une approche plus rationnelle de la thérapie immunosuppressive [12]. CONCLUSION Le fardeau des maladies neurologiques peut être en augmentation en particulier dans les pays en développement. Les maladies non infectieuses occupent une part importante soit 78,2% et la myasthénie occupe 1,0% dans ce large éventail de maladie neurologique [7]. 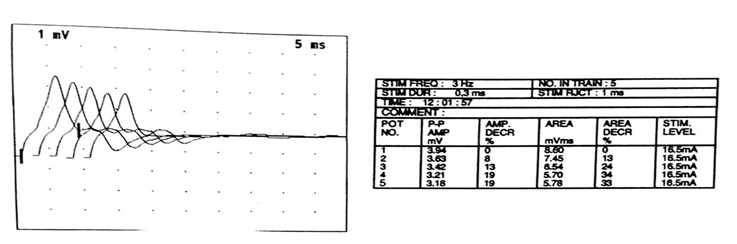 Figure 1 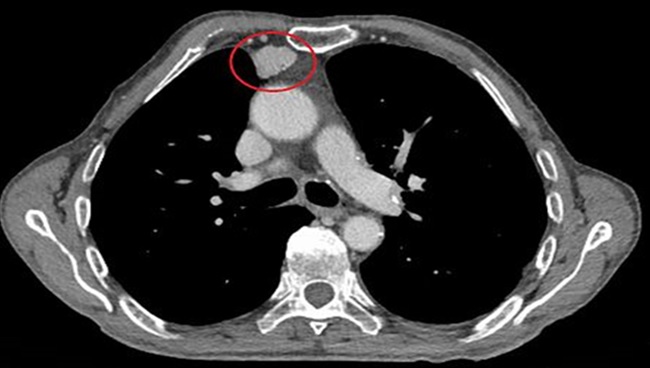 Figure 2 REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647