ORIGINAL PAPERS / ARTICLES ORIGINAUX
ASPECTS BIOCHIMIQUES DE L’EPILEPSIE AU GABON. INTERET DU GLUTAMATE
BIOCHEMICAL ASPECTS OF EPILEPSY IN GABON
- Service de Neurologie, Centre Hospitalier de Libreville (CHL), BP 2228 Libreville Gabon
- Service de Biochimie, Faculté de Médecine, Université des Sciences de la Santé, BP 18027 Libreville Gabon
- Service de Neurochirurgie, Fondation Jeanne Ebori (FJE), Libreville Gabon
E-Mail Contact - KOUNA NDOUONGO Philomène :
RESUME
Introduction
L’hyperexcitabilité neuronale observée dans les crises épileptiques serait la résultante d’un déséquilibre entre une inhibition par l’acide ?-amino butyrique (GABA) et l’excitation par le glutamate, en faveur de ce dernier.
Objectif
Le but de notre travail est de déterminer les taux sériques de glutamate, lactate, lacticodéshydrogénase et glutamine chez les épileptiques gabonais afin d’évaluer leur pouvoir informant dans le pronostic et le suivi des épilepsies dans notre environnement.
Méthodes
L’étude a porté sur 43 patients des deux sexes dont l’âge moyen est de 31,4±23,9 ans (avec des extrêmes allant de 2 à 75 ans) hospitalisés et vus en consultations externes, faisant principalement une crise par mois (76,7%) et une prédominance des crises généralisées (67,4%).
Résultats
Les étiologies les plus fréquemment retrouvées concernent les accidents vasculaires cérébraux (26,1%) et les infections (11,6%). Une augmentation nette des taux sériques de glutamate est observée, allant de 147 à 600 µmol/l, pour une moyenne de 351,7±119,6 µmol/l (normale : 40-120 µmol/l).
Conclusion
Cette étude préliminaire appelle des recherches complémentaires sur des séries longitudinales concernant les clairances hémato-méningées du glutamate pour bien cerner les problèmes d’excitotoxicité liés au glutamate.
Mots clés : Afrique, Epilepsie, Gabon, Glutamate
SUMMARY
Introduction
The neuronal excitability which can be observed during the epilepsial crisis should be the result of a disequilibrium between the inhibitory action of GABA (y-Amino Butyric Acid) and the excitatory action of glutamate, in favour of the latest.
Objectives
The main goal of our study is to determine the glutamate seral in Gabonese people suffering from epilepsy in order to evaluate their informative power for the pronostic and the follow-up of epileptic crisis in our environment.
Methods
The study has concerned 43 patients of both sexes whom medium age was 31,4±23,9 years (from 2 to 75 years old), hospitalised and from external consulting.
Results
Results obtained showed increased levels of seral glutamate (351,7±119,6 µmol/l, from 147 to 600 µmol/l (normal range from 40 to 120 µmol/l). This preliminary study needs to be completed with longitudinal assays of glutamate in order to improve the pronostic of epilepsy.
Keywords : Africa, Epilepsy, Gabon, Glutamate
INTRODUCTION
L’épilepsie est définie comme une affection caractérisée par la récurrence d’au moins deux crises convulsives non provoquées, survenant dans un laps de temps de plus de 24 heures. L’épilepsie est un véritable problème de santé publique dans les pays en voie de développement [9] où son incidence est près de deux fois plus élevée que dans les pays développés (113 – 119 pour 100.000 habitants par an contre 69 pour 100.000 habitants). Sa gravité est liée à sa mortalité qui est deux à trois fois celle de la population générale et à son caractère invalidant puisque le taux de récidive est estimé à 71% dans les trois ans qui suivent une première crise [5,6]. La rémission sous traitement survient dans 70 à 80% des cas, conduisant à arrêter le traitement. Cependant, le risque de rechute après arrêt du traitement est de 17-50% des cas. Actuellement, il n’existe pas de marqueurs fiables permettant de prédire le risque de récidive des crises épileptiques et ainsi, d’adapter la durée et la posologie du traitement prophylactique.
Le but de cette étude prospective a été de déterminer si les taux sériques d’un neurotransmetteur très impliqué dans la survenue de l’épilepsie, le glutamate, en relation avec les marqueurs directs et indirects de l’acidose (glutamine, lactate, lacticodéshydrogénase) étaient élevés chez les patients épileptiques avant tout traitement, et si cette élévation pouvait être corrélée avec le risque de récidive des crises épileptiques. La mise en évidence d’une telle corrélation pouvant avoir des implications thérapeutiques.
MATERIEL ET METHODES
Cette étude prospective a été réalisée entre février et août 2002 sur deux sites : le service de neurologie du Centre Hospitalier de Libreville (CHL) et le service de Neurochirurgie de la Fondation Jeanne Ebori (FJE). Les dosages biologiques ont été réalisés dans le Laboratoire de Biochimie de la Faculté de Médecine de Libreville et au Laboratoire Cerba Pasteur en France.
Les critères d’inclusion ont été: une épilepsie active, la survenue d’au moins deux crises convulsives, un électroencéphalogramme anormal, une glycémie normale, l’absence de drépanocytose et une numération formule sanguine normale.
Quarante trois patients des deux sexes, âgés de 2 à 75 ans ont été inclus dans l’étude. Chaque patient inclus (ou son entourage) était soumis à un interrogatoire complet, visant à déterminer l’ensemble des caractéristiques de l’épilepsie, puis subissait un examen général complet.
Les prélèvements sanguins ont été effectués sur tubes secs, EDTA et fluorure oxalate. Le glutamate et la glutamine ont été dosés par Chromatographie Liquide Haute Performance (HPLC) avec détection électrochimique, la LDH et les lactates par spectrophotométrie classique. Afin d’étudier la valeur pronostique du dosage sérique du glutamate et de la glutamine sur la fréquence des récidives, les patients ont été divisés en deux groupes :
– Groupe 1 (n = 17): patients ayant une crise épileptique ou moins par mois;
– Groupe 2 (n = 26): patients ayant présenté plus d’une crise épileptique par mois.
L’analyse statistique des données est réalisée à l’aide du logiciel EPI 6. L’analyse des variances (ANOVA), le Khi deux et le test non paramètrique H de Kruskal Wallis ont été les tests de comparaison utilisés. Les valeurs alpha <= 0,05 ont été considérées significatives.
RESULTATS
L’âge moyen de notre population d’étude est de 31,4±23,9 ans. Il y a 25 hommes (58,1%) âgés de 23,2±18,9 ans et 18 femmes (41,9%) âgées de 36,6±25,7 ans en moyenne. Il n’y a pas de différence significative entre ces deux groupes.
Les crises sont généralisées chez 29 patients (67,4%) et partielles chez 14 (33,6%). Elles surviennent une fois par mois chez 76,7% des patients, deux fois chez 9,3%, trois fois chez 2,7% et quatre fois chez 11,3% des patients (figure 1).
La fréquence mensuelle moyenne des crises est de 1,0±0 dans le groupe de malades hospitalisés versus 1,8±0,2 dans le groupe de malades non hospitalisés. La principale étiologie retrouvée est représentée par les accidents vasculaires cérébraux (Figure 2).
Les taux de glutamate dans le sérum de nos patients varient de 147 à 600 µmol/l, pour une moyenne de 351,7±119,6 µmol/l. L’intervalle de référence pour la technique utilisée est de 40 – 120 µmol/l. Tandis que les valeurs moyennes du glutamate des patients hospitalisés ne sont pas significativement différentes de celles des patients non hospitalisés (348,1±114,4 µmol/l, contre 356,0±128,7 µmol/l), avec p = 0,97.
Les valeurs de glutamine retrouvées dans l’échantillon sont normales ou relativement basses pour la plupart, la moyenne étant de 239,2±9 (98 – 399) µmol/l. Les valeurs normales pour la technique étant de 180 – 550 µmol/l.
Les valeurs de LDH varient de 158 à 650 U/I, avec une moyenne de 359±112 U/l. Les valeurs de LDH ne diffèrent pas significativement selon que les patients sont hospitalisés ou pas (p = 0,39). Il existe cependant une relation entre la LDH et la fréquence des crises (p=0,00).
Les valeurs des lactates varient de 2,1 à 15,5 mmol/l avec une moyenne de 5,8±3,1 mmol/l. La plupart des patents, 38 sur 43 (88,4%) ont des valeurs de lactates supérieures aux valeurs normales. Les valeurs normales chez les patients hospitalisés (6,0±3,8 mmol/l) ne diffèrent pas statistiquement de celles des patients non hospitalisés (p=0,92).
DISCUSSION
Dans les pays en voie de développement, presque toutes les études montrent une précocité dans l’installation de la maladie épileptique. A Dakar (Sénégal), 48,2% des épileptiques ont moins de 5 ans et les infections sont, avec 67%, l’étiologie la plus citée [3]. Dans les pays industrialisés, le début de l’épilepsie est moins précoce [11]. Dans notre étude, il existe deux pics de prévalence, situés aux extrémités de la vie, c’est-à-dire à 0 – 5 ans et 60 – 70 ans. Dans la première tranche d’âge, la précarité des conditions de suivi des grossesses, de la prise en charge périnatale, les infections materno-foetales, le paludisme, sont autant de causes et de circonstances favorisantes et/ou déclenchantes. Notre population comportait 13,95% d’enfants de moins de 5 ans et l’étiologie infectieuse n’est retrouvée que dans 11,6% des cas, contre 27,9% pour les AVC. Dans la dernière décennie de la vie, la sommation des effets socioprofessionnels tout au long de la vie, mais aussi des causes organiques peuvent justifier cette fréquence élevée.
La plupart des études épidémiologiques concernant les aspects cliniques dans les pays en voie de développement retrouvent une prédominance des crises généralisées, suivies des crises partielles puis les crises non classées. Les résultats de notre étude font ressortir une prédominance des crises généralisées tonicocloniques (67,4%), suivies des crises partielles (32,6%). L’écart avec les résultats des pays développés pourrait être dû à l’absence de données de l’EEG qui permettraient de mettre en évidence les foyers irritatifs et de faire le diagnostic d’une généralisation secondaire. Par conséquent, plusieurs crises étiquetées comme généralisées sont en fait des crises partielles secondairement généralisées [2].
Au plan biochimique, le glutamate est le neurotransmetteur majeur dans la genèse de l’excitabilité cellulaire et synaptique neuronale et le primum movens de l’excitotoxicité [8]. Son action s’accomplit via ses récepteurs et s’accompagne d’une entrée massive de Ca2+ à l’intérieur de la cellule. Cette action peut être médiée par le CO et le NO produits par la NO synthétase neuronale. L’effet direct de celui-ci est délétère, mais en particulier, il potentialise la toxicité du glutamate en entretenant une perfusion sanguine et une oxygénation excessive, conduisant à la formation du peroxynitrile (-OONO), oxydant cytotoxique. Quant au CO, il entretiendrait l’hyperhémie concomitante à l’épilepsie, régulant le débit sanguin, lequel est associé à une libération de glutamate. Dans notre étude, la concentration du glutamate est très élevée. Elle l’est aussi bien chez les malades hospitalisés que ceux vus en externe, sans différence significative entre les deux groupes (p=0,97). Ces taux très élevés de glutamate seraient justifiés par le fait que nous enregistrons 67,4% d’épilepsies généralisées et 32,6% d’épilepsies partielles qui peuvent secondairement se généraliser (21,2% dans une série de Dakar, dans lesquelles 60,5% sont tonico-cloniques et 2,3% myocloniques). On pourrait ainsi craindre en contexte infectieux (Sida, paludisme) et non infectieux (traumatisme, alcool) et en présence de circonstances favorisantes, qu’une interaction permanente avec des taux de glutamate décrochés ne soit un terrain de prédilection à la recrudescence des crises d’épilepsie. Gamberino [4] confirme en effet que l’élévation du taux de glutamate et le neuro-sida sont des circonstances d’une excitotoxicité génératrice d’une dégénérescence aiguë progressive.
Chez les individus normalement oxygénés et perfusés, la concentration des lactates varie de 0,5-2,5 mmol/l. Les occasions de privation ou de réduction de l’oxygénation des tissus telles l’hypoxie restent difficiles à détecter au lit du malade. Elles conduisent à l’augmentation de l’acide lactique et ont été largement décrites par de nombreux auteurs et ont mis en évidence l’intérêt du dosage de l’acide lactique [1,12].
Les travaux de Hazouar [7] sur la crise convulsive mettent en évidence un intérêt certain pour les dosages des lactates. L’acidémie lors de la crise convulsive est d’après lui, associée à une acidose métabolique. Cette acidose est le résultat d’une hypoxémie, d’une élévation critique des catécholamines et du métabolisme aéro-anaérobie musculaire pendant les crises tonico-cloniques. La signification clinicobiologique des lactates veineux périphériques est bonne pour l’aide au diagnostic de la crise généralisée. La disponibilité du lactate et le déficit énergétique pourraient entraîner une double destinée métabolique: la néoglucogenèse avec activation de la pyruvate décarboxylase, mais aussi la formation du glutamate [1] entraînant ainsi le cercle vicieux excitotoxicité – acidose. Dans notre étude, 88,4% des patients ont une lactatémie élevée. La lactatémie moyenne de nos patients est de 5,8±3,1 mmol/l. La lactatémie des malades hospitalisés ne diffère pas significativement de ceux vus en externe (p=0,92). La plupart des épileptiques de notre série (67,4%) font des crises tonico-clonique et myocloniques.
Le profil épidémiologique de notre population de travail où prédominent les AVC à un taux de 26,1 % (composante ischémique et séquellaire), les causes périnatales pour 16,3% (souvent attribuables aux infections dans notre terrain) et des infections (11,6%) justifient cette hyperlactatémie et l’entretiennent. On peut craindre alors un cercle vicieux dans la fréquence des crises avec des manifestations biologiques et électriques à bas bruit, suivis de crises patentes.
La LDH est un essuie glace métabolique entre le lactate et le pyruvate. Sa concentration suit le taux de lactate. En effet, Robinson [12] indique que dans les conditions d’hypoxie, le rapport NAD+/NADH a tendance à baisser dans la mitochondrie, à solliciter un équilibre avec le rapport NAD+/NADH cytosolique. Ce dernier va baisser à son tour, au détriment du NAD+. La forme réduite, NADH, sera prépondérante dans le cytosol, avec comme conséquence métabolique, la transformation préférentielle du pyruvate en lactate. Par ailleurs, il ressort de plusieurs études que le lactate étant produit en abondance en aérobiose et le pyruvate consommé, le rapport lactate/pyruvate se trouve élevé. De plus, ce pool de lactate va recevoir aussi celui qui diffuse des cellules sans mitochondries, à l’exemple des hématies. Tout ce qui précède explique l’augmentation de la LDH chez les patients de notre étude, mais aussi le degré de corrélation avec le lactate (p=0,00). Mieux, on a observé une relation particulière entre la fréquence des crises et le taux de LDH (p=0,00). Plus ce taux est élevé, plus le nombre de crises par mois est augmenté. La moyenne des crises chez les malades hospitalisés est de 1,8±1, contre 1,0 chez les non hospitalisés. Cette différence est significative (p=0,004). Certains de nos patients font même quatre crises par mois (11,3%).
De nombreuses études ont mis en évidence la baisse de la glutamine dans les maladies chroniques et son augmentation dans les états critiques [10], en particulier, dans le paludisme sévère, situation inductrice d’acidose par hyper lactatémie. Par contre, Wong [13] montre que son taux s’élève en particulier chez les enfants qui vont décéder au cours du paludisme grave ; cette élévation étant un mécanisme de lutte contre l’acidose. Dans notre étude, 37,2% des sujets ont des taux de glutamine bas. Les situations pre mortem n’y sont pas atteintes. La lutte contre l’acidose, mais aussi la formation préférentielle du glutamate pourrait expliquer cette baisse.
CONCLUSION
Dans cette étude prospective à visée physiopathologique, sur une série de 43 patients épileptiques, les principaux événements métaboliques mis en évidence dans ce travail concernent:
Au plan clinique et épidémiologique
– l’étiologie des crises (pathologies vasculaires, facteurs périnataux et infections)
– le type d’épilepsie (en majorité les crises généralisées dans 67,4% des cas)
– La fréquence des crises (jusqu’à 4 crises par mois chez 11 % des patients, pour une fréquence moyenne de 1,1).
Au plan biologique
– L’hyperglutamatémie (principal neurotransmetteur responsable de l’excitotoxicité)
– L’hyperlactatémie avec une faible décroissance (auto entretenue par l’association des étiologies suggestives de l’hypoxie)
– L’élévation des taux de LDH corrélée avec l’hyperlactatémie et la fréquence des crises, justifiées par la préférence de la voie métabolique allant du pyruvate au lactate.
Ce climat étiologique et métabolique est négatif pour l’environnement de l’épileptique gabonais car le mécanisme « kindling », d’excitabilité à bas bruit des structures musculaires et neuronales métabotropiques constitue une source permanente de l’avènement des crises classiques.
Enfin, des recherches complémentaires sur des séries longitudinales concernant les clairances hémato-méningées seront nécessaires pour étayer les notions de pronostic suggérées par le glutamate, les lactates et la LDH.
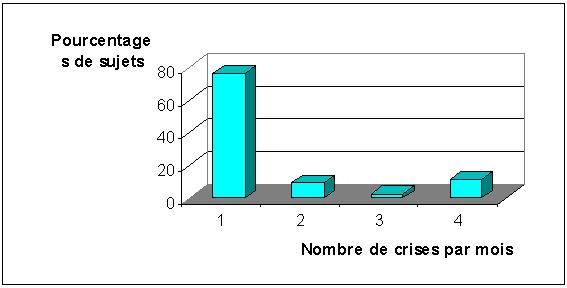
FIGURE 1 : Fréquences mensuelles des crises

REFERENCES
- DE BACKER D, VINCENT JL. Monitorage des taux sanguins de lactate en réanimation. Ann Biol Clin. 2000 ; 58: 487 – 90.
- FARNARIER G, MOUBEKA – MOUNGUENGUI M, KOUNA PH; ASSENGONE – ZEH Y, GUEYE L. Epilepsies dans les pays tropicaux en voie de développement: étude de quelques indicateurs de santé. Epilepsies 1996; 8: 189 – 213.
- FISHER RS, KRAUSS GL, RAMSAY E, LAXER K, GATES J. Assessment of vagus nerve stimulation for epilepsy: report of therapeutics and the technology assessment subcommittee of the American Academy of Neurology. Neurology 1997; 49: 293 – 7.
- GAMBERINO WC, BERKICH DA, LYNCH CJ, XU B; LANOUE KF. Role of pyruvate carboxylase in facilitation of synthesis of glutamate and glutamine in cultured astrocytes. J Neurochemistry 1997; 69, 6: 2312 – 25.
- GRUNITZKY K. E, DUMAS M, MBELLA E. M, BALOGOU A, BELO M, HEGBE YM, RAMIANDRIOSA H. Les épilepsies au Togo. Epilepsies. 1991; 3: 295 – 303.
- HAUSER WA, ANNEGERS JF, KURLAND LT. Incidence of epilepsy and unprovoved seizures in Rochester, Minnesota: 1935 – 1984. Epilepsia. 1993 ; 34: 453 – 68.
- HAZOUARD E, DEQUIN PF, LANOTTE R, LEGRAS A, FERRANDIERE M, PERROFIN D. Perte de connaissance : intérêt du dosage des lactates veineux pour le diagnostic de crise convulsive. La Presse médicale. 1998 ; 27 (13) : 604 – 7.
- HUGON J, VALLAT JM, DUMAS M. Rôle du glutamate et de l’excitotoxicité dans les maladies neurologiques. Rev Neurol (Paris). 1996; 152 (4) : 239 – 48.
- LAVADOS JL, GERMAIN A, MORALES M, CAPEROS M, LAVADOS A. A descriptive study of epilepsy in the district of El Salvador, Chile, 1984 – 1988. Acta Neurol Scand. 1992; 85: 249 – 56.
- OUDEMANS-VAN STRAATEN HM, BOSMAN RJ, TRESKE M, VAN DER SPOEL HJI, ZANDSTRA DF. Plasma glutamine depletion and patient outcome in acute ICU admissions. Intens Care Med. 2001; 27: 84 – 90.
- PRASAD AN, STAFSTROM CF, HOLMES GL. Alternative epilepsy therapies: the ketogenic diet, immunoglobulins and steroids. Epilepsia 1996, 37 (suppl 1), 81 – 95.
- ROBINSON BRIAN H. Lactic acidemia. ln: Scriver CR; Beaudet AL; Sly WS; Valle D. The metabolic basis of inherited disease; Mc Graw-Hill, sixth edition, vol. 1. 1989: 869-88.
- WONG MC, SUITE NDA, LABAR DR. Seizures in HIV infection. Arch Neurol. 1990 ; 47 :640-2.