ORIGINAL PAPERS / ARTICLES ORIGINAUX
L’EXAMEN CLINIQUE POUR LA DETECTION DE LA POLYNEUROPATHIE ET DE L’ARTERIOPATHIE DES MEMBRES INFERIEURS EN CONSULTATION DE DIABETOLOGIE A ABIDJAN : QUELLE VALEUR DIAGNOSTIQUE?
CLINICAL EXAMINATION FOR THE DETECTION OF LOWER LIMBS POLYNEUROPATHY AND ARTERIOPATHY AMONG AMBULATORY DIABETICS IN ABIDJAN : WHICH DIAGNOSTIC VALUE?
- Service de Neurologie, CHU de Cocody, BP V 13 Abidjan 01, Côte d’Ivoire.
- Service de Neurologie, CHU de Yopougon 21 BP 632 Abidjan 21 Côte d’Ivoire
- Service de Médecine Interne, CHU de Yopougon 21 BP 632 Abidjan Côte d’Ivoire
RESUME
Introduction
La polyneuropathie (P) et l’artériopathie (A) sont les principaux incriminés dans la survenue de lésions du pied diabétique qui mettent en jeu le pronostic fonctionnel de ces sujets.
L’objectif
principal de cette étude était d’apprécier la valeur diagnostique de l’examen clinique pour la détection de la P et de l’A des membres inférieurs, en consultation ambulatoire de diabétologie à Abidjan (Côte-d’Ivoire).
Méthodes
Cette étude transversale concerne 120 diabétiques randomisés dans le principal centre antidiabétique ambulatoire d’Abidjan. Selon les résultats de l’électromyogramme et du doppler des membres inférieurs, les sujets ont été répartis en 4 populations: P isolée, A isolée, P et A associés (PA), absence de P et de A. Les performances de l’examen clinique ont été appréciées par la sensibilité (Se), la spécificité (Sp), l’indice de Youden (Y) et les rapports de vraisemblance positif et négatif.
Résultats
Il s’agissait de 84 hommes et 36 femmes âgés en moyenne de 46 ( ± 8 ans avec des extrêmes de 27 et 65 ans), non insulinodépendants dans 86% des cas. La Se est meilleure pour une P (82%) que pour une A (45%) et pour la PA (50%). La Sp est meilleure pour l’A (82%) que pour la PA (73%) et pour la P (62%). Les erreurs sont moins fréquentes lorsqu’on diagnostique une P (Y à 45%), qu’une A (Y à 28%) ou qu’une PA (Y à 24%). L’apport diagnostique d’un résultat positif et d’un résultat négatif est moins important pour l’association PA que pour une A et une P. Chez les PA, la polyneuropathie est cliniquement surestimée aux détriments de l’artériopathie: 78% des patients qui ont des signes cliniques de P sont des PA et il n’est pas retrouvée cliniquement d’A isolée chez les patients PA.
Conclusion
La P, l’A et leur association échappent souvent à l’examen clinique. Le médecin manque ainsi l’opportunité de traiter ces pathologies et de renforcer les mesures de prévention du pied diabétique. Pour la polyneuropathie des scores, exclusivement cliniques pourraient être utilisés.
ABSTRACT
Background
Lower limbs polyneuropathy (P) and arterial disease (A) are the main causes of diabetic foot lesions which threatens the functional prognosis of these subjects.
Objective
The aim of this study was to assess medical examination diagnostic value for lower limbs P and A, in ambulatory diabetic care in Abidjan (Cote-d’Ivoire).
Methods
One hundred and twenty diabetics patients randomly selected at the main antidiabetic ambulatory centre of Abidjan, were included in a cross-sectional survey. Our gold standards tests were lower limbs Electromyogramm and Doppler. After their results, subjects were divided up to 4 populations: P isolated, A isolated, P and A associated (PA), lack of P and A. Medical examination diagnostic value were assessed by different index: sensibility (Se), specificity (Sp), Youden indice (Y), positive and negative likelihood ratios.
Results
Eigthy-four males and 36 females were included in this study. Eighty-six percents were non insulino-dépendants. The average age for all subjects is 46 years (± 8, ranged from 27 to 65 years). Se is better for screening P (82%) than A (45%) and association PA (50%). Sp is better for screening A (82%) than PA (73%) and P (62%). Diagnosis mistakes are less frequent when medical examination detect P(Y= 45%), than A (Y= 28%) or PA (Y= 24%). Diagnostic contribution of one positive result and one negative result was less important for PA than for A and for P. Among PA subjects, polyneuropathy was overestimate to the detriment of arteriopathy: 78% of patients clinicaly diagnosed as P are PA and it was not founded isolated arteriopathy at the medical examination among PA subjects.
Conclusion
P, A or their fearsome association are in many cases misdiagnosed by the medical examination. The consulting physician miss the opportunity to treat these diseases and to reinforce diabetic foot safety measures. Regarding P, scores considered as valid could be used for the medical examination; or as a help to conceive a clinical score adapted to our medical practice.
Mots clés : Artériopathie, Diabète, Polyneuropathie, Examen clinique, Africa-Arteriopathy, Diabetes, Polyneuropathy, Medical examination
INTRODUCTION
Les membres inférieurs n’échappent pas aux complications multiorganes du diabète sucré avec comme risque majeur, la survenue d’une gangrène et d’une amputation. Les principaux accusés sont : la neuropathie, avec son corollaire de modification de points d’appui et d’augmentation de la pression locale; l’artériopathie et l’infection [2,25,26]. Neuropathie, artériopathie et infection déterminent isolément ou conjointement des lésions dont la gravité est illustrée par des statistiques effroyables: coût élevé [15], risque d’amputation de membre élevé, nombreuses amputations parfois itératives [19] avec en Afrique, la majorité des sujets qui demeurent dépendants, parce qu’ils n’ont pas la possibilité d’être d’appareillés [22]. Ainsi, le diagnostic et la prise en charge de la polyneuropathie qui est la neuropathie diabétique la plus fréquente [10], et de l’artériopathie, devraient être une étape préventive de ces redoutables lésions pédieuses. L’objectif principal de ce travail était de déterminer si l’examen clinique des membres inférieurs d’un sujet diabétique, effectué lors d’une consultation ambulatoire permettait de différencier correctement : une polyneuropathie (P), une Artériopathie (A), leur association (PA) et l’absence de ces deux pathologies. L’objectif secondaire était de décrire les résultats de l’examen clinique des membres inférieurs chez ces patients diabétiques. Le but final était d’avoir des informations initiales pour pouvoir proposer et évaluer des actions de santé futures pour améliorer la détection clinique de la P et de l’A.
METHODES
Population : L’étude transversale unique s’est déroulée de façon prospective à l’Institut National de Santé Publique dans le principal centre antidiabétique ambulatoire d’Abidjan; de Janvier 1997 à Décembre 1997. Tous les sujets diabétiques âgés de 27 à 65 ans qui se sont présentés pendant cette période à la consultation ont fait l’objet d’une randomisation. Ont été exclus, les sujets qui avaient une polyneuropathie ou une artériopathie connue ainsi que ceux présentant une étiologie évidente pouvant être à l’origine de ces pathologies (néoplasie, métabolique, toxique, dégénérative). Le diagnostic de diabète était fondé sur la présence d’une symptomatologie clinique évocatrice de diabète sucré associée à une hyperglycémie (glycémie à n’importe quel moment de la journée supérieure à 11mmol/L ou glycémie à jeun supérieure à 7 mmol/L). En absence de signes cliniques évocateurs du diabète, le diagnostic était porté sur deux hyperglycémies à jeun.
Méthodes: Suite à un examen clinique des membres inférieurs, il a été effectué pour chaque sujet, un électromyogramme (EMG) et une ultrasonographie à effet doppler des vaisseaux, des membres inférieurs. Le diagnostic clinique de polyneuropathie et d’artériopathie a été donc été fait en insu des résultats de l’EMG et du doppler. L’interrogatoire recherchait des douleurs ou des paresthésies dont le caractère spontané ou provoqué évocateur de claudication intermittente était précisé. Concernant la P l’on appréciait (i) la sensibilité superficielle : effleurements par la main de l’examinateur, algique à l’aide d’une aiguille; (ii) la sensibilité profonde (la pallesthésie à l’aide d’un diapason appliqué sur les malléoles en demandant au sujet s’il percevait ou non les vibrations et la kinesthésie du gros orteil). La motricité était appréciée par la force musculaire segmentaire et les réflexes ostéo-tendineux (rotuliens et achilléens). Concernant l’A l’examen clinique appréciait la chaleur, la coloration, les pouls, l’allongement du temps de recoloration de la pulpe du gros orteil après sa compression intense (subjective car non quantifiée) et l’existence de troubles trophiques. Le diagnostic clinique de P était fondé sur la présence d’une anomalie sensitive ou motrice bilatérale. Celui d’A sur la classification de Leriche et Fontaine [3].
L’EMG a été réalisé dans l’unité de neurophysiologie du Centre Hospitalier Universitaire (CHU) de Cocody. Les nerfs sciatiques poplités externes et suraux ont été explorés par stimulo-détection. Les valeurs de référence utilisées ont été, (i) au niveau moteur: la latence motrice distale (< 6ms), l'amplitude des réponses (>3mv), la latence des ondes f (< 52ms), la vitesse de conduction motrice (> 45m/s) (ii) au niveau sensitif: l’amplitude (> 10mv), la vitesse de conduction (> 40 M/s). Le doppler a été réalisé à l’institut de Cardiologie d’Abidjan du CHU de Treichville et a consisté en exploration en doppler continu avec appréciation du son, de la tension d’écrasement systolique, la courbe de vitesse et la présence de flux de collatéralité. Le calcul de l’indice systolique de pression distale (Ankle Brachial Index = ABI) a été effectué. Cet ABI est le rapport entre les pressions systoliques maximales d’une part de la cheville et d’autre part, humérale. Le diagnostic d’A a été porté sur l’aspect de la courbe de vitesse (normale, amortie, nulle, frein an aval) et en présence d’un ABI<0,9 [3].
Analyse statistique : La constitution et l'analyse du fichier de données ont été réalisées à l'aide du logiciel Epi-info 6.04 (CDC, Atlanta, GA, USA). Les variables ont été épidémiologiques, cliniques, paracliniques. le type de diabète (selon la classification de l'OMS), la durée d'évolution du diabète (à compter de la date du diagnostic), l'équilibre glycémique a été défini bon : hémoglobine glyquée (hbA1c inférieure à 6%), mauvais (hbA1c supérieure à 6% ou moyenne glycémique d'au moins 1g/l) ou indéterminé (moyenne glycémique bonne sans hémoglobine glyquée). la moyenne glycémique était la moyenne arithmétique des glycémies (à jeun par méthode enzymatique), à la fréquence hebdomadaire pour les diabétiques de moins de deux ans et bimensuelle pour les autres patients, sans tenir compte de la glycémie de découverte. Concernant la polyneuropathie: le type de lésions (axonale et/ou myélinique), la topographie (motrice et/ou sensitive) et l'abolition des réponses (VCM, VCS et latence f); concernant l'artériopathie: le siège des anomalies, la topographie, la présence d'oblitération artérielle et de flux de collatéralité.
Les tests utilisés pour l'analyse descriptive ont été le test de Chi2 de Pearson ou le test exact de Fisher (effectifs inférieurs à cinq) pour la comparaison de pourcentage, avec un seuil de significativité du risque de première espèce à 5% (p<0,05). Les variables quantitatives ont été comparées par le test de Student. Nos patients ont été répartis en quatre populations définies par les résultats de l'EMG et le doppler: Polyneuropathie isolée (P), Artériopathie isolée (A), Neuropathie et Artériopathie associée (PA) et Absence de polyneuropathie et d'artériopathie (S). Pour apprécier les performances de l'examen clinique nous avons opté pour les indicateurs les plus simples et couramment utilisés : la sensibilité (Se), la spécificité (Sp), l'indice de Youden (Y) et les rapports de vraisemblance positif (L) et négatif (λ). La Se est la probabilité d'avoir un examen positif chez les sujets malades. La Sp est la probabilité d'avoir un examen négatif chez les sujets qui ne sont pas malades. L'indice de Youden (Se+Sp-1) permet d'apprécier l'équilibre entre la Se et la Sp. L et λ apprécient respectivement l'apport diagnostique d'un résultat positif (varie dans le même sens que L) et d'un résultat négatif (varie en sens inverse de λ). Les groupes de sujets 'malades' ont été successivement définis comme ceux atteints de polyneuropathie (Pet PA), ceux atteints d'artériopathie (A et PA) et ceux atteints de l'association PA.
RESULTATS
Epidémiologie descriptive
Population : Au total 200 sujets ont été recrutés, 35 (17,5%) sujets n’ont pas consenti à participer à l’étude, 45 (17,5%) n’ont pas effectué une des deux explorations de référence (EMG et Doppler). Les 120 (60%) sujets inclus dans notre analyse se répartissaient en 84 (70%) hommes et 36 (30%) femmes, soit un sexe ratio de 2,33 en faveur des hommes. L’age moyen des sujets était de 46± 8 ans avec des extrêmes de 27 et 65 ans ; les 1er,2ème et 3ème quartiles étaient respectivement dans les classes d’age de : 40 à 44 ans, 45 à 49 ans et 50 à 54 ans. Le mode se situait dans cette dernière tranche d’age.14% étaient insulino-dépendants (ID), 86% étaient non insulino-dépendants (NID). 43% étaient diabétiques depuis moins de 5 ans, 36% depuis au moins 5ans et moins de 10 ans et 20% depuis plus de 10 ans. Chez 80% de nos sujets, le diabète était non équilibré, selon les critères définis dans notre méthodologie. La surcharge pondérale était au premier plan des facteurs de risque vasculaire, présente chez 50% des sujets, suivie de l’HTA (30%), des dyslipidémies (25%) et de l’hyperuricémie (5%).
Examen clinique : Au total 43 sujets n’avaient pas de signes fonctionnels (SF) des membres inférieurs. Présents chez 77 sujets, ces SF peu gênants dans les activités de la vie quotidienne étaient chez 70 sujets ceux de P et chez 29 sujets ceux de A. Les plaintes de P étaient sensitives (45 cas), sensitivo-motrices (12 cas), sensitivo-trophiques (5 cas), motrices (4 cas) et trophiques (2 cas de dépilation). La symptomatologie sensitive était plus souvent à type de fourmillements (26cas) de brûlures (23 cas), que d’hypoesthésie (7cas). Les SF d’A étaient une claudication intermittente (19 cas), des douleurs de décubitus (8 cas) et une gangrène parcellaire (2 cas). Les SF, à défaut d’être absents (44% des P, 30% des A et 11% des PA) sont incomplets (63% des PA) ou trompeurs (40% des A ont que des signes de P et 8% des P n’ont que des signes de A). Des signes physiques (SP) des membres inférieurs étaient présents chez 89 sujets (74,1%) : tous présentaient des SP de P et 47 (52,8%) avaient des SP de A. Parmis ces 89 sujets, aucun n’avait de déficit de la force musculaire. l’hyporéflexivité ostéo-tendineuse était au premier plan des SP de P (93,2%), suivie des troubles trophiques (57,5%) et des troubles sensitifs (50,8%). Selon la classification de Leriche et Fontaine, l’artériopathie était au stade 1 (20 cas), 2 (15 cas), 3(10 cas) et 4 (2cas)
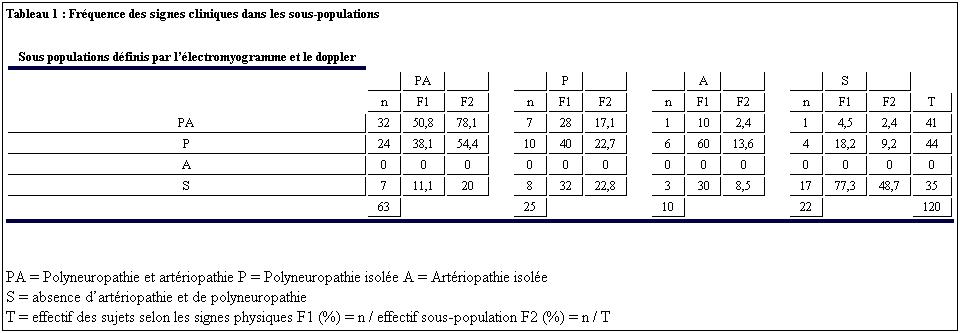
Suite à l’examen physique, la population PA présentait le plus souvent des signes de PA (50%) et de P (38%). La population PA est constituée des 68% de ceux qui avaient des signes de PA, 63% de ceux qui avaient des signes de P et de 20% des sujets qui avaient un examen normal. Ainsi, l’examen physique détecte 50% des PA mais aussi des faux positifs (10% des A et 28% des P sont cliniquement des PA) et des faux négatifs (d’une part, 38% des PA sont cliniquement des P; d’autre part, 11% des PA, 32% des P et 30% des A ont un examen clinique normal). Le détail des résultats de l’examen clinique dans les différentes populations est présenté sur le tableau 1. Les répartitions des sujets selon les signes cliniques et selon les examens de référence qui étaient statistiquement différentes (p= 0,0004) est représentée sur la figure 1.
Diagnostic de référence : Les examens de référence (EMG et Doppler) ont été réalisés avec un intervalle de temps moyen de 10 jours entre l’examen clinique et la 1ère exploration paraclinique; de 8 jours entre l’EMG et le doppler. Suite à ces examens de référence, les sujets ont été classés en 4 populations : Polyneuroapthie isolée (P), Artériopathie isolée (A), Polyneuropathie et Artériopathie associés (PA), absence de P et d’A (S). A l’EMG, la polyneuropathie diagnostiquée chez 88 sujets (63 PA et 25 P) était sensitive (25%) et sensitivo-motrice (75%). Les formes axonales étaient les plus fréquentes (54%) suivies des formes axono-myéliniques (43%) et des formes myéliniques (3%). Les VCN sensitives et la latence f étaient abolies respectivement dans 44% et dans 50%. Chez 25% des patients qui avaient une réponse abolie,le diabète évoluait depuis moins de 5 ans. Au doppler, l’artériopathie diagnostiquée chez 73 sujets (63 PA et 10 A) était le plus souvent bilatérale (79%) et distale (88%). La fréquence de l’atteinte était croissante des artères proximales aux artères distales : iliaque (1cas), fémorale (6 cas), poplité (13 cas), tibiale-postérieur (41 cas) et pédieuse (68 cas). Les lésions disto-proximales (7cas) n’étaient présentes que chez des sujets dont le diabète évoluait depuis plus de 5 ans. L’atteinte était bilatérale dans 58 cas, unilatérale dans 15 cas. L’oblitération artérielle était retrouvée chez 18 sujets, et dans 40% cette oblitération artérielle n’était associée à aucun signe physique d’artériopathie.
Valeur diagnostique
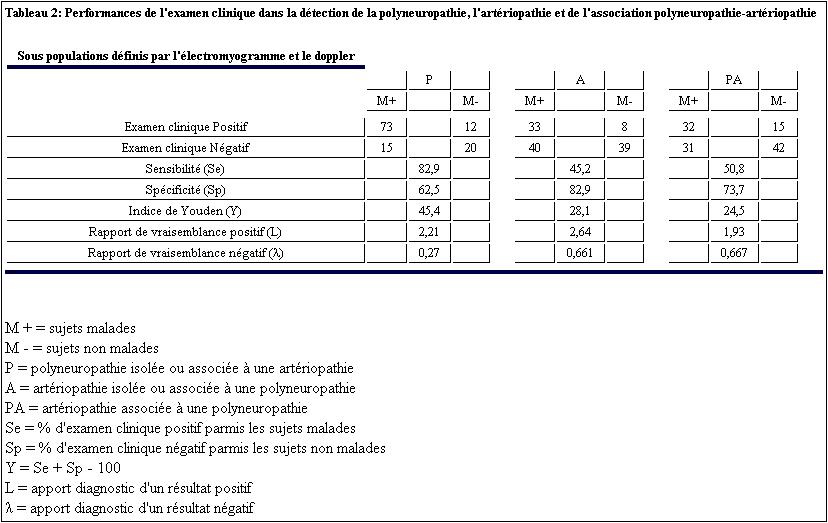
La capacité de l’examen clinique à détecter les malades (Se) est meilleure pour une P que pour une A (82% versus 45%) et pour l’association PA ou seul 1 cas sur 2 est détecté. Concernant la probabilité d’avoir un examen clinique négatif chez un sujet non malade (Sp), elle est meilleure pour l’artériopathie (82%) que pour l’association polyneuropathie-artériopathie (73%) et que pour la polyneuropathie (62%). L’indice de Youden est maximal donc meilleur pour la polyneuropathie, indiquant qu’on se trompe moins (faux positifs et faux négatifs) lors du diagnostic clinique d’une P (Y= 45%) que celui d’une A (Y= 28%) ou de leur association (Y= 24%). La valeur diagnostique de l’examen clinique est résumée sur le tableau 2.
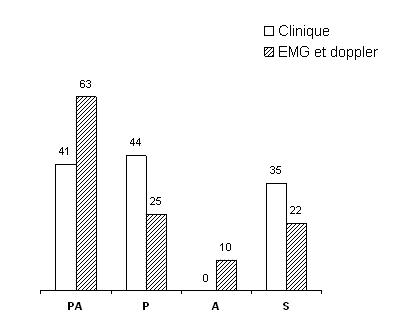
Figure 1
DISCUSSION
La nécessité de la prévention des lésions pédieuses chez le sujet diabétique est universellement admise avec la recommandation d’un examen clinique régulier incluant la recherche d’une neuropathie, d’une artériopathie, de déformations et de lésions cutanées [39]. L’importance de la recherche de toutes ces pathologies est évidente mais nous avons porté notre intérêt sur la neuropathie et l’artériopathie qui peuvent d’une part, être précurseurs de certaines déformations et lésions cutanées. D’autre part, plusieurs classifications du risque de ‘pied diabétique’ utilisent principalement la neuropathie et l’artériopathie [33]. L’examen clinique est d’autant plus utile qu’on sait l’importance qu’on peut attribuer à ses résultats. En effet, la connaissance de la valeur diagnostique est un point essentiel pour préconiser une conduite à tenir objective.
Nous ne pouvons pas certifier que notre échantillon était idéalement représentatif de l’ensemble des sujets diabétiques suivis en consultation ambulatoire; en raison du recrutement unicentrique de sujets volontaires, qui devaient se rendre dans deux structures différentes pour effectuer les examens complémentaires. Ces contraintes d’organisation peuvent expliquer en partie le nombre non négligeable de perdus de vus et de sujets qui n’ont pas consenti à participer à notre étude. L’exclusion de ces sujets (fait souvent rencontré dans les études portant sur des volontaires), dont la majorité (80% pour les perdus de vu et 100% pour les refus de participation) n’avaient aucune symptomatologie fonctionnelle ni physique aux membres inférieurs, n’a pas permis de confronter davantage, l’examen clinique à d’éventuelles formes asymptomatiques de P et de A. Cependant cette étude portant sur des sujets randomisés présentant des caractéristiques démographiques (age, sexe, type du diabète) proches de celles décrites chez les diabétiques en Afrique de l’ouest [28,36]; a l’intérêt (i) d’apprécier les performances de l’examen clinique dans le contexte actuel du principal centre ambulatoire de diabétologie d’Abidjan (ii) de fournir des informations qui pourront être utiles pour la proposition et l’évaluation d’actions visant à améliorer la détection des ces deux pathologies dans la surveillance de ce redoutable pied diabétique.
Quelle que soit la pathologie (P, A ou PA) l’examen physique est utile pour l’orientation diagnostique. Cette utilité est notifiée par un indice de Youden (Y) non nul. Cependant cet examen a des limites avec des erreurs (faux-positifs et des faux-négatifs) dont le nombre est croissant (Y décroissant) lorsqu’on diagnostique un P (Y = 45%), une A (Y = 28%) ou une PA (Y= 24%). Il semble que lors de la coexistence de la polyneuropathie et de l’artériopathie la fiabilité de l’examen physique soit réduite avec une surestimation de la neuropathie aux dépends de l’artériopathie car 78% des patients présentant des signes de Polyneuropathie sont des PA et il n’est pas retrouvée cliniquement d’artériopathie isolée chez les patients PA. (Tableau 1). De plus, l’apport diagnostic du résultat positif ou négatif est moindre en cas de PA, objectivé par des rapports de vraisemblance positif et négatif respectivement minimal et maximal (tableau 2). Ces difficultés à détecter cliniquement ces complications du diabète ont été retrouvées dans d’autres études dont la méthodologie était parfois différente de la notre en certains points. Comparée à une étude [20] qui diffère de la notre par le test de référence de la P qui était une méthode quantitative sensitive (test du fil de 10g), la Se de l’examen clinique dans notre étude est plus similaire pour la P (82% versus 84% qui est la Se maximale obtenue avec un fil de 25g) et que pour l’artériopathie ou notre Se est moins élevée (45% versus 50%). Le test du fil de 10 g est apparu corrélé de façon satisfaisante aux résultats de l’EMG [28] nous permettant de constater que nos résultats sont peu différents. Le test du fil permet d’avoir une évaluation quantifiée qui facilite le suivi du patient, mais ne peut assurer que le déficit est périphérique [30] contrairement à l’EMG. La comparaison dans une même étude [32] des rapports de vraisemblance positif (L) et négatif (λ) montre que l’appréciation de la perception des vibrations est d’un apport diagnostic nettement plus importante (L à 26 et λ à 0,33) que celui de la sensibilité superficielle et que le test de 10g. Quant au temps pendant lequel le sujet perçoit les vibrations, il est d’un apport diagnostic notable (L à 18,5 et λ à 0,51) mais l’interprétation difficile de cette mesure fait préférer l’appréciation non chronométrée des vibrations [32], telle que réalisée dans notre travail.
Utilisant le doppler comme gold standard, certains auteurs estiment que [4]: la diminution ou l’absence des pouls a une Se de 65%, une Sp de 78%. Ces performances variaient selon qu’ils considéraient pour le diagnostic clinique d’A, la présence d’une anomalie des pouls et des signes fonctionnels (Se à 50% et la Sp à 91%) ou uniquement l’un des deux (Se de 93 à 100% et Sp à 58%). Le meilleur rapport de vraisemblance positif était obtenu lorsqu’ils considéraient tel que dans notre étude, les signes fonctionnels et physiques avec un rapport de vraisemblance positif supérieur au notre (5 versus 2,6). Pour ces auteurs [4], les éléments les plus informatifs pour le diagnostics d’A sont : l’absence ou la diminution des pouls et les SF alors que la température, la couleur de la peau et le temps de recoloration capillaire étaient peu informatifs. Ces faits sont rassurant pour les éléments qui composaient la recherche d’A dans notre étude car les troubles de la coloration, sauf majeurs, nous semblent difficilement appréciables chez des sujets de race noire et la mesure du temps de coloration n’est pas utilisé dans notre étude. Au vu des résultats de ces études [32] il ressort que les éléments cliniques utilisés pour la détection de la P et l’A sont pertinents tant au niveau de la faisabilité que des performances diagnostiques. Une autre étape pourrait être de proposer la quantification de ces éléments. Des scores cliniques de neuropathie, parfois même spécifique à la polyneuropathie diabétique existent [6,9,13] et sont largement utilisés dans les études. Il serait probablement plus adapté à notre contexte sanitaire de préconiser l’utilisation de scores au mieux exclusivement clinique, pour assurer un suivi objectif sur lequel pourrait être fondé une conduite à tenir pratique.
Concernant nos tests de référence, quelques points sont à préciser. L’EMG aurait des difficultés pour déceler des atteintes des fibres de petit calibre; cependant la conduction nerveuse est apparue corrélée aux résultats des biopsies du nerf sural qui ne sont pas sans éventuelles complications (infection, douleur et déficit sensitif) et dont l’utilisation demeure controversée [30]. L’étude immunohistochimique de biopsies de peau ont été jugées efficaces pour explorer ces petites fibres, notamment dans la polyneuropathie diabétique [17,34] mais ne sont actuellement pas recommandées en pratique de routine [30]. L’artériographie qui reste la méthode de référence pour l’imagerie des artères, est indiquée quasi exclusivement en péri opératoire et l’angiographie par résonance magnétique est réservée aux insuffisants rénaux sévères [3]. La mesure de l’ ABI au Doppler a une capacité de discrimination (des sujets atteints d’artériopathie des membres inférieurs de ceux idemns d’arétriopathie) a été jugée variable [23]. Dans cette étude, l’aire sous la courbe ROC (Receiver Operating Curves), indicateur global de cette capacité discriminante de l’ABI était plus élevé pour la région fémoro poplitée (0,77 en cas de sténose ou d’occlusion) que pour les régions aorto iliaque (0,69 en cas de sténose >50% et 0,83 en cas d’occlusion) et infrapoplitée (0,59 en cas de sténose>50% et 0,57 en cas d’occlusion). Cependant dans la même étude, lorsqu’on considérait le membre inférieur dans sa globalité, l’ABI avait une aire sous la courbe satisfaisante (la valeur maximale possible étant de 1) avec des valeurs de 0,95 en présence d’une sténose >50% et 0,80 en cas d’occlusion. La médiacalcose décrite chez les diabétiques peut masquer une baisse de l’ABI et sous estimer la sévérité et même l’existence d’une artériopathie [4,35]. Cependant la Se et la Sp de l’ABI avec le seuil de 0,9 ont été respectivement estimés à 79% et 96% [23]. Malgré ces limites, de toutes les autres explorations disponibles (angioscanner, échographie couplée au doppler), nous avons opté pour le doppler compte tenu du coût moins élevé (20 000cfa) permettant des informations non morphologiques certes, mais fonctionnelles estimées essentielles au diagnostic d’artériopathie [3Boccalon]. Le délai variable pour les sujets entre l’examen clinique et les explorations paracliniques avec l’appréciation non répétée de l’équilibre glycémique au moment de ces examens n’est pas exempt de critique. La sévérité électrophysiologique et morphologique de la polyneuropathie a été décrite significativement plus importante en cas de mauvais contrôle glycémique [18,31,40]. Chez les diabétiques insulinodépendants, les anomalies à l’électromyogramme présentes dans 29 à 70% des cas lors du diagnostic initial, sont améliorées par l’insulinothérapie [27]. Notons qu’il n’est pas rapporté dans la littérature de disparition des anomalies EMG après rétablissement de l’équilibre glycémique. De plus le maintient rigoureux de cet équilibre n’a pas diminué la prévalence de la P chez des diabétiques suivis pendant 2 ans [1]. D’autres auteurs estiment qu’il est plus réaliste d’espérer, après rétablissement de l’équilibre glycémique, une stabilisation et non une amélioration des anomalies de la conduction nerveuse [5]. Pour l’artériopathie certains rapportent l’absence de corrélation entre les résultats du doppler et la glycémie ou l’hémoglobine glyquée [21]. Il ne parait donc pas excessif d’estimer que l’absence de dosage de la glycémie, de façon concomitante à la réalisation des examens paracliniques, est une limite méthodologique peu importante de ce travail.
Plusieurs hypothèses peuvent être émises pour expliquer les erreurs du diagnostic clinique. (i) l’apparition retardée des signes physiques par rapport aux anomalies histopathologiques, notamment pour la neuropathie. (ii) l’existence de formes cliniques trompeuses de PA due à la coexistence possible d’une neuropathie autonome avec atteinte sympathique pouvant générer une médiacalcose mais également une ‘artériopathie à haut débit’ qui est due à une ouverture des shunts artério-veineux [11]. L’association de la neuropathie périphérique et autonome a été retrouvée chez 28% des ID et 45% des NID [38]. Dans notre étude cette limite du doppler n’a pas pu être prise en compte puisque nous n’avons pas pu réaliser la radiographie standard des membres inférieurs (prévue dans le protocole initial) qui aurait pu objectiver une médiacalcose, conséquence d’une dénervation sympathique [3,14].
A l’EMG, la prédominance de l’atteinte axonale et sensitivo-motrice est classiquement décrite [5,37] .Quant aux formes démyélinisantes pures, jugées exceptionnelles, Elles posent le problème d’une neuropathie inflammatoire associée et suscitent des interrogations: Phase de début des formes « typiques »? formes axono-myéliniques non détectées par l’EMG ? formes atypiques de polyradiculoneuropathie. Au doppler, nous n’avons pas retrouvé d’atteinte proximale isolée, tel que décrit dans la littérature [7,41]. La révélation d’oblitération artérielle chez des patients sans artériopathie clinique est corroborée par GOT pour qui la palpation des pouls peut-être faussement rassurante alors qu’il existe une occlusion. Cependant l’imputabilité au diabète de la P et l’A diagnostiquée chez ces sujets peut être discutable puisque nous n’avions pas le statut antérieur de présence ou non de polyneuropathie et d’artériopathie. Cependant nos critères d’inclusion ce sont efforcé d’éliminer toute autre cause de polyneuropathie et d’artériopathie, afin d’éviter d’influencer le résultat de l’examen clinique. De plus on peut concevoir que la première étape essentielle, est de diagnostiquer une P et une A chez un sujet diabétique; suivie de celle de l’imputabilité de ces pathologies au diabète qui est l’objet d’une autre démarche.
CONCLUSION
La P, l’A ou leur redoutable association (PA) échappent dans certains cas au diagnostic clinique tel qu’effectué actuellement dans le principal centre antidiabétique ambulatoire à Abidjan. Le médecin manque ainsi l’opportunité de traiter ces complications, donner à son patient des arguments supplémentaires pour hâter son pas vers l’équilibre glycémique et renforcer les mesures hygiéniques de prévention des lésions pédieuses. La valeur diagnostique de l’examen clinique jugée imparfaite dans la littérature a donné lieu à des scores, notamment pour la polyneuropathie associant des items cliniques et paracliniques [8]. Leur utilisation se heurtera sans doute aux insuffisances de notre système de santé. D’autres scores, exclusivement cliniques ont été jugés valides et corrélés pour certains aux résultats de l’EMG [6,12]. Ils pourraient être appliqués tels quels ou aider à la conception d’un score adapté à notre contexte clinique.
| Remerciements |
| Remerciements aux Dr Adoueni Valery et Adou-Lath Claudine, Médecins Diabétologues à l’Institut National de Santé Publique d’Abidjan. |
REFERENCES
- AZAD N, EMANUELE NV, ABRAIRA C et al. The effects of intensive glycemic control on neuropathy in the VA cooperative study on type I diabetes mellitus (VA CSDM). J. Diabetes Complicat. 2000;6:307-13.
- BENOTMANE A, MOHAMMEDI F, AYAD F et al. Diabetic foot lesions: etiologic and prognostic factors. Diabetes Metab 2000;26:113-7.
- BOCCALON H, ELIAS D, LEFEBVRE D et al. Guide pratique des maladies vasculaires. Collection médiguides. Paris: MMI-Masson;2001,344p.
- BOYKO EJ, AHRONI JH, DAVIGNON D et al. Diagnostic utility of the history and physical examination for peripheral vascular disease among patients with diabetes mellitus. J Clin Epidemiol 1997;6:659-68.
- BRILL V. Role of electrophysiological studies in diabetic neuropathy. Can J Neurol Sci.1994;21:58-62.
- BRILL V, BRUCE P. Validation of the Toronto clinical scoring system for diabetic polyneuropathy. Diabetes Care 2002;25:2048-52.
- CORMIER J M, CORMIER F, FICHELLE J M. et al. Artériopathies des membres inférieurs chez le sujet diabétique.Rev Prat.1995;45:50-55.
- CORNBLATH DR, CHAUDHRY V, CARTER K et al. Total neuropathy score. Neurology 1999;53:1660-64.
- DYCK PJ. Evaluative procedures to detect ,characterise ,and assess the severity of diabetic neuropathy. Diabet Med 1991;8:S48-S51.
- DYCK PJ, KRATTZ KM, KARNES JL et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy and nephropathy in a population-based cohort: the Rochester diabetic neuropathy study. Neurology 1993;4:817-24.
- EDMONDS M. Management of the diabetic foot. Crit Ischaemia 1990;1:5-13.
- FEKI I, LEFAUCHEUR JP. Correlation between nerve conduction studies and clinical scores in diabetic neuropathy. Muscle Nerve 2001;24:555-58.
- FELDMAN E, STEVENS M. Clinical testing in diabetic peripheral neuropathy.Can J Neurol Sci 1994;21:S3-S7.
- GOT I. Artériopathie des membres inférieurs. In:Atlas des complications du diabète.Paris:Edition Pradel;1994:63-6.
- HALIMI S, BENHAMOU PY, CHARRA H.Cost of diabetic foot. Diabetes Metab.1993;19:518-22
- HALPERIN JL. Evaluation of patients with peripheral vascular disease. Thromb. Res. 2002;v303-v311.
- HIRAI A, YASUDA H, JOKO M et al. Evaluation of diabetic neuropathy through the quantification of cutaneous nerves. J Neurol Sci 2000;172:55-62.
- HYLLIENMARK L, GOLSTER H, SAMUELSON U et al. Nerve conduction defects are retarded by tight metabolic control in type I diabetes. Muscle Nerve 2001;24:240-46.
- JEFFCAOTE W, HARDING KG. Diabetic foot. Lancet 2003;361:1545-51.
- JIRKOSKA A, BOUECEK P, WOSKOVA V et al. Identification of patients at risk for diabetic foot a comparison of standardized noninvasive testing with routine practice at community diabetes clinics. J. Diabetes Complicat. 2001;15:63-68.
- KARMAFEL W, JUSKOWA J, MANIEWSKI R et al. Microcirculation in the diabetic foot as measured by a multichannel laser Doppler instrument. Med Sci Monit 2002;8:MT137-44.
- LESTER FT. Amputations in patients attending a diabetic clinic in Addis Abeba, Ethiopia. Ethiop Med J 1995;33:15-20.
- LIJMER JG, HUNINK MGM, VAN DEN DUNGEN et al. Roc analysis of non invasive tests for peripheral arterial disease. Ultrasound Med Biol 22:391-98.
- MEIJER JWG, VAN SONDEREN E, BLAUWWIEKEL EE et al. Diabetic neuropathy examination: a hierarchical scoring system to diagnose distal polyneuropathy in diabetes. Diabetes Care 2000;23:750-53.
- MERZA Z, TESFAYE S. The risk factors for diabetic fot ulceration. The Foot 2003;13:125-29.
- MOULIK PK, MTONGA R, GILL GV. Amputation and mortality in new-onset diabetic foot ulcers stratified etiology. Diabetes Care 2003; 26:491-94.
- MRAD FEB, GOULDER R, FREDJ M et al. Chilhood diabetic neuropathy : a clinical and electropysiological study. Funct Neurol 2000;15:35-40.
- OLALEYE D, PERKINS BA, BRIL V. Evaluation of three screening tests and a risk assessment model for diagnosing peripheral neuropathy in the diabetes clinic. Diabete. Res Clin Pract 2001;54:115-28.
- PAPOZ L, DELCOURT C, PONTON-SANCHEZ A et al. Clinical classification of diabetes in tropical west africa. Diabetes Res Clin Pract 1998;39:219-27.
- PERKINS BA, BRIL V. Diabetic neuropathy: a review emphazing diagnostic methods. Clin Neurophysiol 2003;114:1167-75.
- PERKINS BA, GREENE DA, BRIL V. Glycemic control is related to the morphological severity of diabetic sensorimotor polyneuropathy. Diabetes Care 2001;24:748-52.
- PERKINS BA, OLALEYE D, ZIMMAN B et al. Simple screening tests for peripheral neuropathy in the diabetes clinic. Diabetes Care 2001;24:250-56.
- PETTERS EJG, LAVERY LA. Effectiveness of the diabetic foot risk classification system of the internationnal working system of the international working group on the diabetic foot. Diabetes Care 2001;24:1442-47.
- POLYDEFKIS M, GRIFFIN JW, McARTHUR J. New insights nto diabetic polyeuropathy. JAMA 2003;29:1371-76.
- PUTTEMANS T, NEMRY C. Diabetes: the use of color doppler sonography for the assessment of vascular complications. Eur J Ultrasound 1998;7:15-22.
- SOBNGWI E, MAUVAIS-JARVIS F, VEXIAU P et al. Diabetes in Africans. Part 1: epidemiology and clinical specificities. Diabetes Metab 2001;27:628-34.
- SONAN TH, PIQUEMAL M, GIORDANO C et al. Les neuropathies diabétiques. Rev Med. Côte d’Ivoire 1986;75:65-67.
- TENTOLOURIS N, PAGONI S, TZONOU A et al. Peripheral neuropathy does not invariably coexist with autonomic neuropathy in diabetes mellitus. Euro J Intern Med 2001; 12:20-7.
- The HELMUT MEHNET AWAD WORKSHOP PARTICIPANTS, ASSAL JP, MEHNERT H, TRITSCHLER HJ et al. On your feet! Workshop on the diabetic foot. J Diabetes Complicat 2002;16:183-94.
- TRAC I, BRIL V. Glycemic control is related to the electrophysiologic severity of diabetic peripheral sensorimotor polyneuropathy. Diabetes Care 1998;21:1749-52.
- ZIEGLER D., GOT I., POINTEL JP. et al. Artériopthies athéromatheuses des membres inférieurs et diabète. In :Rouffy J, Natali J,editors. Artériopathies athéromatheuses des membres inférieurs. Paris : Masson,1989 :549-56.



