ORIGINAL PAPERS / ARTICLES ORIGINAUX
COBALT, STRESS OXYDATIF ET TROUBLES COGNITIFS CHEZ L’ENFANT EN MILIEU AFFECTE PAR LE KONZO A KAHEMBA/REPUBLIQUE DEMOCRATIQUE CONGO
COBALT, OXIDATIVE STRESS AND COGNITIVE IMPAIRMENTS IN CHILDREN IN KONZO-AFFECTED AREA IN KAHEMBA/DEMOCRATIC REPUBLIC OF CONGO
- Département de Biologie, Université de Kinshasa, Congo-Kinshasa.
- Département des Sciences Biomédicales, Université de Kinshasa, Congo-Kinshasa.
- Département de Neurologie, Université de Kinshasa, Congo-Kinshasa.
- Ecole de Santé Publique, Université de Kinshasa & Programme National de Nutrition, Ministère de la Santé, Congo-Kinshasa.
- Département de Médecine Tropicale, Université de Kinshasa & Institut National de Recherche Biomédicale, Congo-Kinshasa.
- Department of Neurology and Center for Research on Occupational and Environmental Toxicology, Oregon Health & Science University, Portland OR, USA.
E-Mail Contact - ALI-EKANGU Rosine :
RESUME
Introduction
Le rôle du cobalt, élément constitutif des cobalamines et facteur de détoxification cyanhydrique, n’est pas encore clarifié dans le konzo et les troubles y associés. L’objectif de cette étude était de caractériser la relation entre le cobalt, le stress oxydatif et les troubles cognitifs chez des enfants en milieu affecté par le konzo.
Méthodes
Il s’agit d’une étude transversale analytique ayant inclus 21 enfants atteints de konzo (EAK) et 19 présumés sains (EPS). Les taux sériques de la F2-isoprostanes marqueur du stress oxydatif et des éléments-traces métalliques ont été dosés respectivement par chromatographie à haute performance liquide et analyse spectrale et par spectrométrie de masse à plasma à couplage inductif. Les performances cognitives ont été évaluées par le Kaufman Assessment Battery for Children, 2ème édition. L’analyse statistique a été faite avec le logiciel SPSS 21.
Résultats
Il n’y avait pas de différence des taux sériques de cobalt entre les EAK et les EPS. Le stress oxydatif était plus élevé et les performances cognitives plus faibles chez les EAK (p<0,05). Les taux sériques normaux de cobalt s’associaient à la réduction du stress oxydatif (β = 0,363, IC 95% : 0,053 – 0,778 ; p=0,049), à des performances cognitives élevées dans l’apprentissage immédiat (β=20,360 ; IC 95% : 5,393-35,327 ; p = 010) et la mémoire de rappel (β = 23,082 ; IC 95% 5,393-35,327 ; p = 0,007).
Conclusion
Le stress oxydatif et les troubles cognitifs chez l’enfant en milieu affecté par le konzo impliqueraient le métabolisme relatif au cobalt.
Mots-clés : Apprentissage, Cobalamines, Eléments-traces métalliques, Intoxication cyanhydrique, Isoprostanes.
SUMMARY
Introduction
The role of cobalt, a prosthetic group of cobalamins and factor of cyanide detoxification, has not yet been clarified in konzo and related disorders. The objective of this study was to elucidate the relationship between cobalt, oxidative stress and cognitive impairments in children living in konzo affected area.
Methods
We used a cross-sectional study that included 21 children with konzo (CWK) and 19 presumed healthy (PHC). Serum levels of oxidative stress marker F2-isoprostanes and metallic trace elements were determined respectively by High Performance Liquid Chromatography and spectral analysis and by Inductively Coupled Plasma Mass Spectrometry. Cognitive performance was assessed by Kaufman Assessment Battery for Children, 2nd edition. Statistical analysis was done with SPSS 21 software.
Results
No difference was found in serum cobalt levels between CWK and PHC. Oxidative stress was higher and cognitive performance lower in CWK (p <0.05). Normal serum cobalt levels were associated with reduced oxidative stress (β = 0.363, 95% CI: 0.053 to 0.778; p = 0.049), higher cognitive performance in learning (β = 20.360; 95% CI %: 5.393-35.327; p = 010) and recall memory (β = 23.082; 95% CI 5.393-35.327; p = 0.007).
Conclusion
Oxidative stress and cognitive disorders in children living in area affected with konzo involve metabolism related to cobalt.
Keywords: Cyanide intoxication, Cobalamin, Isoprostane, Learning, Metallic trace elements.
INTRODUCTION
Le konzo est une maladie neuro-toxico-nutritionnelle affectant surtout les enfants et les femmes en âge de procréer et attribuée à la consommation des produits du manioc cyanogène mal détoxifié (37,40).
La détoxification de l’ion cyanure se fait principalement par des réactions de transsulfuration, catalysées soit par la mercaptopyruvate sulfure transférase (MPST), soit par la rhodanèse (thiosulfate sulfure transférase ou TST), qui conduisent à la production du thiocyanate (SCN) moins toxique que le cyanure et qui est excrété par voie urinaire (13,29,32). En dehors de la détoxification enzymatique du cyanure évaluée à 80 %, l’hydroxocobalamine (la Vitamine B12), grâce à la plus forte affinité du cyanure pour le cobalt, constitue une des voies de la détoxification non enzymatique, dont l’influence sur la transformation du cyanure en thiocyanate a été déjà suggérée dans les expérimentations avec les animaux (31,39,42).
Dans le konzo, une étude biochimique récente a montré une faible activité enzymatique des sulfures transférases chez les enfants malades de konzo, caractérisée par des temps de détoxification cyanhydrique très longs jusqu’à 1670 ms pour produire 1 μmol SCN /mg protéine pour certains (17). En plus de ce temps long de détoxification cyanhydrique enzymatique, il a été aussi montré chez les enfants konzo par rapport aux enfants non konzo, des niveaux élevés des isoprostanes sériques marqueurs non spécifiques du stress oxydatif (22). Particulièrement, la 8,12-iso-iPF2a-VI Isoprostane était en corrélation positive avec la sévérité des troubles cognitifs présentés par ces enfants (22).
Bien que l’association entre le konzo et l’état nutritionnel (malnutrition protéique) soit déjà établie depuis plus de deux décennies (35-37), les études actuelles (10,22) ont permis de mettre aussi en évidence une association entre les troubles moteurs et cognitifs du konzo, le stress oxydatif et les déficiences nutritionnelles en oligoéléments essentiels comme le sélénium (Se), le zinc (Zn) et le cuivre (Cu) dont les rôles dans les mécanismes cellulaires de lutte contre le stress oxydatif sont bien connus. En outre, les métaux toxiques et potentiellement toxiques tels que le plomb (Pb), le Cadmium (Cd), le mercure (Hg), le manganèse (Mn) et le cobalt (Co) ont été détectés dans le sang des enfants en milieu affecté par le konzo (10). Le rôle de ces métaux dans la physiopathologie du konzo et des troubles associés n’est pas encore clarifié. Le cobalt, dont les rôles métaboliques essentiels passent par celui de la vitamine B 12, participe à la détoxification cyanhydrique non enzymatique, au métabolisme monocarboné et à la neuroprotection (14,15,38,39). En situation d’intoxication cyanhydrique chronique, comme dans le milieu affecté par le konzo, impliquant une utilisation élevée des cobalamines, le métabolisme du cobalt est susceptible d’être modifié, avec majoration possible du stress oxydatif et du risque des troubles neurologiques et cognitifs.
Les conditions dans lesquelles apparait le konzo, caractérisées par une exposition cyanhydrique et une malnutrition chronique, une déficience en métaux essentiels et une exposition probable aux éléments métalliques potentiellement toxiques, réunissent autant de facteurs susceptibles d’induire le stress oxydatif et les troubles neurologiques et cognitifs. La contribution de tous ces facteurs dans la physiopathologie du konzo et des troubles associés nécessite encore d’être documentée. Il s’agit ici notamment du rôle du cobalt comme élément associé au métabolisme de la cobalamine, facteur de détoxification cyanhydrique et élément-trace métallique potentiellement toxique.
L’objectif de la présente étude était de déterminer les liens entre le cobalt, le stress oxydatif et les troubles neurologiques et cognitifs chez des enfants vivant dans le milieu affecté par le konzo.
SUJETS ET METHODES
Sujets
Site de l’étude
Le site de recrutement des enfants était la cité de Kahemba dans le territoire de Kahemba dans la province du Kwango au sud-ouest de la République Démocratique du Congo (Figure1). Le territoire de Kahemba se trouve dans la zone intertropicale sur un vaste plateau de 1 222 m d’altitude, disséqué par les vallées en auge des rivières Lutshima, Kwenge et Tunduala. A l’heure actuelle, la cité de Kahemba détient la plus forte prévalence du konzo dans le monde avec un taux de 5%, le taux de malnutrition aigüe y est de 10% chez les enfants de 0 à 5 ans (33).
Population d’étude
Un échantillon de convenance de 40 enfants, dont 21 enfants atteints de konzo (17 au stade sévère et 4 au stade léger) et 19 enfants présumés sains, a été tiré d’une population d’étude de 210 enfants dont 123 atteints de konzo et 87 présumés sains. Ces deux cent dix enfants étaient enrôlés dans une étude épidémio-clinique réalisée sur le konzo à Kahemba en 2011 (25).
Le diagnostic du konzo a été posé par les médecins neurologues de l’équipe multidisciplinaire de l’étude épidémio-clinique sur le konzo en République Démocratique du Congo. Les critères de la maladie selon l’Organisation Mondiale de la Santé (OMS) ont été utilisés pour le diagnostic du konzo (40) : -une paraparésie manifeste spastique symétrique d’installation brutale en une semaine, non progressive, chez une personne en bonne santé ; -des réflexes ostéo-tendineux exagérés au niveaux rotulien et achilléen ; -sans signes d’une autre affection de la moelle.
La gravité du konzo est définie par l’OMS (40), comme suit : – Atteinte légère : l’individu est capable de marcher sans soutien ; -Atteinte modérée : il nécessite un soutien pour marcher ; -Atteinte sévère : il est incapable de marcher.
Les enfants présumés sains, constituant un groupe de contrôle, ont été recrutés dans une approche d’appariement mais échouée, selon les critères ci-après – enfants présumés sains de même âge et même sexe ; – vivant dans le même environnement que les enfants konzo et qui étaient présents au moment où les enfants konzo sont tombés malades.
Pour tous les enfants, l’évaluation des performances cognitives avait été réalisée par les médecins neurologues formés à l’évaluation neuropsychologique dans les domaines de l’analyse visuo-spatiale (SIMUL), des aptitudes d’apprentissage immédiat et mémoire de rappel (LEARN et DELAY) et de planification (PLAN) ainsi que dans le domaine de la mémoire de travail (SEQ) au moyen de KABC-II (Kaufman Assessment Battery for Children, 2ème édition) (4,19) tandis que l’évaluation de leurs capacités neuromotrices dans les domaines de la motricité fine et globale a été réalisée par le BOT-2, (Bruininks/Oseretsky Test, 2ème édition) (4,9). L’indice de processus mentaux ou fonctionnement cognitif global (MPI) et la capacité neuromotrice globale (TOTMOT) ont été calculés pour chaque enfant (4,9,19).
Méthodes
Type d’étude
Il s’agit d’une étude transversale analytique auprès des enfants atteints de konzo (EAK) et des enfants présumés sains (EPS), non konzo ou contrôles.
Variables d’intérêt
Les principales variables d’intérêt étaient les taux sériques des isoprostanes indicateurs du stress oxydatif, les taux sanguins de cobalt et d’autres éléments traces-métalliques, les taux sanguins et urinaires du thiocyanate (SCN) comme marqueur de l’intoxication cyanhydrique ainsi que l’état neurologique et les performances cognitives.
Procédures de collecte des données
Collecte des échantillons de sang et d’urine
Les prélèvements auprès des enfants konzo et des enfants présumés sains ont été faits à Kahemba par les techniciens de laboratoire de l’Institut National de Recherche biomédicale (INRB) en RDC, expérimentés, formés pour le travail sur terrain et membres de notre équipe. Pour chaque enfant, 4 ml de sang veineux ont été respectivement collectés dans un tube sans anticoagulant pour le sérum et dans un tube avec anticoagulant EDTA pour le plasma. Les urines de chaque enfant ont aussi été prélevées et rapidement conservées dans de l’azote liquide. Après leur collecte, le sérum, le plasma et les urines ont été acheminés à Kinshasa dans de l’azote liquide à l’INRB, d’où ils ont été envoyés sous carboglace à Oregon Health and Science University (OHSU) pour les différentes analyses.
Dosage de thiocyanates urinaire et sanguin
Le thiocyanate urinaire a été mesuré par la méthode semi-quantitative de Howard Bradbury (7), les taux étaient exprimés en micromoles par litre (µmol/l). Le thiocyanate plasmatique, exprimé en µmol/l, a été dosé par spectrométrie (6).
Dosage des isoprostanes libres sériques
Nous avons utilisé la méthode légèrement modifiée de Zhao d’extraction par phase solide (43). La chromatographie à haute performance liquide (HPLC) couplée à la spectrométrie de masse en tandem (LC-MS/MS) a été utilisée pour déterminer les taux sériques des Isoprostanes libres. Les paramètres de spectre de masse LC-MS/MS ont étés menés en utilisant un ABSciex 5500 QTRA (43). Les isoprostanes III (IsoP-III) ; isoprostanes-III totales (IsoP IIItot), isoprostanes-VI (Iso P-VI), isoprostanes-VI totales (IsoP-VI tot), 8,12- isoprostanes VI (8,12-IsopP-VI) étaient les quatre classes d’isoprostanes détectées par la technique de dosage utilisée. Leurs taux étaient exprimés en ng/ml. Les 8,12- isoprostanes VI (8,12-IsopP-VI) ont été considérés comme le principal marqueur du stress oxydatif (24).
Dosage des taux sériques des éléments-traces métalliques
La spectrométrie de masse à plasma à couplage inductif (ICP-MS) a été la méthode utilisée pour déterminer les taux sériques des éléments-traces métalliques. Pour le dosage, nous avons utilisé l’Agilent 7700 équipé d’un auto-échantillonneur ASX 250. Le système a été exploité à une puissance radiofréquence de 1550 W, un débit de gaz plasma d’argon de 15 l / min et un flux de gaz de transport Ar de 1,08 l / min. Le manganèse (Mn), le fer (Fe), le cobalt (Co), le cuivre (Cu) et le zinc (Zn) ont été mesurés en mode de réduction de l’énergie cinétique (KED) en utilisant l’hélium (He) gazeux (4,2 ml / min) ; Le sélénium (Se) a été mesuré en mode cellule de collision en utilisant de l’hydrogène (H2) (3,5 ml / min) ; le mercure (Hg) et le plomb (Pb) ont été mesurés en mode sans gaz. Les taux ont été exprimés en µg/l.
Les valeurs recommandées par l’OMS et les valeurs des moyennes et des médianes compilées de 100000 individus de 55 pays sur base des travaux de 60 investigateurs (16,41) avaient servi de référence pour apprécier la normalité des taux sériques des éléments traces-métalliques.
Analyse statistique
Le logiciel SPSS version 21 a été utilisé pour les analyses statistiques, à un seuil de signification p < 0.05. L’analyse initiale a consisté à une comparaison des caractéristiques biochimiques entre les deux groupes en étude en utilisant le test t de Student, le test de Mann-Whitney ou encore le test de Kruskal-Wallis. Le coefficient de Spearman a été calculé pour voir la corrélation entre les taux des isoprostanes (mesure du stress oxydatif), et les taux sériques de Fe, Se, Cu, Zn, Mn, Co, Hg et Pb mais aussi entre ces derniers et les performances neurocognitives. Les taux sériques de Co ont été regroupés en deux et trois groupes (taux inférieurs et ou supérieurs aux normes et taux correspondant aux normes). Les analyses de variance et covariance ont été utilisés pour établir l’association entre le cobalt, le stress oxydatif, et les performances neurocognitives avec un ajustement pour l’âge et le sexe.
Considérations éthiques
L’étude portant sur les mineurs, l’objet de la recherche a été présenté aux parents et tuteurs des enfants en présence de ceux-ci, en lingala et kikongo deux langues localement utilisées, pour le consentement éclairé. Les parents qui ont donné leurs accords ont signé un formulaire de consentement éclairé avec possibilité de rétraction non conditionnelle. Le protocole de recherche de cette étude avait reçu avant son exécution, l’approbation des comités éthiques du Ministère de la santé publique (Lettre N/Réf. CNM/MD/125/2011) et de l’Oregon Health and Science University (OHSU).
RESULTATS
Caractéristiques cliniques générales de l’échantillon
Dans le groupe konzo, il y avait 10 filles et 11 garçons tandis que dans le groupe contrôle il y avait 9 filles et 10 garçons. L’âge moyen (± ET) des enfants konzo étaient 9,2 (±3,2) ans et dans le groupe contrôle, l’âge moyen (± ET) était de 9,3 (± 2,9) ans. La différence des moyennes d‘âge entre les deux groupes n’était pas statistiquement significative (Tableau I).
Les performances neurocognitives globales (MPI, TOTMOT) des enfants avec konzo étaient dégradées par rapport aux enfants non konzo (p <0,05). La moyenne (±ET) était de 61,75 (±10,02) pour la MPI des enfants non konzo versus 53,48 (± 6,78) pour les konzo. Pour TOTMOT, la moyenne (±ET) était de 35,75 (± 7,03) pour les enfants non konzo versus 21,19 (± 2,32) pour les enfants konzo. Les médianes (Intervalle Interquartile=IIQ) de MPI et de TOTMOT pour les enfants non konzo étaient de 57,50 (14) et 33,50 (11) contre 52,00 (10) et 20,00 (2) pour les enfants avec konzo.
Taux de thiocyanate urinaire et plasmatique des enfants konzo et non konzo
Les taux de SCN urinaire de l’échantillon global variaient entre 172 et 1032 µmol/l d’urine avec une moyenne (±ET) et une médiane (IIQ) respectives de 416,13 µmol/l ±238,223 et de 344,00 µmol/l (344). Comme le montre le Tableau I, la différence des taux moyens de SCN urinaire entre les deux groupes n’était pas statistiquement significative (p = 0,59). Dans l’ensemble, le taux de SCN plasmatique variait de 91µmol/l à 325 µmol/l, avec une moyenne (±ET) et une médiane (IIQ) respectivement de 203,760 µmol/l ± 68,202 et 197,500 µmol/l (107,25). Le taux moyen de SCN plasmatique des enfants konzo était plus bas que celui des enfants non konzo, la différence des moyennes entre les deux groupes était à la limite statistiquement significative (p = 0,05) (Tableau I).
Taux sérique des isoprostanes des enfants konzo et non konzo
Au regard du Tableau I, Il n’y avait pas de différence significative des moyennes de deux groupes quant aux taux sériques de différentes classes d’isoprostanes, sauf pour les taux sériques de la 8,12IsoP-VI qui montraient une différence significative entre les deux groupes (p = 0,04), avec des taux plus élevés chez les enfants konzo.
Taux sériques des éléments métalliques essentiels et potentiellement neurotoxiques et statut neurologique des enfants
Les taux sériques des métaux essentiels Se, Cu, et Zn des enfants inclus étaient en général inférieurs aux valeurs de référence trouvées dans la littérature (16, 41) (Tableau II). Chez les enfants avec konzo, les déficiences en ces métaux étaient encore plus marquées, 16/16 avaient des taux de Se inférieurs à la norme, 13/16 des taux de Cu inférieurs à la norme et 15/16 des taux de Zn inférieurs à la norme. Bien que les enfants konzo aient montré des taux quantitativement plus bas de ces trois éléments que les non konzo, les différences entre les deux groupes n’étaient cependant significatives que pour le Se et le Cu (p <0001 et p = 0,031 respectivement) (Tableau III).
Par rapport à la sévérité de la maladie, les enfants au stade 3 avaient des déficiences nutritionnelles en Se encore plus marquées que ceux du groupe contrôle (Figure 2a), la différence entre les deux groupes était très significative (p < 0,001). Pour le Mn, 12/22 enfants dont 8 non konzo avaient des taux normaux. Quant au fer, 9/30 enfants dont 5 konzo avaient des taux normaux. Par ailleurs, 11/22 enfants dont 6 non konzo avaient des taux normaux de Co (Tableau II). Les taux sériques des métaux neurotoxiques Hg et Pb, étaient par contre dans les limites de référence pour tous les enfants sauf pour 3 enfants sur 22 en ce qui concerne le plomb qui avaient des taux au-delà des limites de référence (Tableau II). Cependant, les taux de ces deux métaux neurotoxiques étaient supérieurs chez les enfants avec konzo par rapport aux enfants présumés sains et la différence entre les deux groupes n’était significative pour le Hg (p = 0,030) (Tableau III). Le taux de Hg était plus élevé chez les enfants au stade 3 par rapport aux présumés sains (Figure 2b), la différence entre les deux groupes était statistiquement significative (p < 0,01).
Relation entre les différents éléments métalliques
Des corrélations significatives ont été trouvées chez les 40 enfants entre les différents éléments métalliques. Le taux sérique de Zn était positivement corrélé à ceux de tous les autres métaux, sauf avec ceux du Co et du Pb. Le Pb était fortement corrélé au Mn, Hg et Co ; r = 0,750, p = 0,001 ; r = 0,669, p = 0,001 ; r = 0,733, p = 0,001 respectivement.
Relation entre les éléments métalliques et les isoprostanes comme marqueur du stress oxydatif
Des corrélations positives ont été trouvées entre les taux sériques de 8,12-IsoP-VI et les taux sériques des métaux neurotoxiques, avec le Pb (r = 0,73, p = 0,01), et le Hg (r = 0,577, p = 0,002). En plus, une corrélation positive a été trouvée entre les taux sériques des IsoP-VI tot et de Pb (r = 0,729, p = 0,001). Par contre pour le sélénium, une corrélation négative a été trouvée avec les taux sériques des 8,12-IsoP-VI (r = – 0,518, p = 0,006). Les taux sériques de Fe et de Co tendaient aussi à être associés positivement aux taux sériques de la 8,12-IsoP-VI (r = 0,33, p = 0,097 ; r = 0,395, p = 0,094 respectivement) (Tableau IV).
En considérant 3 groupes des taux sériques de Co, selon les valeurs de référence indiquées dans le Tableau II, les taux sériques de la 8,12- IsoP-VI étaient plus élevés dans le groupe avec des taux de Co supérieurs à la référence normale (p = 0,031). Avec l’ajustement pour l’âge, les taux sériques de la 8, 12-IsoP-VI étaient moins élevés chez les garçons et dans le groupe avec des taux sériques de Co correspondant aux valeurs de référence (Tableau V et Figure 3).
Relation entre les troubles neurocognitifs, le stress oxydatif et les éléments métalliques
Il y avait des corrélations négatives significatives, sauf pour le planning, entre les taux de 8,12IsoP-Vl comme marqueur du stress oxydatif et les performances cognitives et neuromotrices : r = -0,610 ; p<0,001 avec l’Indice global de fonctionnement cognitif (MPI) ; r = -0,601 ; p = 0,001 avec la mémoire de travail (SEQ) ; r = – 0,546 ; p = 0,001 avec les capacités d’analyse visuo-spatiale (SIMUL) ; r = -0,426 ; p = 0,01 avec l’apprentissage immédiat (LEARN) ; r = -0,395 ; p = 0,028 avec la mémoire de rappel, r = – 0,16 ; p = 0,435 avec le planning (PLAN) et r = -0,407 ; p = 0,021 avec les capacités neuromotrices globales (TOMOT). Des corrélations positives ont été trouvées entre toutes les performances neurocognitives des enfants et les taux de Se, sauf avec les capacités d’apprentissage immédiat ou ‘’LEARN’’ (Tableau VI). Les taux de Hg étaient en corrélation négative significative avec les capacités neuromotrices globales (TOTMOT) (r = – 0,384 ; p = 0,036). Les taux de Cobalt étaient corrélés négativement aux capacités neurocognitives à l’exception des capacités de mémoire de rappel, mais cela n’était pas statistiquement significatif. L’analyse des capacités neurocognitives des enfants en relation avec les taux de Co, suivant les limites de référence indiquées plus haut au Tableau II, avait montré que les capacités de la mémoire de travail (SEQ), d’apprentissage immédiat (LEARN), de la mémoire de rappel (DELAY) et de fonctionnement cognitif global (MPI) plus élevées s’associaient aux taux sériques de Co dans les limites de référence, p = 0,05 ; 0,002 ; 0,002 et 0,026 respectivement (Tableau VII). Les enfants avec des taux sériques de Co dans les limites de la référence montraient des performances cognitives plus élevées dans l’apprentissage immédiat, la mémoire de rappel et l’indice global de fonctionnement cognitif et ceux avec des taux supérieurs avaient des performances plus basses, p respectivement égal 0,002, 0,001 et 0,041. Les enfants présumés sains, avec des taux sériques de Co supérieurs et inférieurs à la référence, n’avaient des performances cognitives significativement dégradées par rapport à celles de ceux avec des taux de Co dans les limites de référence que dans le domaine de LEARN (p = 0,026), alors les enfants atteints de konzo avec la même catégorie de taux sériques de Co avaient des performances cognitives dégradées dans les domaines de LEARN ( p = 0,016), DELAY(0,008), SIMUL (p = 0,008) et de MPI( p = 0,008).
Cependant dans l’ensemble de tous les enfants, l’analyse des covariances impliquant l’âge et les taux de Co par rapport aux valeurs de référence, avait montré que les enfants avec des taux sériques de Co inférieurs ou supérieurs aux valeurs de référence avaient des capacités neurocognitives dégradées par rapport à ceux dont les taux de Co étaient dans les limites de valeurs de référence. Indépendamment de l’âge, les différences étaient significatives dans les domaines de LEARN (p = 0,010) et de DELAY (p = 0,007) (Tableau 8).
DISCUSSION
Les résultats de la présente étude mettent en évidence pour la première fois la déficience en cobalt chez les enfants vivant en milieu konzo de l’ordre de 40,90% (9/22). Cette déficience en cobalt, pouvant traduire la déficience en vitamine B12, pourrait en partie s’expliquer par son élimination permanente sous forme de cyanocobalamine consécutive à l’exposition cyanhydrique chronique (3,8,27). Cette perte permanente de la vitamine B12 est susceptible de priver d’autres voies métaboliques de ce cofacteur avec des conséquences neurodéveloppementales (12,21,28,30,34). La déficience pourrait aussi s’expliquer par l’insécurité alimentaire à laquelle ces enfants sont exposés et par la malnutrition (1,2,12,33,35,37).
La déficience en cobalt était associée à un niveau élevé de la 8, 12-IsoP-VI, ce dernier étant un biomarqueur du stress oxydatif associable au risque d’apoptose et de neurodégénerescence (23,24). Cependant, dans le site de l’étude, l’élévation du taux sérique de la 8, 12-IsoP-VI n’est pas attribuable à cette seule déficience du cobalt. En effet, chez les enfants vivant en milieu konzo, les taux sériques de la 8, 12-IsoP-VI sont aussi corrélés négativement aux taux sériques du sélénium (10,22). En outre, dans notre présente étude, les taux de la 8, 12-IsoP-VI (marqueur du stress oxydatif) étaient aussi positivement corrélés à ceux du plomb et du mercure bien que les taux sériques de ces deux métaux lourds neurotoxiques aient été trouvés dans les limites de référence. Le stress oxydatif associé à la neurotoxicité de ces deux métaux qui n’ont aucun rôle physiologique dans le corps humain ainsi que les conséquences neurocognitives sont connues (18). En plus, le sexe féminin était caractérisé par un stress oxydatif, avec des taux de la 8, 12-IsoP-VI plus élevés que chez le sexe masculin et suivant les trois les groupes de taux sériques de cobalt, ce qui suggère que la déficience en cobalt tendrait à majorer le stress oxydatif surtout chez les filles en milieu affecté par le konzo. Mais, il est à noter que le niveau élevé du stress oxydatif a été déjà décrit chez les filles dans le même milieu (22).
Les taux sériques bas et élevés de cobalt par rapport aux valeurs de référence étaient associés à des faibles performances cognitives notamment dans les domaines de l’apprentissage immédiat et de la mémoire de rappel, indépendamment de l’âge. Ces dernières constatations montrent l’influence du taux de cobalt sur le neurodéveloppement notamment sur l’apprentissage (12,20,21,26). Chez l’enfant, il est connu que les carences en cobalt, comme l’exposition, affectent l’apprentissage (11). Une étude récente sur des enfants congolais exposés à des doses élevées de cobalt d’origine environnementale a montré une forte association entre les taux élevés de cobalt (>5µg/l) et des capacités cognitives dégradées surtout dans l’apprentissage immédiat (5). Les résultats de cette dernière ainsi que les nôtres montrent le rôle du cobalt dans le développement cognitif de l’enfant et suscite des questions sur le rôle du cobalt ou des cobalamines dans le stress oxydatif et les troubles cognitifs chez l’enfant en milieu affecté par le konzo.
CONCLUSION
Nous avons montré que la déficience en cobalt contribue non seulement à l’élévation du stress oxydatif chez les enfants vivant en milieu konzo, mais aussi à la dégradation de leurs performances cognitives. La déficience en cobalt sérique, marqueur probable du métabolisme des cobalamines, serait due à la surutilisation des cobalamines du fait de besoins de la détoxification cyanhydrique. Cependant, la présente étude bute à quelques limites, qui doivent être considérées dans l’interprétation de nos résultats telles que : – la taille de l’échantillon qui ne nous a pas permis de dégager des différences entre les groupes selon les stades du konzo mais aussi d’effectuer une régression permettant d’ajuster les résultats aux taux des oligo-éléments comme le sélénium, le cuivre et le zinc impliquées dans les mécanismes antioxydant ; – la nature du cobalt dosé qui est le cobalt métallique alors que la forme impliquée dans la détoxification cyanhydrique chez l’Homme est la vitamine B12 ou l’hydroxocobalamine. Toutefois, la question du cobalt dans le konzo reste donc entière et nécessite des études ultérieures approfondies, notamment sur les marqueurs de la carence en hydroxocobalamine, les liens entre la carence en cobalt, les autres éléments traces-métalliques, le sexe, l’âge, l’état nutritionnel, le stress oxydatif, la vitesse de détoxification enzymatique, le konzo et les troubles cognitifs.
Conflits d’intérêts
Les auteurs déclarent l’absence de conflit d’intérêt.
Contributions des auteurs
Tous les auteurs ont contribué à la conception de l’étude et à la rédaction de l’article.
Ali-Ekangu Rosine, Daniel Okitundu Luwa E-Andjafono et Tshala-Katumbay Désiré ont contribué particulièrement à l’analyse des données.
Remerciements
Les auteurs remercient la population de la Cité de Kahemba, les autorités admnistratives et sanitaires de la Province du Kwango, du territoire et de la zone de Santé de Kahemba, particulièrement le médecin chef de zone Dr Jean Jacques Kaniki et l’infirmier superviseur Monsieur Dieudonné Kansenia, pour la collaboration et la participation à l’étude. Au dernier qui est décédé avant la fin de la rédaction de ce travail, les auteurs rendent un hommage particulier. Les auteurs sont également reconnaissants envers le « Fogarty International Center and NIEHS, NIH, Bethesda, USA » pour le Grant R01ES019841.
 Figure 1: Carte du Territoire de Kahemba au Sud-Ouest de la RDC/ Source : Rapport annuel 2015 du Territoire de KAHEMBA/CAID
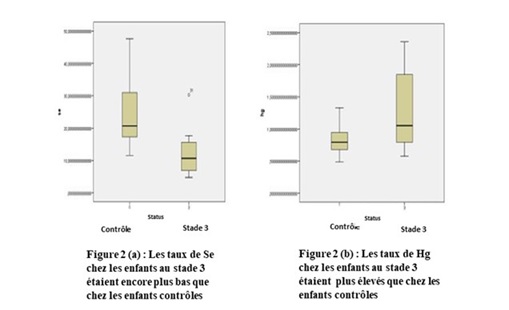
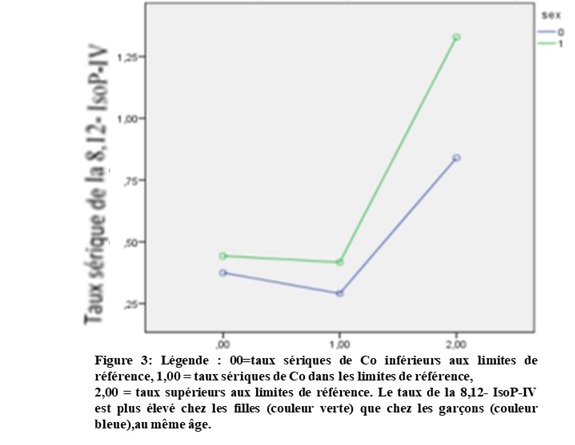
Tableau I : Age moyen, taux d’isoprostanes sériques des enfants konzo et non konzo
| Variables |
Konzo |
Non konzo |
P |
| Age (ans) |
9,2 (±3,2) |
9,3 (±2,9) |
0,94 |
| IsoP-III (ng/ml) |
0,3 (±0,1) |
0,3 (±0,1) |
0,68 |
| IsoP IIItot (ng/ml) |
3,1 (±1,7) |
3,4 (±2,2) |
0,64 |
| Iso P-VI (ng/ml) |
0,3 (±0,3) |
0,2 (±0,1) |
0,18 |
| IsoP-VItot (ng/ml) |
3,2 (±1,4) |
2,9 (±0,7) |
0,92 |
| 8,12-IsopP-VI (ng/ml) |
0,5 (±0,2) |
0,3 (±0,1) |
0,04 |
| SCN Urine (μmol/l) |
439,55 (±271,77) |
387 (±195,76) |
0, 59 |
| SCN Plasma (μmol/l) |
177,84 (±61,45) |
229,69 (±66,76) |
0 ,05 |
La comparaison des moyennes a montré que les enfants konzo produisaient moins de thiocyanate plasmatique (SCN Plasma (μmol/l) et plus de stress oxydatif (8,12-IsopP-VI (ng/ml) que les non konzo.
Tableau II : Taux sériques des éléments métalliques essentiels et neurotoxiques, selon le status konzo ou non konzo
|
Variables
(N) |
Dans la norme |
|
Inferieur a la norme |
Supérieur a
la norme |
|
Konzo |
Non konzo |
|
Konzo |
Nonkonzo |
Konzo Non konzo |
| Se (30) |
0 |
2
µmol/l (10,968) |
|
16 |
12 |
0 0 |
| Cu (30) |
3 |
4 |
|
13 |
8 |
2 0 |
| Zn (30) |
1 |
1 |
|
15 |
13 |
0 0 |
|
Fe (30)
(N=22) |
5 |
4
|
|
9 |
7 |
2 3 |
| Mn (22) |
4
|
8 |
|
3 |
4 |
2 1 |
| Hg (30) |
16 |
14 |
|
0 |
0 |
0 0 |
| Co (22) |
5 |
6 |
|
3 |
6 |
2 0 |
| Pb (21) |
9 |
9 |
|
0 |
0 |
2 1 |
Le taux sérique du cobalt été trouvé dans les limites des valeurs normales dans 11 /22 (50%) dont 5 enfants konzo contre 6 non konzo tandis que le taux du mercure était dans les limites de référence pour tous les enfants tant konzo que non konzo.
Tableau III : Taux sériques des éléments essentiels et potentiellement neurotoxiques des enfants konzo et non konzo par rapport à la référence OMS
|
Variables
(µg/l) |
Moyennes (±ET) |
|
Médianes |
Min-Max |
Références
(µg/l) p |
|
Konzo |
Non konzo |
|
Konzo |
Nonkonzo |
|
|
| Se (N=30) |
12,14 (± 6,490) |
25,171 (± 10,968)
µmol/l (10,968) |
|
10,685 |
24,268 |
(4,779 – 47,586) |
(46 – 143) 0,0001 |
| Cu (N=30) |
643,64 (±172,635) |
900,88 (± 413,464) |
|
619,869 |
771,204 |
(435,880 – 1066,515) |
(800 – 1750) 0,017 |
| Zn (N=30) |
449,823 (± 206,814) |
519,001(± 214,692) |
|
398,858 |
434,707 |
(172,945 – 1098,047) |
(700 -1200) 0,400 |
| Mn (N=22) |
7,060 (± 1,261) |
0,78 (± 0,438)
|
|
0,733 |
0,635 |
(0,137 – 61,665) |
(0,54 -1,76) 0,401 |
| Fe (N=30) |
1141,991 (±1303,138)
|
936,351 (±615,616) |
|
601,493 |
779,167 |
(215,903 – 4459,051) |
(750 – 1500) 0,667 |
| Co (N=22) |
0,14 (± 0,08) |
0,131 (± 0,093) |
|
0,200 |
0,107 |
(0,033 – 10,799) |
(0,11 – 0,458) 0,080 |
| Hg (N=30) |
1,307 (± 0,592) |
0,844 (± 0,262) |
|
1,051 |
0,79 |
(0,484 – 2,356) |
(,.2 – 5,08) 0,030 |
| Pb (N=21) |
0,862 (±1,344) |
0,812 (± 1,745) |
|
0,365 |
0,24 1 |
(0,063 – 6,051) |
(<1) 0,070 |
Les taux médians du Se, du Cu et du Hg présentaient des différences statistiquement significatives entre les enfants avec konzo et les enfants sans konzo alors que le taux de Co tendait à être statistiquement différent entre les deux groupes, avec des taux élevés chez les enfants sans konzo (p = 0.08).
Tableau IV : Coefficient de corrélation de Spearman entre les taux des différents éléments métalliques et les taux sériques des isoprostanes
| Eléments métalliques |
IsoP-III
r(p) |
IsoP-IIItot
r(p) |
IsoP-VI
r(p) |
IsoP-Vitot
r(p) |
8,12IsoP-VI
r(p) |
| Zn |
0,175(0,382) |
0,065(0,746) |
0,238(0,232) |
0,115 (0,569) |
0,155 (0,441) |
| Hg |
0,061(0,764) |
0,070 (0,728) |
0,174 (0,385) |
0,224 (0,260) |
0,577 (0,002) |
| Fe |
0,039(0,845) |
-0,096 (0,634) |
0,124 (0,538) |
0,311 (0,114) |
0, 33 (0,097) |
| Co |
0,142(0,563) |
-0,353(0,139) |
0,080 (0,745) |
0,281 (0,244) |
0,395 (0,094) |
| Pb |
0,195(0,439) |
0,077 (0,760) |
0,371 (0,130) |
0,729 (0,001) |
0,73 (0,001) |
| Cu |
0,232(0,244) |
0,019 0(,925) |
0,086 (0,671) |
0,126 (0,532) |
0,073 (0,717) |
| Se |
0,258(0,194) |
-0,123(0,540) |
-0,365 (0,061) |
-0,317(0,107) |
-0,52 (0,01) |
| Mn |
0 ,93 (0,704) |
-0,086 (0,726) |
– 0,40 (0,088) |
0,316 (0,188) |
0,334 (0,163) |
Les taux sériques des métaux neurotoxiques (Pb, Hg) étaient tous en corrélation positive avec la 8,12IsoP-VI tandis que le taux de Se était en corrélation négative avec la 8,12IsoP-Vl.
Tableau V : Association entre le stress oxydatif (taux sériques de 8, 12-IsoP-VI), le sexe, le taux de cobalt, modèle ajusté à l’âge
| Variables |
Β |
Intervalle de confiance
(IC 95%) |
P |
| Variation par rapport à l’âge et genre |
| Référence sexe féminin |
0 |
|
|
| Sexe masculin |
-0,489 |
[-0,863 à -0,115] |
0,015 |
| Age |
0,001 |
[-0,031 à 0,033] |
0,950 |
| Variation par rapport à la référence |
| Co au-dessus des valeurs de référence |
0 |
|
|
| Co au niveau des valeurs de référence |
0,421 |
[0,003 à 0,840] |
0,049 |
| Co en dessous des valeurs de référence |
0,363 |
[-0,053 à 0,778] |
0 ,081 |
En prenant les filles comme référence, le stress oxydatif était réduit de 51 % chez les garçons (β=-0,489 ; p = 0,015). En considérant le taux de Co supérieur aux valeurs normales comme référence, le niveau de stress oxydatif était significativement moins élevé chez les enfants ayant des taux de Co dans les limites de la référence (p=0,049).
Tableau VI : Coefficient de corrélation de Spearman entre les taux des différents éléments métalliques, les performances neurocognitives
| Eléments métalliques |
TOTMOT
r(p) |
MPI
r(p) |
SEQ
r(p) |
SIMUL
r(p) |
LEARN
r(p) |
PLAN
r(p) |
DELAY
r(p) |
| Zn |
0,036 (0,849) |
0,013 (0,945) |
0,217 (0,249) |
-0,211 (0,264) |
0,020 (0,915) |
0,332 (0,122) |
0,012 (0,950) |
| Hg |
-0,384 (0,036) |
-0,242 (0,198) |
-0,215 (0,255) |
-0,301 (0,106) |
-0,176 (0,353) |
0,041 (0,852) |
-0,166 (,391) |
| Fe |
0,033 (0,863) |
-0,169(0,373) |
-0,067 (0,726) |
-0,161 (0,396) |
-0,348 (0,059) |
0,257 (0,237) |
-0,249 (,0194) |
| Co |
-0,376 (0,085) |
-0,099 (0,661) |
-0,050 (0,824) |
-0,200 (0,372) |
0,042 (0,854) |
-0,414 (0,099) |
0,044 (0,850) |
| Pb |
-0,185 (0,422) |
-0,365(0,104) |
-0,160 (0,489) |
-0,420 (0,058) |
-0,126 (0,585) |
-0,331(0,210) |
-0,072 (0,764) |
| Cu |
0,352 (0,056) |
0,344 (0,063) |
0,411 (0,024) |
0,027 (0,888) |
0,248 (0,186) |
0,242 (0,265) |
0,250 (0,192) |
| Se |
0,602 (<0,001) |
0,584 (0,001) |
0,585 (0,001) |
0,480 (0,007) |
0,327 (0,078) |
0,481 (0,020) |
0,444 (0,016) |
| Mn |
-0,243(0,276) |
-0,192 (0,391) |
0,010 (0,966) |
-0,276 (0,214) |
0,044 (0,845) |
-0,193 (0,442) |
0,089 (0,702) |
Les taux des métaux potentiellement neurotoxiques Hg étaient en corrélation négative avec l’indice globale des performances motrices TOTMOT. Les taux sériques de Co étaient corrélés négativement à toutes les capacités neurocognitives sauf avec la mémoire de rappel bien que toutes les corrélations soient statistiquement non significatives.
Tableau VII : Variation des capacités cognitives en fonction de taux sériques du cobalt classés selon la référence normale
(Analyse de variance)
|
Valeurs moyennes ±Ecart-type selon les groupes des taux de Co |
|
| Variables cognitives |
Taux dans les limites normales (TLN), n=11 |
Taux Inférieurs à la référence (TIN), n=9 |
Taux supérieurs à la référence (TSN), n=2 |
p |
| Apprentissage (LEARN) |
72,73 ±10,687 |
60,44 ± 7,367 |
48,00±0,000 |
0,002 |
| Mémoire de rappel (DELAY) |
77,90±10,365 |
63,67±9,381 |
50,50 ±4,950 |
0,002 |
| Mémoire de travail (SEQ) |
77,27±13,965 |
69,89±15,161 |
48,00±0,000 |
0,050 |
| Indice global de fonctionnement cognitif (MPI) |
61,45±9,543 |
55,33±7,50 |
43,00 ±0,00 |
0,026 |
|
TLN, n=11 |
TIN et TSN, n=11 |
|
| Apprentissage (LEARN) |
72,73±10,687 |
58,18±8,292 |
0,002 |
| Mémoire de rappel (DELAY) |
77,90±10,365 |
61,27±10,061 |
0,001 |
| Mémoire de travail (SEQ) |
77,273±4,525 |
66,091±10,365 |
0,096 |
| Indice global de fonctionnement cognitif (MPI) |
61,45±9,543 |
53, 09±8,360 |
0,041 |
Les enfants avec des taux sériques de Co dans les limites de la référence montraient des performances cognitives plus élevées dans l’apprentissage, la mémoire de rappel et l’indice global de fonctionnement cognitif et ceux avec des taux supérieurs avaient des performances plus basses.
Tableau VIII : Association entre l’apprentissage immédiat, la mémoire de rappel,
l’ âge et le taux de Cobalt
| Variables |
Β |
Intervalle de confiance
(IC 95%) |
P |
| Apprentissage immédiat |
| Age |
-1,434 |
[-3,176 -0 ,308] |
0,101 |
| Co au-dessus des valeurs de référence |
0 |
|
|
| Co en dessous des valeurs de référence |
13,161 |
[-1,098 à 27,421] |
0,068 |
| Co au niveau des valeurs de référence |
20,360 |
[5,393 à 35,327] |
0,010 |
| Mémoire de rappel |
| Age |
-1,599 |
[-3,176 à -0 ,308] |
0,108 |
| Co au-dessus des valeurs de référence |
0 |
|
|
| Co en dessous des valeurs de référence |
13,966 |
[-1,098 à 27,421] |
0,070 |
| Co au niveau des valeurs de référence |
23,082 |
[5,393 à 35,327] |
0,007 |
| |
Par rapport aux performances de cas avec des taux de Co supérieurs à la référence, les cas avec des taux de Co au niveau des valeurs de référence ont montré des performances plus élevées dans l’apprentissage immédiat et la mémoire de rappel, à la différence des cas avec des taux de Co en dessous des valeurs de référence (p=,010 et 0,007 respectivement) et cela indépendamment.
RÉFÉRENCES
- BANEA J, TYLLESKÄR T, TYLLESKÄR K, GEBRE-MEDHIN M, ROSLING H. Dietary cyanide from insufficiently processed cassava and growth retardation in children in the Democratic Republic of Congo (formerly Zaire). Annals of Tropical Paediatrics International Child Health 2000; 20(1):34-40.
- BANEA J, BRADBURY J, MANDOMBI C, NAHIMANA D, DENTON C. MATTHEW B, FOSTERB P, KUWAA N. TSHALA KATUMBAY D. Konzo prevention in six villages in the DRC and the dependence of konzo prevalence on cyanide intake and malnutrition. Toxicology reports 2015; 2:609-616.
- BAUMEISTER R, SCHIEVELBEIN H, ZICKGRAF-RÜDEL G. Toxicological and Clinical Aspects of Cyanide Metabolism. Arzneim.-Forsch. Drug Res. 1975; 25:7.
- BOIVIN M, OKITUNDU D. Neuroropsychological effects of konzo: a neuromotor disease associated with poorly processed cassava. Pediatrics 2013; 13(14):e1231- e1239.
- BORA K, RAMOS-CRAWFORD A, SIKORSKII A, BOIVIN M, LEZ DM, NGOYI D, MUKALAY WA MUKALAY A, LUWA D, TSHALA-KATUMBAY D. Concurrent exposure to heavy metals and cognition in school-age children in Congo-Kinshasa: A complex overdue research agenda. Brain Research Bulletin 2019 ;145:81-86
- BOWLER R. The determination of thiocyanate in blood serum. Biochem J. 1944; 38(5):385-8.
- BRADBURY M, EGAN S, BRADBURY H. Determination of all forms of cyanogens in cassava roots and cassava products using picrate paper kits. J. Sci. Food Agric. 1999; 79:593–601.
- BRÆKKAN O, NJAA L AND UTNE F. The Effect of Cyanide on Liver Reserves of Vitamin B12. Acta pharmacol. and toxicol. 1957; 13:228-232.
- Bruininks-Oseretsky. Test of Motor Proficiency-Second edition.2nd NCS Pearson Inc. Copy right 2005.
- BUMOKO M, SADIKI N, RWATAMBUGA A, KAYEMBE K, OKITUNDU L, MUMBA N, MUYEMBE T, BOIVIN M, TSHALA-KATUMBAY D. Lower serum levels of selenium, copper, and zinc are related to neuromotor impairments in children with konzo. Journal of the Neurological Sciences 2015; 349(1–2):149-153.
- CATALANI S, RIZZETTI M PADOVANI A, APOSTOLI P. Neurotoxicity of cobalt. Hum Exp Toxicol. 2012; 31(5):421-437.
- DROR D, ALLEN L. Effect of vitamin B12 deficiency on neurodevelopment in infants: current knowledge and possible mechanisms. Nutrition Review 2008; 66(5):250–255.
- FIEDLER H, WOOD J. Specificity studies on the p-mercaptopyruvatecyanide transsulfuration system. J. Biol. Chem. 1956; 222:387-397.
- FRANKENBERG L, SÖRBO B. Effect of Cyanide Antidotes on the Metabolic Conversion of Cyanide to Thiocyanate. Arch. Toxicol. 1975; 33:81-89.
- HERBERT, V. Staging vitamin B12 (cobalamin) status in vegetarians. The American Journal of Clinical Nutrition 1994; 59(5):1213S-1222S.
- IYENGAR V AND WOITTIEZ J. Trace elements in human clinical specimens: evaluation of literature data to identify reference values. Clinical chemistry 1988; 34(3):474-481.
- KAMBALE K, ALI E, SADIKI N, KAYEMBE K, MVUMBI L, YANDJU D, BOIVIN M, BOSS G, STADLER D, LAMBERT W, LASAREV M, OKITUNDU L, MUMBA N, BANEA J, TSHALA-KATUMBAY D. Lower sulfur transferase detoxification rates of cyanide in konzo – a tropical spastic paralysis linked to cassava cyanogenic poisoning. Neurotoxicology 2016; 59:256-262.
- KARRI V, SCHUHMACHER M, KUMAR V. Heavy metals (Pb, Cd, As and Me Hg) as risk factors for cognitive dysfunction: A general review of metal mixture mechanism in brain. Environmental Toxicology and Pharmacology 2016; 48: 203–213.
- KAUFFMAN A, KAUFFMAN N. Kauffman Assessment Battery for Children. Manual K-ABC-II. Pearson, San Antonio, 2004.
- KRACKE K. Biochemical Bases for Behavior Disorders in Children. Journal of Orthomolecular 1982; 114(2):289-296.
- LINDENBAUM J, HEALTON E, SAVAGE D, BRUST J, GARRETT T, PODELL E, MARGELL P, STABLER S, ALLEN R. Neuropsychiatric Disorders Caused by Cobalamin Deficiency in the Absence of Anemia or Macrocytosis. N Engl J Med.1988; 318:1720-1728.
- MAKILA-MABE BG, KIKANDAU KJ, SOMBO TM, OKITUNDU DL, MWANZA J-C, BOIVIN M, MUMBA N, MUYEMBE T, BANEA J, BOSS G, TSHALA-KATUMBAY D. Serum 8,12-iso-iPF2a-VI Isoprostane Marker of Oxidative Damage and Cognition Deficits in Children with Konzo. PLoS ONE 2014;9 (9):e107191
- MILLER E, MOREL A, SASO L, AND SALUK K. Isoprostanes and Neuroprostanes as Biomarkers of Oxidative Stress in Neurodegenerative Diseases. Oxidative Medicine and Cellular Longevity 2014:1-10.
- MORROW J, ROBERTS L. The isoprostanes. Current knowledge and directions for future research. Biochem Pharmacol. 1996; 51:1–9.
- OKITUNDU D, BUMOKO G, SOMBO M, KAMBALE J, MASHUKANO N, KAYEMBE T, MUMBA D, BOIVIN M, MUYEMBE J, BANEA J, TSHALA-KATUMBAY D. Persistance des épidémies de konzo à Kahemba, République Démocratique du Congo: Aspects phénoménologiques et socio-économiques. Pan Afr Med J. 2014; 18:213.
- PIHL RO. Recent evidence of physical abnormality in children with learning of Education. McGill Journal of Education 1979; 14(003):353-365.
- PIYATHILAKE C, MACALUSO M, HINE R, RICHARDS E, KRUMDIECK C. Local and systemic effects of cigarette smoking on folate and vitamin B12. The American Journal of Clinical Nutrition 1994; 60(4):559–566.
- SALINAS M, FLORES E, LÓPEZ‐GARRIGÓS M, LEIVA-SALINAS C. Vitamin B12 deficiency and clinical laboratory: Lessons revisited and clarified in seven questions. International journal of laboratory hematology 2018; 40:83-88.
- SCHLESINGER P, WESLEY J. An Expanded Mechanism for Rhodanese Catalysis. J. Biol Chem. 1974; 249:780–788.
- SESHADRI S, BEISER A, SELHUB J, JACQUES P, ROSENBERG I, D’AGOSTINO R, WILSON P, WOLF P. Plasma homocysteine as a risk factor for dementia and alzheimer’s disease. N Engl J Med. 2002; 346: 476-483.
- SMITH A, DUCKETT S. Cyanide, Vitamin B12 experimental demyelination and tobacco amblyopia. British journal experimental pathology. 1965;46(6):615-622
- SÖRBO B. Enzymatic transfer of sulfur from mercaptopyruvate to sulfate or sulfinates. Biochim Biophys. Acta 24. 1957:324–332.
- Statistiques sanitaires de la Zone de Santé de Kahemba, 2011.
- TAKAHASHIIÑIGUEZ T, GARCIA-HERNANDEZ E, ARREGUIN-ESPINOSA R, FLORES M. Role of vitamin B12 on methylmalonyl-CoA mutase activity. J Zhejiang Univ Science Bv. 2012 ; 13(6):423-437.
- TYLLESKÄR T, BANEA M. Epidemiological evidence from Zaire for a dietary etiology of konzo, an upper motor neuron disease. Bulletin of the World Health Organization 1991; 69 (5): 581-589.
- TYLLESKAR T, HOWLETT W, RWIZA H, AQUILONIUS S, STALBERG E, LINDEN B, MANDAHL A, LARSEN H, BRUBAKER G, ROSLING H. Konzo: a distinct disease entity with selective upper motor neuron damage. Journal of Neurology, Neurosurgery, and Psychiatry 1993; 56:638-643.
- TYLLESKÄR T. The causation of konzo studies on a paralytic disease in Africa. Acta Universitatis Upsaliensis, Comprehensive Summaries of Uppsala Dissertations from the Faculty of Medicine 1994; 413:67.
- VOLKOV I. The critical role of Vitamin B12. The Physician and sportsmedecine 2008;36(1):34-31.
- WAY J. Cyanide intoxication and its mechanism of antagonism Ann. Rev. Pharmacol. Toxicol. 1984; 24:451-481.
- Konzo a distinct type of upper motor neuron diseases. Weekly epidemiological records.1996, 71:225-232.
- Trace elements in human nutrition and health. World Health Organization. 1996:1-360.
- WOKES F, PICARD W. The Role of Vitamin B12 in Human Nutrition. Am J Clin Nutr. 1955;3(5):383-390.
- ZHAO Z, HJELM N, LAM C, HO CS. One-step solid-phase extraction procedure for F (2)-isoprostanes. Clin Chem. 2001; 47:1306-1308.
|
|