
|
|||
|
CLINICAL STUDIES / ETUDES CLINIQUES
ENCEPHALOPATHIES EPILEPTOGENES PRECOCES AVEC SUPPRESSION BURST
EARLY EPILEPTIC ENCEPHALOPATHIES WITH SUPPRESSION BURST
E-Mail Contact - BASSOLE Prisca-Rolande :
rolandebassole@gmail.com
RESUME Introduction Méthodologie Résultats Conclusion Mots clés : Encéphalopathies, Epilepsie, Epileptogènes, Précoces, Suppression burst ABSTRACT Introduction Methodology Results Conclusion Keywords: Encephalopathies, epileptic, Early, suppression burst INTRODUCTION On estime que 10,5 millions d’enfants de moins de 15 ans dans le monde ont une épilepsie active et que l’incidence de cette pathologie est encore plus élevée pendant la première année de vie [9]. Le cerveau, à cette période précoce, est en cours de maturation et va subir, du fait des crises épileptiques associées ou non à d’autres anomalies fonctionnelles ou biologiques, et/ou des anomalies électro-encéphalographiques (EEG) intercritiques, une détérioration des fonctions cérébrales définie sous le terme d’« Encéphalopathie Epileptogène (EE)». Des crises convulsives ont fréquemment été décrites dans le cadre d’encéphalopathie anoxo-ischémique (EAI) néonatale avec pronostic d’autant plus mauvais lorsque le tracé EEG est de type suppression burst [20]. De même, ont été décrites l’Encéphalopathie Myoclonique Précoce (EMP) par Aicardi et Goutières en 1978 [1] et l’Encéphalopathie Epileptique Infantile Précoce (EIEP) décrite par Ohtahara en 1976 [17]. Il s’agit de deux syndromes âge-dépendants d’épilepsies néonatales sévères qui ont en commun un pattern EEG de type suppression burst » et se caractérisent par une épilepsie sévère de début précoce, des crises pluriquotidiennes, voire incessantes, une encéphalopathie profonde [2]. Le tracé « suppression burst » est un tracé discontinu, sans aucune organisation physiologique, avec des bouffées d’anomalies paroxystiques diffuses, alternant avec des périodes de silence électrique pouvant durer plusieurs secondes. Ces EEG précoces avec pattern de « suppression burst » ont des présentations cliniques, neuroradiologiques et évolutives très différentes. Leur gravité réside dans leur pharmacorésistance, l’impact important sur le développement psychomoteur des enfants atteints et le handicap corollaire. Nous présentons des observations de patients souffrant d’encéphalopathie épileptogène précoce avec tracé de type suppression burst » dont nous identifierons les aspects cliniques, électro-encéphalographiques et évolutifs sous traitement. PATIENTS ET METHODES Il s’agissait d’une étude rétrospective et prospective à partir de dossiers médicaux de patients suivis à la clinique Neurologique du CHNU Fann dans le cadre d’une consultation spécialisée et allant de janvier 2013 à janvier 2015. Elle n’a intéressé que les patients avec une épilepsie ayant débuté dans les 3 premiers mois de vie associant retard du développement psychomoteur et pattern de suppression burst à l’EEG. Les aspects anamnestiques, cliniques, électro-encéphalographiques et évolutifs sous traitement ont été évalués grâce à une fiche d’enquête établie à cet effet. Comme autre donnée recueillie, il y avait les résultats de la TDM cérébrale. RESULTATS Quatre enfants aux initiales respectifs de (FM), (NNF), (GPML), (TSS) ont pu être suivis au cours de notre période d’étude. a)Les aspects cliniques des crises épileptiques Dans les antécédents de nos patients, on relevait des crises convulsives fébriles chez la mère à l’âge de 5 ans sans plus de détails pour l’un et la notion d’épilepsie chez une parente au premier degré de la mère pour l’autre (GPML – TSS). Dans 2 observations, on notait une notion de souffrance ftale aiguë et celle d’un décollement prématuré du placenta (FM – GPML). Les premières crises épileptiques sont survenues dans les trois premiers mois de vie soit à J1 de vie dans 2 observations, à J 30 de vie et en début du troisième mois de vie dans les deux autres. Au cours des premières consultations spécialisées aux âges respectifs de 3 ans, 5 mois 22 jours, 3 mois et 6 mois, le retard du développement psychomoteur était manifeste chez la totalité de nos patients (troubles du tonus, retard du langage, aucun contact social). Il existait un polymorphisme des crises observées dans notre étude oscillant entre les myoclonies, les crises toniques pures, les spasmes toniques et les accès de clonies oculaires. Les crises toniques étant cependant les plus observées. b)Les aspects EEG des patterns de bouffées suppressives Tous les EEG 1 de sommeil, au moment du diagnostic, réalisés chez tous nos patients mettaient en évidence un tracé désorganisé avec cet aspect d’alternance de bouffées d’activité paroxystique avec des périodes de silence ou d’hypo-activité caractéristique du pattern de « supression burst » à quelques variantes près: – L’EEG 1 de sommeil réalisé à l’âge de 3 ans (figure 1) retrouvait pour l’observation 1 (FM), des bouffées polymorphes durant en moyenne 3 secondes suivies de périodes d’hypoactivité d’une durée à peu près semblable qui se répétait pendant quasiment tout le temps de l’enregistrement. c)Les autres bilans complémentaires (TDMc) Une TDM cérébrale a pu être réalisée chez trois patients. Elle était normale chez un seul patient. Chez les deux autres (figures 5 et 6), elle mettait en évidence des aspects non spécifiques (atrophie sous corticale, lacunes périventriculaires sans aspect de leucomalacie, ectasie des sinus transverses sans signes de thromboses) (figures 5 et 6). d)Evolution électro-clinique sous traitement Le traitement anti convulsivant a été médicamenteux avec comme molécule principale le valproate de sodium (VPA) à une dose moyenne de 20 mg/Kg/jr. Ce traitement pris seul, a permis une amélioration de la symptomatologie avec un amendement des crises chez deux patients (NNF – GPML). En association avec d’autres molécules telles que le clonazépam, le phénobarbital ou le vigabatrin, ces traitements médicamenteux ont permis une amélioration de la symptomatologie en terme de diminution de l’intensité et de la fréquence des crises épileptiques qui sont demeurées persistantes dans les deux autres observations (FM – TSS). Des EEG 2 de sommeil de contrôle ont été réalisées chez la totalité de nos patients. Ils mettaient en évidence une bonne évolution électrique caractérisée par une détersion du tracé de contrôle avec retour des grapho-éléments physiologiques du sommeil (figure 7, 8 et 9) par rapport au tracé initial chez trois patients (FM – NNF- GPML) et une évolution vers un tracé de sommeil mal organisé pour l’âge avec une hypsarythmie fragmentée et des signes irritatifs prédominant en région pariéto-temporale droite compatible avec une encéphalopathie épileptique type WEST (figure 10) retrouvé chez le quatrième (TSS). Le retard du développement psychomoteur est resté persistant chez tous les patients. DISCUSSION Nous avons eu quelques limites dans la collecte des données ce qui explique que quatre patients seulement ont pu faire l’objet de notre étude. Ces limites sont: – L’EEG ne fait pas encore partie en pratique courante du bilan systématique à réaliser chez tous nouveau-nés à risque. Nos cas présentent des analogies évidentes avec les différentes observations d’EE précoces données dans la littérature [1 ; 4 ; 6 ; 7 ; 14 ; 20]. Dans notre étude, la survenue des premières crises épileptiques se situe bien dans les trois premiers mois de vie. Ceci est bien en adéquation avec la définition des syndromes épileptiques néonataux dans lesquels pour certains les premières crises peuvent survenir jusqu’à 3 mois de vie rentrant dans le cadre des épilepsies précoces [3 ; 15]. Au cours des premières consultations en neurologie, le retard du développement psychomoteur (RPM) était manifeste chez la totalité de nos patients. Ce RPM était associé aux crises épileptiques précoces, nous permettant d’emblée d’évoquer les hypothèses d’encéphalopathies épileptogènes précoces dans les quatre observations. Du point de vue des antécédents, il existait une notion d’épilepsies familiales chez deux patients. Certaines anomalies génétiques ont été mises en cause dans la survenue des EE précoces à savoir des anomalies du gène ARX, des mutations du gène GC1, des mutations ou délétions du gène STXBP1 ou MUNC 18-1 [2, 12 , 19]. De ce fait et vu qu’aucun test génétique n’a été réalisé dans la recherche étiologique chez nos patients, nous ne pouvons conclure formellement à une absence de transmission héréditaire de cette pathologie, d’autant plus qu’il existe des mutations de novo. Cependant, l’absence de consanguinité parentale ne milite pas pour une origine génétique familiale. Dans 2 observations, il existe des situations à haut risque d’anoxie périnatale [10] et donc d’EE précoce suivant les complications inhérentes. L’éventail clinique des EE précoces décrites dans la littérature oscille essentiellement entre les myoclonies et les spasmes toniques (1, 4, 6, 14, 20). Dans notre série, les crises toniques sont les plus fréquentes, observées au cours des enregistrements EEG, ce qui corrobore les travaux d’Ohtahara (1976), de Estivill (1984), de Yamatogi et Ohtahara (2002) et de Sarnat et Sarnat (1976). Associés aux crises épileptiques dans nos quatre observations, nous retrouvions des signes neurologiques à type de trouble du tonus (hypotonie axiale et hypertonie des membres) comme l’avaient indiqué Vigevano (1982) dans son article sur les encéphalopathies myocloniques précoces associées à des niveaux élevés d’acide propionique [23]. L’EEG revêt une importance capitale dans le diagnostic et le pronostic de ces EE précoces. En effet, 10% des crises convulsives précoces sont d’expression uniquement électro-encéphalographique et 15% des convulsions s’accompagneraient d’un EEG normal. Ceci montre le risque de sous-estimation ou de surestimation des convulsions précoces, et la nécessité d’un enregistrement EEG chez tout nouveau-né à risque [13]. Dans notre étude, tous les patients ont bénéficié d’un EEG initial et d’un EEG de contrôle mais aucun EEG n’a pu être réalisé en période néonatale ou dès l’observation des premières crises. Il semble exister une unanimité entre les différents auteurs préalablement cités. L’aspect caractéristique des tracés au cours de ces encéphalopathies est constitué par des bouffées à début et fin brusques, à voltage très élevé, parfois asynchrones, formées par un mélange anarchique d’ondes aiguës et de pointes, suivies de périodes d’hypoactivité d’une durée à peu près similaire (3-7 s). Ces caractéristiques donnent à l’EEG un aspect périodique, facilement reconnaissable qui demeure invariable pendant l’état de veille et de sommeil spontané, identifié sous le nom de suppression burst [5, 7, 22]. Des EEG de veille n’ont pu être réalisés dans notre série du fait de la difficulté d’enregistrement, les patients n’étant pas coopératifs à l’éveil. Les EEG 1 de sommeil réalisés chez tous nos patients présentaient tous cet aspect d’alternance de bouffées d’activité paroxystique avec des périodes de silence ou d’hypo-activité caractéristique du pattern de « suppression burst » à quelques variantes près : – Pour l’EEG 1 de sommeil réalisé à l’âge de 3 ans (FM) dans la première observation, on notera dans ce contexte particulier de survenue des crises convulsives suite à une souffrance ftale aiguë, le caractère particulier de la brève durée des bouffées – inférieure à 6 secondes – qui se révèle être délétère d’un point de vue du pronostic au vue des conclusions des travaux de D’Allest (1998) et Sinclair (1999) [5, 22]. L’hétérogénéité des présentations cliniques au cours des encéphalopathies épileptogènes précoces avec SB, témoigne de l’existence de causes diverses. Leur diagnostic et la précision de leurs caractères distinctifs, bien que plusieurs facteurs puissent être incriminés simultanément, implique une recherche étiologique soigneuse. Cette recherche inclue particulièrement une IRM cérébrale à la recherche de malformation. En effet, des anomalies structurelles du cerveau ont été incriminées comme facteur étiologique des encéphalopathies épileptiques néonatales principalement dans l’EIEP [11, 14, 18, 21]. Les investigations doivent prendre en compte également un bilan métabolique exhaustif, notamment à la recherche d’une anomalie dans le système de clivage de la glycine (hyperglycinémie sans cétose ; augmentation de la glycine dans le LCR), d’une maladie mitochondriale (anomalies de la chaîne respiratoire mitochondriale) et d’une recherche d’acidurie organique ou d’une hyperammoniémie. Une fois cette première étape réalisée, une analyse génétique est utile à savoir en particulier la recherche d’une anomalie du gène ARX, une mutation ou délétion du gène STXBP1/MUNC18-1. Sur le plan nosologique, le cadre des encéphalopathies précoces à bouffées périodiques reste cependant toujours à préciser. En effet, Ohtahara (1976) définit, pour l’EIEP, un syndrome reconnaissant des étiologies diverses – mais essentiellement malformatives ou dysplasiques dans les cas décrits – tandis qu’Aicardi et Goutières (1978) décrivent un tableau électro-clinique, l’EMP, pouvant correspondre soit à des étiologies du même ordre, soit secondaire à des anomalies métaboliques. En tout état de cause, lorsque les recherches biochimiques sont négatives, un tracé à bouffées périodiques a alors toutes les chances de correspondre à une encéphalopathie dysplasique ou malformative. La part respective de chaque étiologie demeure jusqu’à présent inconnue au sein de cohortes de patients présentant une EE précoce avec SB de même que la proportion de patients pour lesquels aucune étiologie n’est retrouvée. Les EE sont pharmacorésistantes [23]. Dans nos observations, le traitement anti convulsivant a été médicamenteux avec comme molécule principale utilisée chez la totalité des patients, seule ou en association, le valproate de sodium (VPA) à une dose moyenne de 20 mg/Kg/jr. Les EEG 2 de sommeil de contrôle réalisées chez tous nos patients mettaient en évidence une bonne évolution électrique chez trois patients dont 2 sous monothérapie par VPA et une évolution vers un tracé désorganisé type hypsarythmique retrouvé chez le dernier patient. Martin (1981) décrit des cas d’encéphalopathies épileptogènes précoces qui évoluent vers un syndrome de West avec un tracé EEG de type hypsarythmique [14]. Le retard psychomoteur était toujours présent lors du contrôle chez tous nos patients. Le pronostic des EE précoces avec SB reste sévère. Selon Yamatogi et Ohtahara, bien que les crises soient éventuellement supprimées vers 5-6 ans dans environ la moitié des cas, le pronostic du développement et de la vie sont très pauvres. Tous les patients qui ont survécu sont gravement handicapés, mentalement et physiquement. La mortalité est élevée, en particulier au stade précoce de la maladie avec quatre décédés avant 2 ans [24]. CONCLUSION Les encéphalopathies épileptogènes précoces représentent une entité nosologique très vaste et grave. A travers la littérature et nos observations, elles semblent constituer une réponse non spécifique à des lésions encéphalopathiques de nature variée liée à l’état de maturation cérébrale au moment où s’installe le processus épileptogène. Les résultats de ce travail ouvrent donc la perspective à des études complémentaires notamment longitudinales qui permettraient de mieux individualiser ces pathologies à début précoce. Elles pourront prendre en compte en plus des différents aspects que nous avons traités, l’aspect épidémiologique, rationaliser le bilan étiologique de ces encéphalopathies précoces surtout qu’il existe des causes curables parmi elles et déterminer des profils de réponses thérapeutiques permettant une meilleure prise en charge des patients. La recherche doit donc se poursuivre avec des bilans anatomo-pathologiques afin d’éclaircir les étiologies possibles et délimiter avec plus d’exactitude ces encéphalopathies épileptogènes précoces.
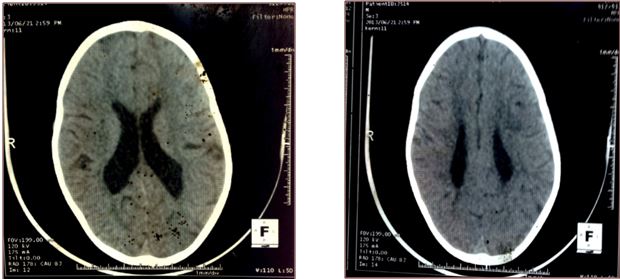 Figure 5: FM, TDM cérébrale sans injection de produit de contraste, coupe axiale 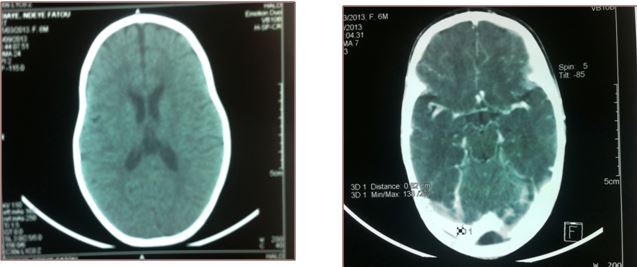 Figure 6: NNF, TDM cérébrale sans puis avec injection de produit de contraste, coupe axiale
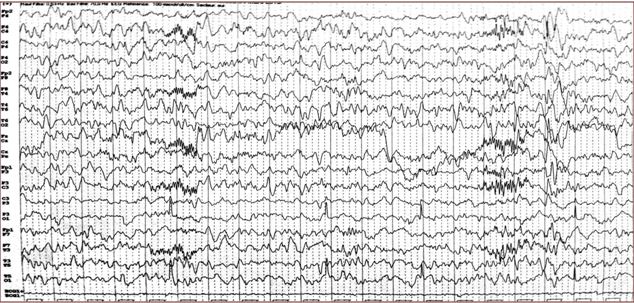 Figure 8: NNF, 1an 5mois, EEG 2 de sommeil avec une amplitude à 100 microvolts/cm (22/08/14)
REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647






