
|
|
|
ORIGINAL PAPERS / ARTICLES ORIGINAUX
EVOLUTION APRES CLIPPAGE DE L’ANEVRISME CEREBRAL EN MILIEU DE REANIMATION : UNE SERIE DE 32 CAS AU MALI
OUTCOME AFTER CLIPPING OF CEREBRAL ANEURYSM IN INTENSIVE CARE SETTINGS: A SERIES OF 32 CASES IN MALI
E-Mail Contact - SIDIBE AMADOU :
beidysi7@yahoo.fr
Résumé : Introduction : L’anévrisme cérébral est une ectasie d’une artère cérébrale. La cure chirurgicale fréquente, est associée à une morbi-mortalité élevée. Objectif : Décrire l’évolution des patients en réanimation après clippage d’anévrisme cérébral. Patients et Méthode : étude de cohorte à recueil historique de 8 ans (Novembre 2012 à Octobre 2020). La saisie et l’analyse ont été faites par Microsoft Word 2010 et SSPS version 25. Résultats : Durant la période d’étude, la prévalence était de 64 %. L’âge moyen était de 45,2 ± 12,5 ans. Le rapport femme-homme était de 2,55. Les patients résidaient à Bamako dans 75 %. L’HTA était l’antécédent médical le plus fréquent. Les patients étaient de grade I de WFNS dans 87,5%. A la tomodensitométrie, l’anévrisme siégeait sur le polygone de Willis dans 100%. L’échelle de Fischer était II ou IV dans 68,8%. La classe ASA II représentait 84,4%. Tous les patients ont été opérés sous anesthésie générale. Une antibioprophylaxie a été faite chez tous les patients. La perte sanguine moyenne était de 737,3 ± 460,5 ml. L’évènement per opératoire était cardiovasculaire dans 96,9 %. La durée moyenne de la chirurgie était de 267,1±77,1 minutes. Celle de l’anesthésie était de 427,9 minutes. En réanimation, une complication a été observée dans 34,4%. Il s’agissait : d’une complication neurologique (63,6%), cardiovasculaire (18,2%), métabolique et infectieuse dans 9,1% chacune avec un Glasgow Outcome Scale (GOS) de 3,9±1,7. La mortalité était de 25%. La durée moyenne de séjour était de 6,3 jours. Conclusion : Au Mali, le clippage de l’anévrisme cérébral est un progrès. Il s’accompagne d’une morbidité-mortalité élevée. Mots clés : Anévrisme cérébral – Clippage-Evolution-Réanimation.
Abstract: Introduction: The cerebral aneurysm is an ectasia of a cerebral artery. Frequent surgical treatment is associated with high morbidity and mortality. Objective: To describe the evolution of patients in intensive care after clipping of a cerebral aneurysm. Patients and Method: cohort study with historical collection of 8 years (November 2012 to October 2020). Data entry and analysis were done by Microsoft Word 2010 and SSPS version 25. Results: During the study period, the prevalence was 64%. The mean age was 45.2 ± 12.5 years. The female to male ratio was 2.55. The patients resided in Bamako in 75%. Hypertension was the most frequent medical history. Patients were WFNS grade I in 87.5%. On computed tomography, the aneurysm sat on the polygon of Willis in 100%. The Fischer scale was II or IV in 68.8%. ASA class II accounted for 84.4%. All patients were operated under general anesthesia. Antibiotic prophylaxis was given to all patients. The average blood loss was 737.3 ± 460.5 ml. The intraoperative event was cardiovascular in 96.9%. The average duration of surgery was 267.1±77.1 minutes. That of anesthesia was 427.9 minutes. In intensive care, a complication was observed in 34.4%. These were: neurological (63.6%), cardiovascular (18.2%), metabolic and infectious complication in 9.1% each with a Glasgow Outcome Scale (GOS) of 3.9±1.7. Mortality was 25%. The average length of stay was 6.3 days. Conclusion: In Mali, the clipping of brain aneurysm is a step forward. It is accompanied by high morbidity and mortality. Keywords: Cerebral aneurysm- Clipping- Outcome-Resuscitation. Introduction : L’anévrisme cérébral est une ectasie de la paroi artérielle cérébrale. Il est le plus souvent révélé après un accident vasculaire cérébral (AVC). Son incidence varie selon les pays entre 2,5 et 28/100 000 [8]. L’anévrisme cérébral touche le sexe féminin dans plus de 60%avec une clinique polymorphe [8]. L’artériographie cérébrale précise son siège. [8,16]. Le traitement de l’anévrisme rompu est une urgence. Il se fait par voie chirurgicale (clip) ou endovasculaire (embolisation). La cure chirurgicale est hémorragique [8,16]. Le taux de morbidité-mortalité est élevé malgré les progrès diagnostiques et thérapeutiques [8]. L’évolution peut être émaillée de complications : le resaignement, le vasospasme, l’hydrocéphalie, épilepsie [8]. En Afrique, la pratique de l’anesthésie réanimation est caractérisée par un manque de moyens matériels, une pénurie en personnels qualifiés et une morbidité-mortalité élevée. Le Mali n’échappe pas à ce constat [8]. Au Mali, la radiographie interventionnelle n’est pas envisageable. Il nous est apparu intéressant de décrire l’évolution des patients opérés pour clippage d’anévrisme cérébral en milieu de réanimation. Nous rapportons notre expérience d’un pays à revenu faible. Le but de notre étude était de : décrire l’évolution des patients après clippage d’anévrisme cérébral en réanimation de l’admission jusqu’à la sortie. Type d’étude : Il s’agissait d’une étude de cohorte à collecte historique de huit (8) ans de Novembre 2012 à Octobre 2020. Elle a eu comme cadre le service d’anesthésie-réanimation (SAR) de l’hôpital du Mali. L’hôpital du Mali est le seul centre hospitalier universitaire (CHU) situé sur la rive droite du fleuve Niger à Bamako. Elle a concerné tous les patients de tout âge, des deux (2) sexes, qui ont été opérés pour clippage d’anévrisme cérébral, et admis secondairement en réanimation. Nous n’avons pas inclus à l’étude, les patients opérés pour clippage d’anévrisme cérébral et admis en réanimation pendant la période d’étude avec un dossier médical incomplet ou non exploitable. Les données ont été recueillies à travers le registre de consultation, le registre de réanimation, la fiche d’anesthésie, le dossier du malade en réanimation et une fiche d’enquête préétablie. Les variables étudiées étaient : l’âge, le sexe, la résidence, les données cliniques, les données des examens biologiques, radiologiques, de l’anesthésie, les complications survenues et leur évolution. Les échelles d’évaluation cliniqueà valeur pronostique ont été appliquées : 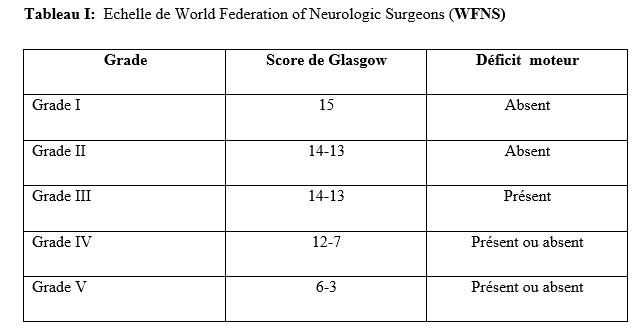 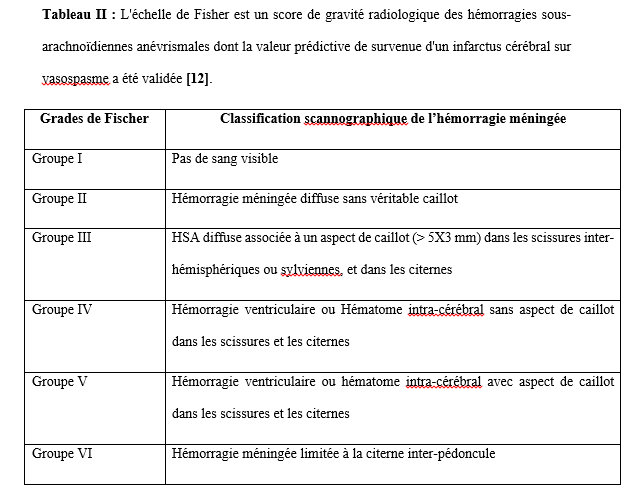 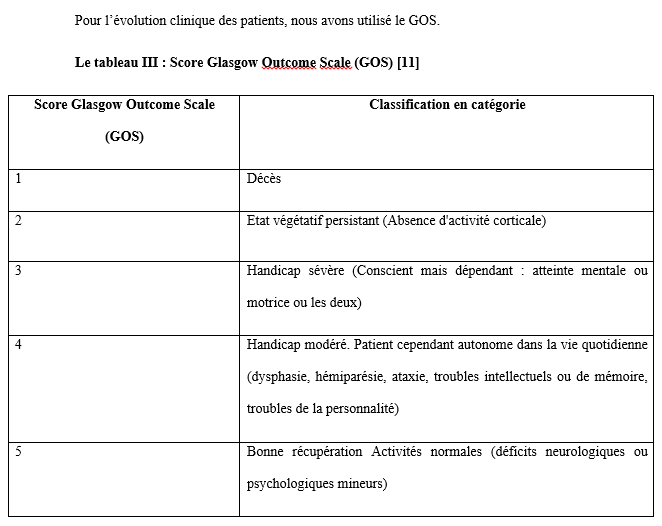 La saisie et l’analyse des données ont été faites à partir du logiciel SSPS version 25, Microsoft Word 2010. Les variables qualitatives ont été exprimées en effectif et en pourcentage. Les variables quantitatives ont été exprimées en moyenne et en écart-type. Résultats : Durant la période d’étude, nous avons colligé 32 patients sur 50 interventions pour clip page d’anévrisme cérébral soit une prévalence de 64%. L’âge moyen était de 45,2 ± 12,5 ans avec un rapport femme-homme de 2,55. Les patients résidaient à Bamako dans 75 %. Les données sociodémographiques sont illustrées dans le tableau IV. 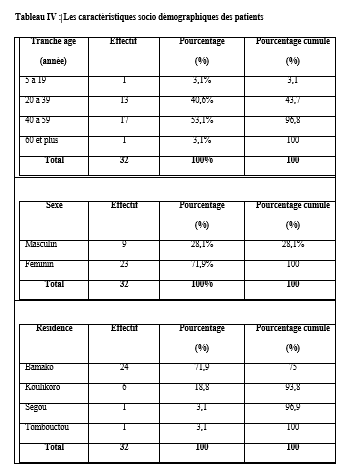 L’hypertension artérielle (HTA) était l’antécédent médical le plus fréquent avec 59,4%. Les patients étaient de grade I de WFNS dans 87,5%. Le tableau V montre l’évolution des patients en réanimation en fonction du grade WFNS. La tomodensitométrie cérébrale était réalisée chez tous les patients avec une localisation de l’anévrisme au niveau du polygone de Willis dans 100%. L’échelle de Fischer était II ou IV dans 68,8%. L’anévrisme était rompu dans 87,5 %. Le tableau V illustre l’évolution des patients en réanimation en fonction de l’échelle de Fisher. Les anomalies à l’électrocardiogramme (ECG) ont été observées chez 68,7%. Il s’agissait d’une hypertrophie du ventricule gauche (72,7%), un trouble de rythme (18,2%) et un bloc de branche incomplet (9,1%). La classe ASA II représentait 84,4%. La chirurgie était programmée chez tous les patients. Une antibioprophylaxie à base de β lactamine a été faite chez tous les patients. Il s’agissait de la céfazoline (90,6%) et de l’amoxicilline-acide clavulanique (9,4%). La perte sanguine moyenne était de 737,3 ± 460,5 ml. Une transfusion de concentré de globule rouge (CGR) per-opératoire a été faite dans 46,8% avec une moyenne de 2 ± 1,3 unités/ transfusion. L’incident per opératoire était : une HTA (34,4%), une hypotension (31,2%), une tachycardie (28,2%), une bradycardie (3,1%) et une allergie (3,1%). La durée moyenne de la chirurgie était de 267,1±77,1 minutes, celle de l’anesthésie de 427,9 minutes. En réanimation, le traitement a consisté à une analgésie multimodale (100%), un apport hydroélectrolytique (100%), la nimodipine (87,5%), un anticonvulsivant (53,1%), un corticoïde (50%), une transfusion de CGR (43,8%), la neurosédation (28,1%). Une complication a été observée dans 34,4%. Il s’agissait d’une complication neurologique (63,6%), cardiovasculaire (18,2%), métabolique et infectieuse dans 9,1% chacune. 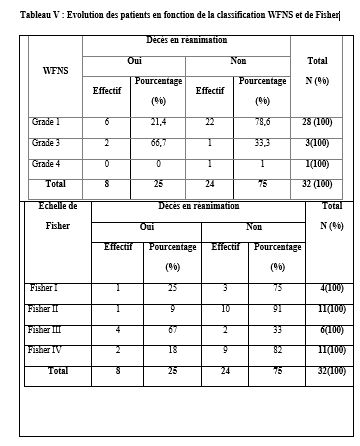 Les différentes complications survenues en réanimation sont répertoriées sur le tableau VI. 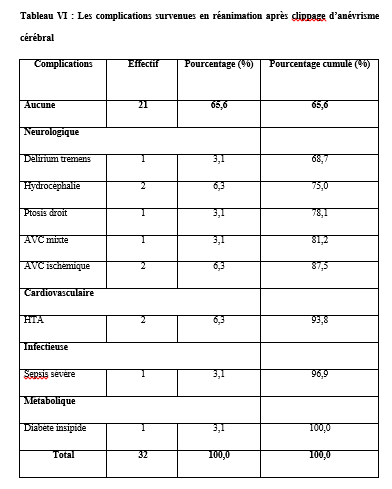 Le GOS était de 3,9±1,7. Le tableau VII montre l’échelle de devenir de Glasgow (GOS). La mortalité était de 25% avec une durée moyenne de séjour de 6,3 jours. 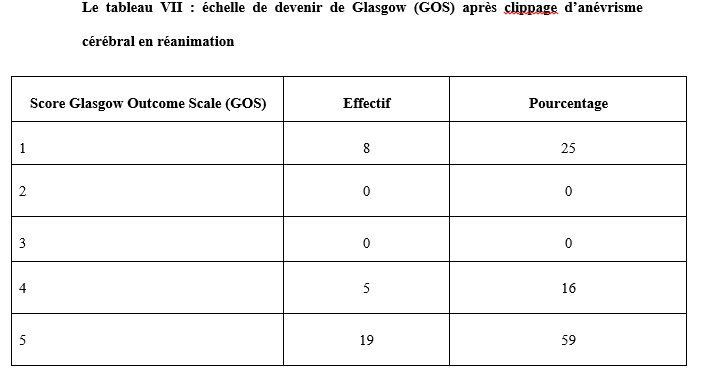 Discussion : A travers cette étude monocentrique de cohorte à recueil historique de 8 ans (Novembre 2012 à Octobre 2020), nous décrivons l’évolution en réanimation des patients opérés pour clippage d’anévrisme cérébral. Nous rapportons notre expérience dans un pays à ressources limitées. Dans la littérature, l’incidence de la rupture de l’anévrisme cérébral variait de 2,5 à 28/100 000 habitants par an. Ce taux était plus élevé en Finlande [6,8]. L’anévrysme touchait la tranche d’âge 30-70 ans avec un pic dans les 50 et 60 ans [6,8,15]. Dans notre étude, l’âge moyen était de 45,2 ± 12,5 ans avec les extrêmes de 15 ans et de 70 ans. Dans la littérature, comme dans notre étude, l’anévrisme cérébral touchait plus les femmes que les hommes [6,8]. Les facteurs de risque clairement identifiés sont l’hypertension artérielle, le tabagisme et la prise d’alcool. L’association hypertension artérielle et tabagisme est synergique [8]. Dans notre étude, l’HTA a été l’antécédent médical le plus fréquent. La présence de pathologies systémiques et graves telles que : l’hypertension, diabète, artériosclérose sévère, maladie chronique pulmonaire, vasospasme était prédictive de mauvais pronostic [6, 8, 15]. Dans notre étude, un facteur de comorbidité associé a été retrouvé dans 71,8 %. Il s’agissait d’une HTA (59,4%), une obésité modérée (3,1%), une bronchopneumopathie chronique obstructive (3,1%), un tabagique chronique (3,1%) et un cas de prise d’alcool (3,1%). L’échelle de WFNS est une échelle clinique et, à valeur pronostic. L’échelle de WFNS est classée de grade I à grade V [12]. Dans notre étude, il n’y avait pas de grade II ou V. Le vasospasme après hémorragie méningée par rupture anévrismale est de survenue typique et fréquente [8]. Les facteurs de risque les plus importants étaient : le grade clinique et l’importance de l’hémorragie méningée sur le scanner [6,15]. Dans notre étude, l’anévrisme était rompu dans 87,5 %. La nimodipine a été administrée. Dans la littérature, le siège le plus fréquent de l’anévrisme cérébral était le polygone de Willis [15] comme ce fut le cas dans notre étude. Dans la littérature, l’incidence des anomalies de l’électrocardiogramme (ECG) variait entre 49 et 100% [1,10]. Dans notre étude, elles étaient de 68,7%.Le score ASA Physical Status est une estimation essentiellement subjective des risques opératoires, indépendante de l’âge du patient et du type de chirurgie. Le score ASA repose sur la recherche de deux éléments : l’absence ou la présence d’une maladie systémique et l’évaluation de son degré de sévérité [7]. Dans notre étude, la classe ASA était II dans 84,4% et, III dans 15,6%. La chirurgie était programmée dans 100 %. L’antibioprophylaxie a été faite par β lactamine dans 100% comme dans la littérature [7]. Dans la littérature, les événements per opératoires étaient : l’hypotension, ischémie cérébrale, la tachycardie, l’hypertension artérielle [14, 5, 9]. La perte sanguine, la durée de la chirurgie et la durée de l’anesthésie variaient selon la morphologie, le siège et l’étendue de l’anévrisme [3, 14, 15]. Dans la littérature, la perte sanguine variait de 250 à 4000 ml [14]. La durée de la chirurgie variait de 180 minutes à 480 minutes [7]. Elle était de 90 minutes à 390 minutes dans notre étude. Dans notre étude la durée de l’anesthésie était de 120 minutes et 460 minutes. Dans la littérature, pour le maintien de la normo volémie et du volume sanguin, les cristalloïdes, colloïdes et produits sanguins sont proposés en per opératoire [7,4]. Dans notre étude, une transfusion per-opératoire a été faite dans 46,8% avec une moyenne de 2 ± 1,3 unités/ transfusion. Le réveil des patients grade I-II, doit être programmé avec une extubation en salle d’intervention. Pour les patients opérés grades IV et V, l’extubation est différée en unité de soins intensifs. [1, 14]. Dans notre étude, tous les patients ont été réveillés en réanimation. Dans notre étude, la sédation a été faite par une association fentanyl-midazolam dans 28,1%. Les auteurs ont montré que chez les cérébrolésés en particulier des traumatisés crâniens, une élévation modérée de la PIC avec diminution de la pression artérielle et de la PPC survient lors de l’injection en six minutes de sufentanil (1 µg/kg), alfentanil (100 µg/kg), fentanyl (10 µg/kg) avec relais en perfusion ; après une augmentation moyenne de 5–9 mm Hg, la PIC retournait à sa valeur préalable en 15 minutes [9,13,2]. La plupart des équipes préconisaient un traitement prophylactique des convulsions. Cependant, la poursuite de ce traitement après les premiers jours post opératoires ne semblait pas justifiée chez les patients qui n’ont pas fait de crise de convulsions [1,9]. Dans notre étude, un traitement prophylactique des convulsions a été fait dans 53,1%. Le GOS est une échelle incontournable pour les rééducateurs prenant en charge des traumatisés crâniens. Il s’agit d’une échelle de devenir global internationalement reconnue dans tous les travaux ayant trait aux traumatisés crâniens et recommandée comme mesure essentielle dans les essais cliniques. Sa création en 1975 répondait à un besoin d’évaluation objective et facile du devenir des cérébrolésés [11]. Dans notre étude, le GOS était de 3,9±1,7.Dans la littérature, les complications neurologiques variaient de 5 à 50% [5,9] etl’hydrocéphalie entre 15 à 25% [7]. Dans notre étude, une complication neurologique a été observée dans 21,9 % et une hydrocéphalie (6,3 %). Dans la littérature, le taux d’infection variait de 10 à 29 % [15]. Dans notre étude, il était de 3,1%. Dans la littérature, la morbidité-mortalité augmente au fur et à mesure qu’on monte en grade WFNS [12]. Dans notre étude, la mortalité était plus élevée dans le grade I WFNS. Au Mali, l’anévrisme cérébral est une situation clinique grave quel que soit le grade. La durée de séjour en réanimation variait de : 1 à 7 jours [7]. Dans notre étude, elle était de :1 à 56 jours. Conclusion : Au Mali, le clippage chirurgical de l’anévrisme cérébral est un progrès technologique. Cependant, il s’adresse à une population féminine, hypertendue avec un haut risque hémorragique. Le risque de survenue de complications au cours de la chirurgie et en réanimation demeure élevé tout comme la mortalité en réanimation. L’amélioration du pronostic passe par : le renforcement des moyens notamment de surveillance et le renforcement de la multidisciplinarité. Références : 1-Berre J, Hans P, Puybasset L, Beydon L, Audibert G, Bruder N, Ravussin P, Boulard G, Minassian A, Dufour H, Kersaint-Gilly A, Gabrillargues J. Hémorragie sous-arachnoïdienne grave et épilepsie. Ann Fr Anesth Reanim.2005 ; (24) : 739–741. 2- Beydon L, Audibert G, Berre J, Boulard G, Gabrillargues J, Bruder N, Hans P, Puybasset L, Ravussin P, Kersaint-Gilly A, Minassian A, Dufour H. Traitement de la douleur des hémorragies méningées graves. Ann Fr Anesth Reanim.2005 ; (24) : 782–786. 3- Beydon L. Hémorragie sous-arachnoïdienne (HSA) grave. Ann Fr Anesth Reanim. 2005 ; (24) : 713–714. 4- Boulard G, Ravussin P, Prousr F, Bonafe A, Audibert G, Kersaint-Gilly A. Filière de la prise en charge de l’hémorragie sous-arachnoïdienne. Ann Fr Anesth Reanim. 2005 ; (24) : 721–722. 5- Bruder N, Ravussin P, Hans P, Berre J, Puybasset L, Audibert G, Boulard G, Beydon L. Anesthésie pour le traitement des hémorragies méningées graves par rupture d’anévrisme. Ann Fr Anesth Reanim. 2005 ; (24) : 775–781. 6- Bruder N, Velly L. Vasospasme cérébral. Elsevier Masson, France 2008 : 177-187 7- Bula-Bula IM, Kamanda R, Mukuna P, Lepira F, Mbuyi M, Babakazo D, Kimpanga P, Kilembe M. Lecture critique de l’ASA status score : analyse d’une enquête menée au cours d’un congrès SARANF. Rev Afr Anesthésiol Med Urg. 2016 ;21(2) :47-50. 8- Diani N, Sidibé A, Cissé MAC, Dramé AI, Dama M, Coulibaly O, Dembélé AS, Tall FK, Samaké B, Diallo O. Evolution de l’anévrisme cérébral en milieu de réanimation à propos de 10 cas à l’hôpital du Mali. Médecine d’Afrique Noire 2018 ; 65 (3) :165-168. 9- Dufour H, Bonafe A, Bruder N, Boulard G, Ravussin P, Lejeune J P, Gabrillargues J. Diagnostic en hôpital général et prise en charge immédiate des hémorragies méningées graves. Ann Fr Anesth Reanim. 2005 ; (24) :715–720. 10- Hans P, Audibert G, Berre J, Bruder N, Ravussin P, Ter Minassian A, Puybasset L, Beydon L. Répercussions cardiovasculaires et pulmonaires des hémorragies méningées graves. Ann Fr Anesth Reanim.2005 ; (24) : 734–738. 11- Fayol P, Carrière H, Habonmana D, Preux PM, Dumond JJ. Version française de l’entretien structuré pour l’échelle de devenir de Glasgow (GOS) : recommandations et premières études de validation. Annales de réadaptation et de médecine physique 2004 ; 47 : 142–156. 12-Harsimrat BSS, Amey R.S, Sandeep M, Rajesh C, Vivek G, Sunil KG. The clinical profile, management, and overall outcome of aneurysmal subarachnoid hemorrhage at the neurosurgical unit of a tertiary care center in India. J Neurosci Rural Pract.2014 ; 5 (2) : 118–126. 13-Leblanc P E, Engrand N. Hémorragie méningée post-anévrysmale : rôle de l’anesthésiste-réanimateur. In MAPAR 2000: 477- 493. 14- Steinberg GK, Dodd RL. Anesthesia of cerebral aneuvrysm. In Manual of Surgical Procedures, 4th ed. Lippincott, Williams &Wilkins 2009, p .4-11 15- Uhrig L, Losser MR. Prise en charge des hémorragies méningées par rupture d’anévrisme. Elsevier Masson. France 2007 : 403-414. 16- Viars P, Spielvogel C, Cathelin M, Bromberg N, Adnet PJ. Anesthésie-Réanimation pour cure chirurgicale d’un anévrysme intra crânien. Imprimerie nationale. France1994 ; 1 : 239-6. |
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647