
|
|
|
TECHNIQUES
EXERESE D’UN GLIOME DE BAS GRADE EN CHIRURGIE EVEILLEE : NOTRE 1ère EXPERIENCE
REMOVAL OF A LOW-GRADE GLIOMA IN AWAKE SURGERY : OUR FIRST EXPERIENCE
E-Mail Contact - DROGBA Kporou Landry :
landrydrogba@gmail.com
RESUME Introduction La cartographie peropératoire a permis de prendre en charge les gliomes diffus de bas grades souvent situés en zone fonctionnelle, autrefois taxés d’inopérables. Cette technique couramment pratiquée dans les pays du nord, ne l’était pas en Afrique noire francophone. Nous rapportons notre 1ère expérience d’exérèse d’un gliome de bas grade en chirurgie éveillée. Observation Il s’agit d’un patient de 34 ans, qui a consulté pour des crises convulsives partielles. L’examen clinique retrouvait un syndrome pyramidal avec hémiparésie droite à 4/5. L’IRM cérébrale mettait en évidence une lésion située en région précentrale gauche d’allure tumorale prenant le contraste de façon hétérogène. Une biopsie sous neuronavigation a été réalisée et l’examen anatomopathologique a conclu à un astrocytome gémistocytique de grade 2. Après discussion pluridisciplinaire, l’exérèse la plus complète possible a été proposée et réalisée en chirurgie éveillée selon le protocole anesthésique AAA (Asleep-Awake-Asleep). Les suites opératoires ont été simples sans aggravation neurologique. L’IRM cérébrale à J1 post opératoire évaluait l’exérèse à plus de 80%. Le suivi à 6 mois post opératoire n’a pas révélé de nouvelles crises convulsives. Conclusion La chirurgie des gliomes diffus de bas grade ne doit plus être conditionnée par le choix exclusif de la fonction ou la survie ; mais doit désormais être plus ambitieuse et tenter d’avoir une influence positive sur les deux. La cartographie per opératoire en chirurgie éveillée répond à cet objectif. Cette pratique est désormais possible à Abidjan. Mots clés : cartographie per opératoire, chirurgie éveillée, gliome de bas grade. ABSTRACT Introduction Intraoperative brain mapping techniques allows managing diffuse low-grade gliomas often located in a functional area, which were once considered inoperable. This technique commonly practiced in developed countries, was not practiced in French speaking sub-Saharan Africa. We report our first experience of removing of a low-grade glioma in awake surgery. Case presentation A 34-year-old patient presented with partial seizures. Neurological examination revealed the presence of a pyramidal syndrome with right-side hemiparesis at 4/5. The MRI showed a left precentral tumor-like lesion with a heterogeneous contrast enhancement. A biopsy under neuronavigation was performed. Anatomopathological examination confirmed a grade II gemistocytic astrocytoma. After a multidisciplinary meeting, a decision of near complete resection was taken. The resection of the tumor was performed in awake surgery according to the AAA (Asleep-Awake-Asleep) anesthetic protocol. During the first postoperative day, the MRI showed subtotal resection (STR) of more than 80%. The patient was discharged without any neurological deficit. The 6-month follow-up did not reveal any incidence of seizures. Conclusion Diffuse low-grade gliomas surgeries should no longer be limited by the choice between function preservation and patient survival, but rather should now be more ambitious and try to have a positive influence on both. Intraoperative brain mapping during awake surgery provides this objective which is now possible in Abidjan. Keywords: awake surgery, diffuse low-grade gliomas, intraoperative brain mapping. INTRODUCTION Les gliomes cérébraux de bas grades sont des tumeurs intermédiaires infiltrantes révélées généralement par des crises d’épilepsie chez des patients jeunes (médiane de 30 – 40 ans) (6). La chirurgie de ces tumeurs souvent situées en zones éloquentes chez des patients paucisymptomatiques a longtemps constitué un dilemme chirurgical (5,8,13). Toutefois, l’histoire naturelle de ces gliomes a démontré qu’ils étaient évolutifs dans 100% des cas avec une croissance systématique et une transformation maligne inéluctable. La chirurgie d’exérèse représente actuellement la première option thérapeutique ayant un impact significatif sur les médianes de survie en retardant leur passage à l’anaplasie (6,17). L’exérèse se doit d’être la plus maximaliste possible. La chirurgie éveillée représente une excellente alternative, permettant d’optimiser l’étendue de la résection tout en préservant les structures fonctionnelles. Cette chirurgie de plus en plus pratiquée dans les pays du nord, ne l’était pas en Afrique noire francophone. Nous ne disposons pas d’IRM fonctionnelle dans notre environnement de travail. Nous rapportons notre première expérience d’exérèse chirurgicale d’un gliome de bas grade en condition éveillée à Abidjan. OBSERVATION Il s’agit d’un patient de 34 ans, sans antécédents significatifs, gaucher homogène qui a consulté pour des crises convulsives partielles et une impotence fonctionnelle de l’hémicorps droit d’installation progressive. L’examen clinique retrouvait un syndrome pyramidal avec une hémiparésie droite à 4/5, des réflexes ostéotendineux vifs et un signe de Babinski à droite. La lésion initialement prise pour une encéphalite au scanner, a été traitée comme telle sans succès. L’IRM cérébrale mettait en évidence une lésion située en région précentrale gauche d’allure tumorale prenant le contraste de façon hétérogène (figure 1). Un traitement par levetiracetam 500mg matin et soir a été institué. Une biopsie sous neuronavigation a été réalisée et l’examen anatomopathologique a conclu à un astrocytome gémistocytique de grade 2. L’IRM multimodale avec tractographie a objectivé une désorganisation des fibres de substance blanche au niveau du foyer lésionnel avec une rupture des fibres (figure 2). Après discussion pluridisciplinaire, l’exérèse la plus complète possible a été proposée et réalisée en chirurgie éveillée selon le protocole anesthésique AAA (Asleep-Awake-Asleep). La première partie « asleep » correspondant à la craniotomie a été réalisée sous anesthésie générale, après un bloc du scalp aidé de la neuronavigation. Un masque laryngé protégeait les voies aériennes. Les produits anesthésiques utilisés étaient le propofol et le fentanyl. Pendant cette phase, la dure mère a été ouverte après tamponnement à la bupivacaïne. La deuxième phase « awake » correspondant à la phase de travail a été réalisée patient vigile. La stimulation électrique cortico sous corticale prévue à l’aide du système NIM-Eclipse de Medtronic n’a pas fonctionné faute de ressource compétente. En l’absence d’orthophoniste ou de neuropsychologue, les taches de motricité controlatérale étaient demandées par le médecin anesthésiste et réalisées pendant cette phase. Il s’agissait de mouvements répétés de flexion extension du coude droit et des doigts de la main droite. Entre les 2 phases, le réveil a été plus long. Une crise épileptique est survenue pendant la phase de travail, calmée par le sérum physiologique froid. L’exérèse s’est arrêtée quand a débuté une difficulté à réaliser les mouvements de flexion extension. La phase de fermeture « asleep » a été réalisée patient endormi. Les suites opératoires ont été simples sans aggravation neurologique. L’IRM cérébrale à J1 post opératoire retrouvait une prise de contraste résiduelle concordant avec une exérèse à plus de 80% (figure 3). Le suivi à 6 mois post opératoire n’a pas révélé de nouvelle crise convulsive. L’IRM montrait une stabilité de la prise de contraste résiduelle (figure 4). DISCUSSION La stimulation corticale sous anesthésie locale remonte à plus d’un siècle, mais ce sont les travaux de l’équipe de Penfield qui ont fait de cette technique une référence dans la cartographie peropératoire en neurochirurgie (18). Le principe est basé sur une inactivation des zones corticales et sous corticales essentielles pour la fonction, à l’origine d’une perturbation pendant quelques secondes des taches effectuées en continu par le patient sur la table opératoire lorsque ces zones sont stimulées par un train d’ondes électriques mimant une « véritable lésion transitoire » (6,7). Il est alors possible d’affirmer que, en cas de résection de ces zones détectées comme cruciale par la cartographie électrique, un déficit permanent sera généré. Le but est par conséquent de préserver ces aires et d’effectuer la résection selon les limites fonctionnelles (4,5,15). Les principales indications de la chirurgie en condition éveillée sont la résection des foyers épileptiques dans les épilepsies pharmaco-résistantes, la stimulation profonde dans la maladie de Parkinson et la résection de lésions localisées en zone fonctionnelle. Ces lésions concernent principalement des tumeurs cérébrales primitives (majoritairement représentées par les gliomes), mais également des métastases cérébrales, des cavernomes, plus rarement des malformations artérioveineuses ou des anévrismes intracrâniens (1). Dans notre cas il s’agissait d’une lésion tumorale située en région centrale gauche, aire somato motrice par excellence. Le challenge était donc de minimiser le risque de paralysie motrice permanente controlatérale après l’exérèse, garant d’une meilleure qualité de vie du patient. Le stimulateur utilisé était monopolaire ayant probablement une diffusion moins sélective. Sur le plan anesthésique, plusieurs protocoles ont été discutés allant de la sédation simple à l’anesthésie générale (1,6). La procédure endormie-éveillée-endormie avec masque laryngé que nous avons utilisée est la plus couramment rapportée pour la chirurgie oncologique (3,6,12,16). Le propofol et le remifentanil sont les agents anesthésiques de choix. Ils ont l’avantage d’être rapidement éliminés ce qui permet un réveil précoce à l’arrêt de l’administration (1,4,16). Le rémifentanil étant indisponible dans notre contexte, nous avons utilisé le fentanyl, ce qui pourrait expliquer un temps de réveil plus long. Le recueil des réponses cliniques concernant les fonctions cognitives et somato sensorielles nécessite la présence d’un orthophoniste (4). Pour les fonctions somato motrices, le recueil ne pose pas de problème puisqu’il s’agit de mouvement régulier réalisé lors des stimulations. L’IRM à J1 post opératoire évaluait l’exérèse à plus de 80%. L’évaluation clinique n’a pas retrouvé d’aggravation neurologique. Nous avons ainsi pu préserver la qualité de vie du patient. Ce résultat concorde parfaitement avec ceux obtenus dans la plupart des séries (2,9-11,14). CONCLUSION La chirurgie des gliomes diffus de bas grade ne doit plus être conditionnée par le choix exclusif de la fonction ou la survie, mais doit désormais être plus ambitieuse et tenter d’avoir une influence positive sur les deux. La cartographie per opératoire en chirurgie éveillée répond à cet objectif. Elle nécessite une coopération entre neurochirurgien, anesthésiste et orthophoniste. Cette pratique est désormais possible en Côte d’Ivoire.
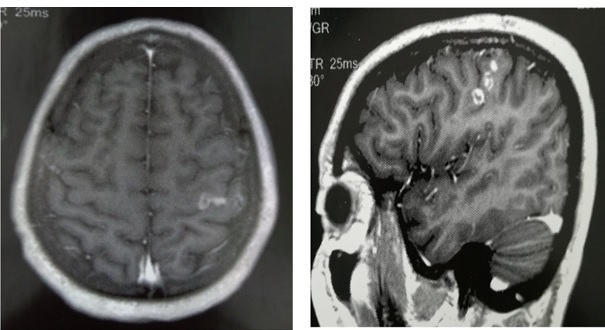 Figure 1 : IRM cérébrale en séquence pondérée T1 après injection de Gadolinium, coupe axiale (A), coupe sagittale (B) ; montrant une lésion d’allure tumorale située en région précentrale gauche prenant le contraste de façon hétérogène.
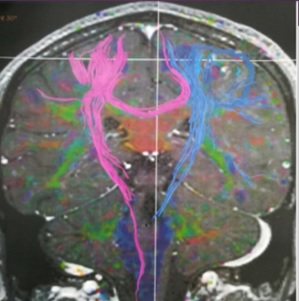 Figure 2 : IRM cérébrale multimodale, tractographie montrant une désorganisation des fibres de substance blanche au niveau du foyer lésionnel avec une rupture des fibres.
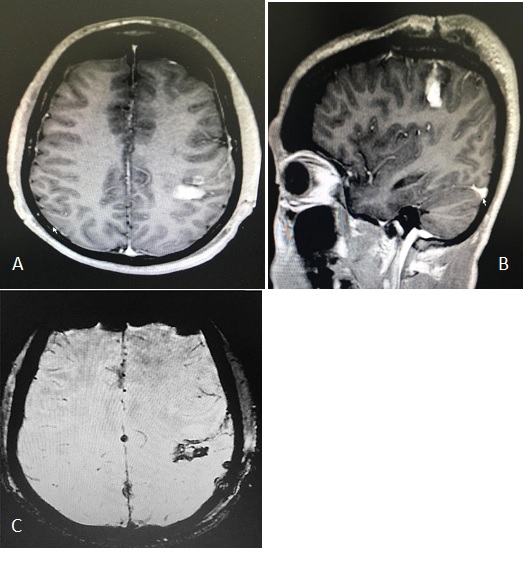 Figure 3 : IRM cérébrale à J1 post opératoire en séquence pondérée T1 après injection de Gadolinium en coupe axiale (A), coupe sagittale (B) et coupe axiale en pondération T2* (C) ; montrant un hématome du foyer opératoire avec une prise de contraste résiduelle <20%.
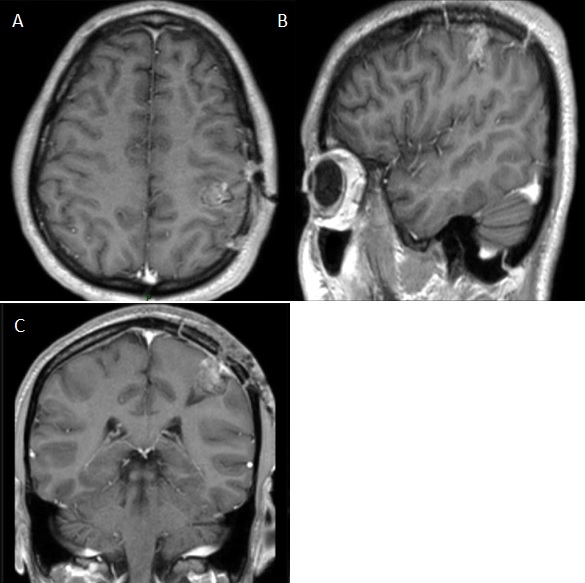 Figure 4 : IRM cérébrale à 6 mois post opératoire en séquence pondérée T1 après injection de Gadolinium, coupe axiale (A), coupe sagittale (B) et coupe coronale (C) montrant une stabilité de la prise de contraste. REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647