
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ORIGINAL PAPERS / ARTICLES ORIGINAUX
INDICE GLOBAL DES SIGNES NEUROLOGIQUES DU KONZO: MARQUEUR CLINIQUE DE MULTIPLES FACTEURS DE SUSCEPTIBILITE ET DE GRAVITE DES TROUBLES NEUROCOGNITIFS CHEZ L’ENFANT EN MILIEU KONZO
KONZO GLOBAL NEUROLOGICAL INDEX: A CLINICAL MARKER OF SUSCEPTIBILITY AND SEVERITY OF NEUROCOGNITIVE DEFICITS IN CHILDREN LIVING IN KONZO-AFFECTED AREAS.
E-Mail Contact - OKITUNDU LUWA E-ANDJOFONO Daniel :
danielokitundu@hotmail.com
RESUME Objectif : Quantifier la détérioration neurologique observée dans le konzo eu égard aux multiples déficiences incriminées dans sa pathogénie. Méthodes : Une étude transversale a été entreprise auprès de 123 enfants konzo et 87 non-konzo (4-17 ans) en 2011 à Kahemba, Congo-Kinshasa. L’indice global de signes neurologiques du konzo (IGSNK) était étudié en relation avec le niveau socio-économique familial évalué par le HOME, les performances cognitives au KABC-II et motrices au BOT-2, les taux sériques des isoprostanes, oligoéléments, et l’albuminémie et triglyceridémie mesurés respectivement par LC-MS/MS, ICP-MS, et automate Piccolo. Les tests de χ2, de Mann-Whitney et Kruskal-Wallis, ou la corrélation r de Spearman ont été appliqués au seuil de signification de 0,05. Résultats : L’augmentation de l’indice global des signes neurologiques du konzo était associée à la sévérité de la maladie (p < 0,001), le niveau socioéconomique familial (r = – 0,25 ; p < 0,001, la triglyceridémie (r = 0,55 , p = 0,001) et les 8,12-IsoProstaneF2-VI sériques (r = 0,33 , p= 0,06),), l’albuminémie (r = – 0,44 , p = 0,010 ) , la cuprémie ( r = – 0,36 , p= 0,048), le sélenium sérique (r = – 0,57, p = 0,001) ; en plus de l’habilité motrice globale (r = -0,861 ; p < 0,001) et l’indice global de fonctionnement cognitif (r = – 0,44 ; p = 0,002). Conclusion : L’indice global des signes neurologiques du konzo paraît être un bon marqueur clinique de multiples déficiences (pauvreté socio-familiale, malnutrition, stress oxydatif) incriminées dans la sévérité du konzo. Mots-clés : malnutrition, niveau socio-économique familial, stress oxydatif, konzo, intoxication cyanhydrique, troubles moteurs et cognitifs. ABSTRACT Objective: To quantify the extent of neurological deficits in konzo in a context of multiple factors incriminated in its pathogenesis. Methods: A cross-sectional study was carried out to assess 123 children with and 87 presumably healthy controls (4-17 years) in 2011 in kahemba, congo-kinshasa. A konzo global neurological index (KGNI) was constructed and assessed in relation to socio-economic status (assessed using the home questionnaire), cognitive and motor performances at the KABC-II and BOT-2, respectively; serum isoprostanes (measured by LC/MS-MS), trace elements (by ICP-MS), albumin and triglycerides (by automated Piccolo). The chi-square, Mann-Whitney and Kruskal-Wallis tests as well as the Spearman r coefficients were used at the 0.05 level of statistical significance. Results: A higher KGNI was significantly associated with the severity of konzo (p < 0.001), poor socio-economic status (r = – 0.25, p < 0.001), elevated serum triglycerides (r = 0.55, p = 0.001), 8,12-isoprostane F2-VI (r = 0.33, p = 0.06), hypoalbuminemia (r = – 0.44, p = 0.010), low serum concentrations copper (r = – 0.36, p = 0.048) or selenium (r = – 0.57, p = 0.001);in addition to poor scores at the BOT-2 testing (r = -0.86; p < 0.001) and KABC-II testing for cognition (r = – 0.44; p = 0.002). Conclusion: The konzo global neurological index appears to be a good clinical marker of disease susceptibility factors (poor socio-economic status, malnutrition, oxidative stress) incriminated in the severity of konzo. Key-words: malnutrition, socio-economic status, oxidative stress, cyanide intoxication, neurocognition INTRODUCTION Le konzo est définie par l’OMS comme ‘’une paraparésie manifeste spastique symétrique d’installation brutale en une semaine, non progressive, chez une personne en bonne santé, avec des réflexes ostéo-tendineux exagérés aux niveaux rotulien et achilléen, sans signes d’une autre affection de la moelle’’ [1]. C’est une maladie associée à l’intoxication cyanhydrique chronique d’origine diététique affectant les populations pauvres d’Afrique Sub-saharienne vivant en milieu rural et dépendant d’un régime alimentaire monotone à base des produits du manioc amer mal détoxifié [2-4]. Les sujets vulnérables sont des personnes peu instruites ignorant la toxicité du manioc amer et des femmes en âge de procréer ainsi que des enfants âgés de plus de deux ans [2-6]. La prévalence moyenne du konzo est de 1% de la population exposée [1], mais elle peut atteindre 4 à 7% dans certaines contrées notamment en République Démocratique du Congo [7]. Cette maladie a été consacrée par l’OMS comme une maladie neurologique toxico-nutritionnelle avec déficit de la motricité globale sans déficience intellectuelle [1]. Cependant, dans les premières descriptions de la maladie [8] et dans les études ultérieures de terrain[9-13], les caractéristiques cliniques du konzo notamment les signes d’encéphalopathie aiguë au début de la maladie, la survenue d’emblée de la spasticité, l’absence fréquente du signe de Babinski associée à l’hyperréflexie ostéo-tendineuse permanente, la positivité du réflexe cheiro-mentonnier, les troubles de la motricité fine aux membres supérieurs non paralysés ainsi que les perturbations électro-encéphalographiques et de la stimulation transcorticale suggéraient l’existence des troubles neurologiques autres que le syndrome pyramidal. Des études récentes ont démontré l’existence des troubles psychomoteurs et de la sphère cognitive [14] ainsi que les liens entre les troubles moteurs et cognitifs, la pauvreté, la malnutrition, la déficience en oligoéléments et le stress oxydatif [15-17]. Les données de ces études mettent en évidence un problème de santé avec handicap neurologique multiple pouvant s’aggraver avec le temps pour des personnes qui continuent à être exposées aux mêmes conditions de vie délétères et à l’intoxication cyanhydrique chronique. Mis à part les faits de la seconde attaque aggravante dans environ 10 % des cas [2,9], l’amélioration fonctionnelle partielle au début de la maladie [2], la rémission partielle de troubles moteurs [5, 9, 18], l’aggravation des troubles cognitifs avec l’âge [14,17], les aspects évolutifs cliniques du konzo ainsi que la détérioration neurologique possible y associée sont encore scientifiquement peu documentés. La présente étude avait pour objectif d’évaluer la détérioration neurologique dans le konzo par ‘’un indice global des signes neurologiques du konzo’’ considéré comme un marqueur clinique de l’évolution et de la sévérité de la maladie ainsi que de multiples déficiences socio-économiques, nutritionnelles, métaboliques, motrices et cognitives y associées. SUJETS ET METHODES Sujets Cette étude avait enrôlé 210 enfants dont 123 affectés par le konzo et 87 sujets non-konzo ou contrôles ou présumés sains dans la Cité de Kahemba en 2011. La Cité de KAHEMBA est le Chef-lieu du territoire de Kahemba. Ce dernier est localisé au sud-ouest de la République Démocratique du Congo dans de la province de Kwango et limité au sud par la République d’Angola (Figure 1). La Cité de Kahemba a été choisie pour cette étude en tant que contrée la plus affectée par le konzo dans le monde, avec une prévalence de 5% pour une population de 50.000 habitants (Zone de Santé de Kahemba. Statistiques Sanitaires 2011. Province de Bandundu, République Démocratique du Congo). Cette étude avait reçu l’approbation de Comités d’éthique du Ministère de la santé de la République Démocratique du Congo et de « Oregon Health and Sciences University « , Portland, Oregon, Etats Unis d’Amérique. Les enfants avaient été recrutés moyennant le consentement des chefs de leurs ménages. Les cas konzo avaient rempli les critères de définition du konzo selon l’OMS [1]. Trois degrés de sévérité de la maladie étaient définis de la manière suivante: (i) forme légère pour le malade capable de marcher sans support (stade 1); (ii) forme modérée pour le malade utilisant un ou deux bâtons pour se déplacer (Stade 2), (iii) forme sévère pour le malade incapable de marcher (Stade 3). Le critère d’inclusion pour le sujet présumé sain était défini par le fait de ne pas avoir le konzo, d’être de même sexe, de même tranche d’âge, et avoir vécu dans le même quartier que le cas à l’avènement du konzo pour le cas. Les enfants avec antécédents médicaux d’une maladie possible affectant gravement le système nerveux central (par exemple le neuropaludisme, l’infirmité motrice cérébrale) ont été exclus. Tous les enfants avaient été testés négatifs pour le VIH1 et le HTLV1. Ils étaient tous exposés à l’intoxication cyanhydrique d’origine diététique. Cette exposition au cyanure avait été prouvée par la mesure, au moyen de la méthode semi-quantitative de Howard [19], de la quantité de cyanure dans les farines apprêtées pour la cuisson dans les ménages et des taux de thiocyanate urinaire des enfants recrutés. Il a été démontré le risque d’intoxication au cyanure sur base des critères de la FAO/ OMS [20 ] par des taux de 92,22 ± 56,21 mg (50 à 200mg) de cyanure par kilogramme de poids sec dans la farine (norme : valeurs inférieures à 10 mg/kg) et/où des taux moyens (± déviation standard) de thiocyanate urinaire de 518,59 (± 354,19) micromoles par litre pour les cas et 381,04 (± 221,88) pour les présumés sains (norme pour l’absence de risque de faire le konzo : valeurs inférieures ou égales à 100 micromoles par litre) [18]. MÉTHODES Type d’étude Il s’agit d’une étude transversale ayant porté sur l’évaluation quantitative de la détérioration neurologique dans le konzo par un indice global de signes neurologiques du konzo (IGSNK) en relation avec la sévérité et l’évolution de la maladie, le niveau socio-économique des ménages, l’état nutritionnel, les performances neuromotrices et cognitives et les biomarqueurs nutritionnels et du stress oxydatif chez des enfants avec et sans konzo. Procédure de collecte des données cliniques Pour chaque enfant, avec ou sans konzo, l’anamnèse neurologique et neuropsychologique a été réalisée, le poids et la taille ont été mesurés au moment de l’examen neurologique. Les modalités de survenue et la durée de la paralysie ont été déterminées. La paraparésie et la quadriparésie spastiques ont été les 2 formes topographiques de la paralysie cliniquement caractérisées. Pour l’évaluation de l’indice de l’environnement socio-économique familial, l’ »Home Observation for the Measurement of the Environment »(HOME), la version adaptée à l’âge scolaire a été utilisée [21, 22]. La somme des cotes des 10 domaines constituaient la cote totale (Home Total) considéré comme l’indice de l’environnement socio-économique familial. Le bilan neuropsychologique a été réalisé par le Bruininks Oseretsky Motor Test of proficiency second édition (BOT-2) et le Kaufman Assessment Battery of Children second édition (K-ABC II) respectivement pour l’évaluation des habiletés neuromotrices et des principaux domaines de compétences neurocognitives [23,24]. Pour le BOT-2, les scores composites ont été calculés pour le contrôle de la motricité fine, la coordination manuelle et corporelle, l’agilité et la vitesse ainsi qu’un score composite total (TMC). Par le K-ABC-II, la planification, l’apprentissage, l’analyse visuo-spatiale (traitement simultané) et la mémoire de travail (traitement séquentiel) étaient des capacités évaluées pour obtenir le score de l’indice global de fonctionnement cognitif ou indice des processus mentaux (IPM), les capacités d’apprentissage différé ont été aussi évaluées. Procédure d’élaboration de l’indice global des signes neurologiques du konzo (IGSNK) Pour quantifier la détérioration neurologique dans le konzo, l’IGSNK été élaboré pour les enfants atteints de konzo et présumés sains sur la base de 13 signes neurologiques indiqués dans le tableau 1 ici-bas. Les 13 signes ont été retenus sur base des données de la littérature sur la clinique du konzo [2, 3, 5, 9, 25]. Un score total reflétant la gravité de l’atteinte neurologique a été calculé par la sommation de scores attribués aux différents signes neurologiques dans le tableau 1. Etude biochimique A cause de la limitation des ressources, l’étude biochimique avait porté sur un sous-échantillon de 40 sujets dont 21 atteints de konzo et 19 présumés sains. Sur les 21 enfants atteints de konzo, 17 étaient au stade sévère de la maladie (stade 3) et 4 (2 paires de jumeaux) atteints de la forme légère de konzo (stade 1). Les taux sériques des Isoprostanes libres on été déterminés par la chromatogrphie en phase liquide couplée à la spectométrie de masse en tandem (LC-MS/MS). Le dosage sérique de 3 oligoéléments, le sélénium, le cuivre, le zinc, avait été réalisé par la Spectrométrie de Masse par Plasma à Couplage Inductif (ICP-MS). L’albuminémie, l’urémie, la créatininémie, la triglycéridémie et les taux sériques des lipides totaux ont été déterminés par le Système automatique de dosage Piccolo [Abaxis Piccolo, Germany]. Analyse des données Pour apprécier l’état nutritionnel des enfants, les indices Poids/Age et Poids/Taille ont été calculés selon les standards de l’OMS [26]. Le logiciel SPSS version 20,0 a été utilisé pour les analyses statistiques et les productions graphiques. Après une analyse descriptive avec calcul des effectifs et des tendances centrales, les tests de c2 et exact de Fisher, les corrélations de Pearson et de Spearman, l’analyse des variances, les tests non paramétriques de Mann-Whitney, de Kruskal-Wallis et de la médiane ont été appliqués selon les besoins. RESULTATS Caractéristiques sociodémographiques et cliniques générales de la population d’étude L’âge des enfants enrôlés variait entre 5 et 17 ans, sans différence entre les enfants atteints de konzo et présumés sains comme le montre le tableau 2. Les garçons prédominaient tant chez les enfants atteints de konzo que chez les non-konzo, le sex-ratio garçon: fille était de 1,12:1 pour les enfants atteints de konzo et de 1,5:1 pour les enfants non-konzo, sans différence statistiquement significative (p<0,05, Test de Chi-carré) (Tableau 2). Les enfants atteints de konzo étaient moins scolarisés que les non-konzo, 72 sur 123 étaient scolarisés (58,5%) et 51 non scolarisés (41,5%) contre 78 enfants contrôles sur 87 (89,6%) et 9 non scolarisés (10,4%) (p<0,001, Test de Chi-carré). Il n’y avait pas aussi de différence entre les 2 groupes concernant le statut matrimonial de parents et le caractère désirable des naissances. La taille de la fratrie variait de 1 à 13 avec une moyenne (± écart-type) de 6,14 (± 2,4), sans différence entre les deux groupes d’enfants recrutés (Tableau 2). Comme le présente le tableau 2, il y avait des différences significatives en défaveur des enfants atteints de konzo concernant l’indice de l’environnement socio-économique familial (Home Total), les indices de malnutrition chronique (Indice Taille/Age-WHO-Z score), de statut pondéral actuel et réserve énergétique (Indice Poids/Age-WHO-Z score), les capacités motrices globales (TMC), l’indice global de fonctionnement cognitif ou des processus mentaux(IPM) et l’indice global des signes neurologiques du konzo (IGSNK). CARACTERISTIQUES CLINIQUES EVOLUTIVES DE LA MALADIE Le début de la maladie été rapporté brutal dans 95,9 % (117/122) et progressif 4,1 % (5 /122) et dans un cas mal précisé. La répartition en stades de sévérité de l’OMS était de 74,8 % (92/123) pour le stade 1 ; 10,6 % (13/123) pour le stade 2 ; 14,6 % (18/123) pour le stade 3. Quant à la forme topograhique clinique de la paralysie, 65 % des cas (80 /123) étaient paraparésiques spastiques et 35 % (43/123) quadriparésiques spastiques. La durée de la maladie variait de 1 mois à 101 mois, avec une moyenne (± écart-type) de 27 (± 21) mois, une médiane de 17 et un mode de 16. La sévérité de la maladie en termes de stades de l’OMS n’était pas associée à la durée de la maladie, mais l’âge des enfants plus élevé était associé à la gravité de la maladie selon l’OMS (D= 3,986 ; ddl = 2 ; p=0,021 ; analyse de variance univariée, modèle linéaire général), l’âge plus jeune étant la caractéristique associée aux enfants au stade 1 par rapport au stade 3 (ß= -1,55 ; IC 95% : -2,85 à -2,56 ; p=0,019) mais avec une discrète différence significative entre les stades 1 et 3 (p=0,058, Test de Bonferroni) et non entre 1 et 2 et 2 et 3 (Figure2). L’évolution de la maladie a été rapportée favorable dans 27,6% des cas (34/123), avec amélioration fonctionnelle notable et passage du stade 3 au stade 1 dans 17,1% (21/123), du stade 3 au stade 2 dans 7,3% (9/123), et du stade 2 au stade 1 dans 3,2% (4/123). Les cas d’aggravation étaient signalés dans 9,7% des cas (12/123) avec 8 cas ayant évolué du stade 1 au stade 3 ; 2 cas du stade 1 au stade 2 et 2 cas du stade 2 au stade 3. Les corrélations (corrélation de Spearman) négatives ont été observées entre la durée de la maladie et les habilités cognitives pour les capacités d’apprentissage immédiat (r= – 0,166, p= 0,034) et différé (r= -0,258, p= 0,003) et l’indice global de fonctionnement cognitif ou de processus mentaux IPM (r= – 0,199, p= 0,016). La corrélation entre la durée de la maladie et l’habilité motrice globale TMC n’était pas significative (r= -0,053, p= 0,57). Variation de l’GSNK en relation avec les caractéristiques cliniques Dans l’ensemble, l’IGSNK variait entre 0 et 26 points, avec une moyenne de 7,5 ; un écart-type de 5,82, une médiane de 7 et un mode de 2, le 5ème percentile à 0 et le 95ème percentile à 18,5. Pour les enfants atteints de konzo, le minimum était à 4, le maximum à 26, la moyenne à 11,4 et l’écart-type de 4,4, la médiane 11, le mode 10 , le 5ème percentile à 5, le 25ème à 8 et le 95ème à 21. Alors que pour les enfants présumés sains, le minimum était à 0 et le maximum à 8, la moyenne était à 2,1, l’écart-type de 1,7 et le mode et la médiane à 2, le 5ème percentile à 0 et le 95ème percentile à 5,6. Il n’y avait pas de différence de l’IGSNK entre les garçons et les filles, parmi les enfants konzo (p=0,867, test de Mann-Withney) ou présumés sains (p=0,399). L’IGSNK était en corrélation positive (Pearson) avec l’âge des enfants avec parmi les enfants atteints de konzo (r = 0,35, p<0,001) contre une l’absence de corrélation chez les enfants présumés sains (r = – 0,13, p=0,24) et dans l’ensemble (r=0,08, p=0,28). Il n’y avait pas aussi de corrélation entre l’IGSNK et la durée de la maladie (r = 0,07 ; p = 0,49) (Tableau 3). L’IGSNK avait des scores plus élevés suivant les stades de sévérité de la maladie selon l’OMS (p<0,001, Tests de Kruskal-Wallis et de la médiane) (Tableau 3). Les différences étaient significatives entre les stades 1 et 2 (p<0,001), les stades 1 et 3 (p<0,001) et non entre Stades 2 et 3. Avec des scores de l’IGSNK supérieurs à 7 (Test positif), les enfants étaient atteints de konzo dans 99,01 % des cas (100/101) et pour des scores égaux ou inférieurs à 7 (Test négatif), 21,1% des cas (23/109) en étaient affectés. Il s’était dégagé une sensibilité de 81% (100/123) et une spécificité de 98,85 % (86 /87). La valeur prédictive positive était ainsi de 99,01 % (100/101) et la valeur prédictive négative de 81,13% (86/109). Avec un score de l’IGSNK supérieur à 7, le risque d’être konzo était augmenté d’au moins 49 fois (OR = 373, 9 ; IC 95% : 49,47-2836 ; p<0,001 ; Test exact de Fisher). L’IGSNK avait montré la capacité à séparer les états neurologiques non konzo (chez les présumés sains, sans paralysie) du konzo (paraparésie et quadriparésie spastiques) [Figure 3) à la côte d’environ 5, correspondant au 5ème percentile de l’IGSNK dans les cas konzo et au 95ème percentile chez les non-konzo, et en dessous du 50ème percentile (Score 7) dans l’ensemble des enfants. En plus, tous les enfants aux stades 2 (13/13) et 3 (18 /18) avaient des scores supérieurs à 7. Relation entre l’IGSNK et les indices socio-économique et nutritionnels Dans l’ensemble des enfants atteints de konzo et contrôles, l’IGSNK montrait une corrélation(Spearman) négative avec l’indice de l’environnement socio-économique familial, Home total (r= – 0,25; p<0,001), avec l’état nutritionnel évalué selon l’indice Taille /Age Z-Score WHO (r= – 0,38; p< 0,001) et l’indice Poids pour l’Age Z-score-WHO (r= – 0,34; p<0,001). Entre ce dernier paramètre de malnutrition d’insuffisance pondérale et réserve énergétique et l’IGSNK, la corrélation négative n’était pas significative parmi les enfants atteints de konzo (r= – 0, 16; p = 0,141) alors qu’elle l’était discrètement parmi les présumés sains (r= -0,26, p = 0,053) (Tableau 3). Par contre, la corrélation négative entre l’IGSNK et l’indice de malnutrition chronique Taille/Age Z-Score WHO se retrouvait tant chez les enfants atteints de konzo (r= – 0,26; p=0,003) que chez les présumés sains (r= – 0,26 ; p = 0,016). La corrélation négative avec l’indice socio-économique notée dans l’ensemble n’était maintenue que parmi les enfants atteints de konzo (r= – 0,27; p=0,002) versus (r= – 0,09; p=0,412) parmi les contrôles (Tableau 3). Relation entre l’IGSNK, les biomarqueurs physiopathogéniques du konzo et les habilités neuromotrices et cognitives Les résultats ci-après concernent le sous-échantillon de 40 enfants. Il n’y avait pas de liens significatifs entre l’IGSNK et les taux sérique et urinaire de thiocyanate ainsi qu’avec le taux sérique de zinc (Tableau 4). Dans l’ensemble des cas konzo et présumés sains, l’IGSNK était en corrélation (Spearman) positive avec les taux sériques des 8, 12-Isoprostane F2-VI (r = 0, 33, p= 0,055) et des triglycérides (r = 0,55, p= 0,001), et en corrélation négative avec ceux d’albumine (r = – 0,44, p= 0,010) ; créatinine (r = – 0,54, p= 0,001); sélénium sérique (r = – 0,57, p= 0,001) et de cuivre ( r = – 0,36, p= 0,048) (Tableau 4). Aussi dans l’ensemble des enfants atteints et présumés sains, la relation entre l’IGSNK et les performances neuropsychologiques montrait des corrélations négatives entre l’IGSNK et les habilités neuromotrices et cognitives notamment avec l’habilité motrice globale (TMC) (r = -0,86; p< 0,001), l’indice global de fonctionnement cognitif (IPM) (r=-0,49; p=0,002), la mémoire de travail (r =-0,49; p=0,002); les capacités d’analyse visuo-spatiale (r=-0,47;p=0,004) (Tableau 4). Dans le cas konzo, il y avait des corrélations significatives entre l’IGSNK et le taux sérique des triglycérides comme marqueur de la malnutrition protéino-énergétique (r = 0,48 ; p= 0,033) et celui des 8, 12-Isoprostane F2-VI sérique comme indicateur du stress oxydatif (r = 0,46 ; p= 0,044). Chez les présumés sains, les corrélations significatives positives ne concernaient que les triglycérides (r=0,57 ; p= 0, 035) et les lipides totaux (r= 0,65 ; p=0,012). Dans un modèle de régression linéaire, seule la sévérité du konzo était associée de façon significative à l’ISGNK, avec un coefficient de détermination de 4 (IC95%: 2,4 – 6,1; p < 0,001) et cela s’expliquait dans 89,9 % des cas, indépendamment de l’âge et des taux sériques d’albumine, triglycérides, créatinine, cuivre, sélénium ainsi que des taux de 8, 12-Isoprostane F2-VI sérique. Par rapport à la médiane de scores de l’IGSNK qui était de 7, les enfants avec des scores inférieurs ou égaux à 7 (Test négatif) avaient des indices nutritionnels et des capacités neuromotrices et cognitives moins dégradés par rapport à ceux avec scores supérieurs à 7 (Test de la médiane). Cela concernait les indices Poids/Age-Z Score WHO (p= 0,030) et Taille/Age-Z Score WHO (p= 0,028), les taux sériques d’albumine(p=0,005), de sélénium (p= 0,009) et de triglycérides (p=0,011), des habilités motrices globales TMC (p<0,001) et les capacités de mémoire de travail (p=0,033). DISCUSSION Valeur clinique de l’indice global des signes du konzo (IGSNK) L’IGSNK, mis au point dans ce travail pour une évaluation quantitative de la détérioration neurologique dans le konzo, permettrait de faire une discrimination entre les états de détérioration neurologique de l’enfant avec konzo en termes de sévérité selon les stades ou les formes topographiques de la paralysie. Contrairement à la définition du konzo par l’OMS comme paraparésie spastique [1], le konzo peut prendre les formes topographiques cliniques de paraparésie ou quadriparésie spastiques [9], respectivement dans 65% et 35% des cas dans la présente étude. En rapport avec ces formes cliniques de la paralysie, l’IGSNK a montré sa valeur pour séparer les états neurologiques des enfants sans konzo de ceux avec konzo en dessous du score de 7 (Test négatif). Dans les états indemnes de konzo, l’IGSNK était associé à la malnutrition chronique, avec une corrélation négative avec l’Indice Taille/Age-Z Score WHO et positive avec la lipidémie totale et la triglycéridémie, ce qui indiquerait une mobilisation des réserves lipidiques pour combler le déficit énergétique glucidique. Ainsi, l’IGSNK rendrait compte de l’existence de troubles neurologiques mineurs liés à la malnutrition et l’intoxication chroniques ou peut être des formes infracliniques du konzo que l’on observe chez des enfants dans les zones endémiques ou dans les suites des épidémies de konzo [25]. L’association de l’augmentation de l’IGSNK à la sévérité du konzo, à la détresse socioéconomique familiale, à la malnutrition chronique, aux déficiences en albumine, sélénium, au stress oxydatif ainsi qu’à la diminution des performances neuromotrices et cognitives lui donne la valeur d’un marqueur clinique de multiples déficiences associées à la problématique étiopathogénique et clinique du konzo. Le lien de l’IGSNK avec la sévérité du konzo, les troubles moteurs et cognitifs ainsi qu’avec les isoprosranes 8,12-iso-iPF2α-VI marqueur ubiquitaire du stress oxydatif et du risque d’apoptose accorderait à cet indice la valeur d’un marqueur clinique probable de la neurodégénerescence en conditions d’intoxication cyanhydrique chronique [16, 27-30]. Indice global des signes neurologiques et aspects évolutifs du konzo La sévérité du konzo, comme l’IGSNK, n’était pas liée à la durée de la maladie, mais plutôt à l’âge des enfants. Par rapport à la durée de la maladie, cela dénote le caractère non progressif des troubles moteurs pyramidaux dans le konzo et quant au lien à l’âge, il s’agit probablement des effets cumulatifs de la vulnérabilité de l’enfant à l’intoxication cyanhydrique et à la malnutrition chroniques s’accentuant avec le temps de vie passé dans le milieu d’exposition. Cet effet cumulatif de la vulnérabilité à l’intoxication liée à l’âge est démontré dans une étude longitudinale dans laquelle les enfants atteints de konzo et présumés sains connaissent un déclin de leurs habiletés motrices globales avec une plus grande vulnérabilité des garçons associée à des indices d’une exposition plus élevée à l’intoxication cyanhydrique et au déclin cognitif [31]. En dépit de l’irréversibilité de la paralysie spastique, le konzo comporte des aspects évolutifs variables et encore peu documentés. L’amélioration fonctionnelle est possible, elle a été notée dans près de 3 cas sur 10 avec changement de stade dans cette étude, contre environ 1 cas d’aggravation sur 10 généralement mentionné dans la littérature [2, 9]. Mais dans l’enquête de l’Action contre la Faim [18], la rémission fonctionnelle partielle était signalée dans 20,8% des cas et l’aggravation dans 36,4% dans une série d’enfants et adultes confondus, sans précision de changement de stade. Les facteurs à la base de cette variation de l’évolution clinique fonctionnelle du konzo sont encore mal connus et appellent des études. Perspectives de recherche de validation de l’IGSNK En effet, dans les zones à forte prévalence de konzo, les signes d’atteinte pyramidale fruste sous forme d’hyperréflexie achilléenne et rotulienne et de clonus du pied sont observés [25] et leur fréquence chez les enfants en âge scolaire est supérieure à celle de konzo, soit 8 à 17% chez les enfants mozambicains [3]. L’étude de l’IGSNK est indiquée dans ces atteintes précliniques du konzo tout comme dans l’évolution du konzo, l’aggravation ou la rémission fonctionnelle partielle ou le changement des stades ainsi que dans l’évolution des troubles neuromoteurs et cognitifs. La recherche sur les formes précliniques, l’évolution clinique fonctionnelle du konzo associant l’IGSNK et les biomarqueurs physiopathogéniques toxiques, nutritionnels et du stress oxydatif pourra contribuer à l’élucidation de la question de l’évolution des troubles associés au konzo chez des personnes affectées surtout les enfants qui continuent à vivre dans les mêmes conditions d’exposition. La recherche sur les formes précliniques du konzo chez l’enfant est d’autant plus indiquée qu’une étude récente vient de montrer que les petits enfants de 12 à 48 mois présumés sains présentent des troubles psychomoteurs et cognitifs corrélés aux marqueurs de l’intoxication cyanhydrique [32]. CONCLUSION L’indice global des signes neurologiques du konzo, associé à la sévérité du konzo, corrélé à la pauvreté, aux troubles moteurs et cognitifs ainsi qu’aux biomarqueurs de la malnutrition et du stress oxydatif, constitue un marqueur clinique de susceptibilité et de gravité des troubles neurologiques et cognitifs chez l’enfant en milieu affecté par le konzo. Sa validation nécessite des études ultérieures. Tableau 1. Cotation des signes neurologiques dans le konzo
Tableau 2. Caractéristiques sociodémographiques et cliniques s enfants atteints de konzo et non atteints de konzo
Tableau 3. Association de l’indice global des signes neurologiques du konzo aux données cliniques et indices socioéconomique et nutritionnels chez les enfants atteints et non atteints de konzo
Légende: IIQ= intervalle interquartile; * corrélation de Pearson ; ** corrélation de Spearman; *** Tests de Kruskal-Wallis et de la médiane. Tableau 4. Corrélation entre les biomarqueurs d’intoxication cyanhydrique, du stress oxydatif, nutritionnels, les habilités neuromotrices et neurocognitives et l’indice global des signes neurologiques du konzo dans l’ ensemble des enfants konzo et non konzo(n=40).
 Figure 1 : Carte du Territoire de Kahemba au Sud-Ouest de la RDC/ Source : rapport annuel 2015 du 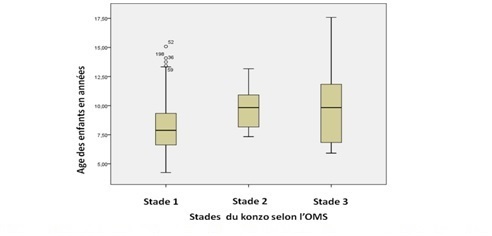 Figure 2: Sévérité de la maladie selon les stades 1, 2, 3 d’après l’OMS et Age des enfants atteints de konzo les enfants au stade 3 étaient relativement plus âgés que ceux au stade 1(p=0,05).  Figure 3 : Indice global des signes neurologiques du konzo et fréquence des états neurologiques des enfants en milieu affecté par le konzo REFERENCES
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647