
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CLINICAL STUDIES / ETUDES CLINIQUES
INFIRMITE MOTRICE D’ORIGINE CEREBRALE : UNE SERIE SENEGALAISE
CEREBRAL PALSY: A SENEGALESE COHORT
E-Mail Contact - NDIAYE Moustapha :
ngouille@hotmail.com
RESUME Introduction Methodologie Resultats Conclusion Mots-clès : Infirmité motrice cérébrale, Sénégal SUMMARY Background and purpose Methods Results Conclusion Key-words : Cerebral palsy, Senegal INTRODUCTION L’infirmité motrice d’origine cérébrale (IMOC) est un ensemble de troubles moteurs provoqués par des lésions cérébrales non progressives datant de la période ftale, néonatale ou des premiers mois de vie. Cette atteinte survient sur un cerveau immature. Si la lésion neuronale et gliale est définitive et fixée très tôt, les manifestations cliniques vont par contre se modifier avec l’âge, au fil des étapes de maturation neurologique jusqu’à l’âge de 7 ans. Il s’agit d’un véritable problème de santé publique par ses conséquences médicales, socioculturelles et économiques. La prise en charge est multidisciplinaire et coûteuse. L’objectif de ce travail est d’étudier les facteurs de risque associés aux infirmités motrices d’origine cérébrale (IMOC), les aspects cliniques, paracliniques et évolutifs de ces handicaps infantiles. PATIENTS ET METHODES Il s’agit d’une étude rétrospective de dossiers de patients suivis dans le cadre d’une consultation de neurologie pédiatrique entre Juillet 2003 et janvier 2009. L’enquête a eu pour cadre la Clinique Neurologique du Centre Hospitalier Universitaire de Fann et l’Hôpital d’Enfants Albert Royer. Nous avons colligé tous les dossiers de patients qui avaient un diagnostic certain d’infirmité motrice d’origine cérébrale et qui étaient âgés de 3 ans au plus. Les patients âgés de plus de 3 ans et les dossiers incomplets ont été exclus. Nous avons recueilli dans une fiche d’enquête remplie par nos soins, les variables suivants : la biographie, les données cliniques (age début, formes cliniques, signes associés) et paracliniques, la prise en charge et l’évolution. L’analyse statistique des informations collectées sur la fiche d’enquête a été faite à l’aide du logiciel SPSS 13.0. RESULTATS 793 enfants ont été colligés, en majorité des garçons (59%). L’âge moyen, au moment du diagnostic, était de 2 ans (extrêmes 3 mois et 3 ans). 85,4% des enfants avaient un âge compris entre 3 mois et 2 ans (figure 1). Cliniquement, 381 enfants (48,04%) avaient une hypotonie axiale, les formes pyramidales spastiques représentaient 49% soit 389 enfants, les formes extrapyramidales 2,9% (Tableau II). Outre les manifestations motrices, 179 enfants (23%) avaient un contact social pauvre : une absence de poursuite oculaire et/ou de sourire réponse et/ou de reconnaissance de l’entourage. 614 enfants (77%) avaient un bon contact social avec des interactions sociales de qualité . 282 enfants (35,6%) étaient épileptiques : 37,23% des patients avaient une épilepsie partielle, 54,96% une épilepsie généralisée et pour 7,8 % le caractère partiel ou généralisé de l’épilepsie n’était pas déterminé. 88 enfants (11,1%) présentaient des troubles du langage oral : 60 enfants avaient un retard isolé de l’expression orale, 28 autres patients avaient un trouble global de la compréhension et de l’expression orale. Des troubles du comportement étaient notés chez 10 enfants (1,26 %) à type de syndrome autistique pour 7 enfants, de troubles attentionnels avec une hyperactivité pour 3 autres. 7 enfants (0,88%) présentaient des mouvements anormaux à type de chorée et de tremblement. 17 enfants (2,14%) avaient des troubles neuro-sensoriels (surdité et cécité) mais seuls 7 d’entre eux avaient bénéficié dune exploration éléctro physiologique avec des potentiels évoqués visuels et auditifs altérés. Les anomalies du périmètre crânien et de la face étaient notées chez 76 enfants (9,58 %) à type de microcéphalie (49 cas), de macrocéphalie (15 cas), de craniosténose (5 cas) et de dysmorphie faciale (7 cas). 447 enfants (56,4%) avaient bénéficié d’un électroencéphalogramme (EEG). L’EEG était normal chez 81 (18,1%) enfants. 196 (43,8%) enfants présentaient des anomalies irritatives focales ou diffuses. 166 (37,1%) patients avaient une souffrance cérébrale sans anomalies irritatives. 4 patients (0,9%) avaient des rythmes rapides en rapport avec les benzodiazépines qu’ils prenaient. 4 enfants avaient une altération sévère des Potentiels Evoqués visuels et 3 autres une altération sévère des Potentiels Evoqués auditifs. 378 enfants (57,7%) avaient bénéficié d’une tomodensitométrie crânio-encéphalique (TDM). La TDM était normale chez 126 enfants et anormale chez 252 autres enfants. Les anomalies suivantes étaient identifiées : atrophie corticale et/ou sous corticale (150 enfants), hypodensités focales de topographie vasculaire (23 enfants), calcifications cérébrales (15 enfants) et malformations cérébrales (30 enfants). Les malformations cérébrales étaient dominées par les porencéphalies, l’holoprosencéphalie et les troubles de la gyration (agyrie, pachygyrie avec shizencéphalie), des agénésies du corps calleux, du trigone et du splénium, une agénésie du vermis, une hémimégalencéphalie, un Dandy Walker I et une hydronencéphalie. Tous les enfants avaient une prescription de rééducation motrice. 283 enfants (35,7%) avaient bénéficié d’un traitement antiépileptique dont 219 cas d’une monothérapie, 59 cas d’une bithérapie et 5 cas d’une trithérapie. Les molécules les plus utilisées étaient le phénobarbital, le valproate de sodium et la carbamazépine. Seuls 2 enfants (0,3%) avaient pu bénéficier d’une rééducation orthophonique. D’autres traitements (anti-spastiques, benzodiazépines, halopéridol) avaient été prescrits chez 28 enfants (3,5%). 112 patients ont été régulièrement suivis (tous les 3 mois) et évalués après un délai moyen de 31,61 mois (extrêmes 12 à 68 mois). 35 enfants avaient acquis une marche autonome sans aucun déficit. 37 enfants avaient une autonomie de la marche limitée du fait d’une diplégie spastique (22 enfants) ou d’une hémiplégie spastique (11 enfants) ou d’une démarche ataxique (4 cas). 35 enfants n’avaient eu aucune acquisition psychomotrice avec persistance d’une hypotonie axiale et d’une quadriplégie spastique (33 cas) ou d’une dystonie axiale (2 enfants). Le langage oral était déficitaire chez 91 enfants soit de façon apparemment isolée (87 enfants) soit dans un contexte de déficit cognitif global (4 enfants). Le langage oral était expressif chez 18 autres enfants dont 2 présentaient cependant des troubles du graphisme. Pour 3 autres enfants le langage n’a pu être apprécié du fait du jeune âge (moins de 18 mois). Parmi les 112 patients régulièrement suivis, 67 étaient épileptiques dont 55 bien équilibrés sous traitement antiépileptique depuis 1 à 2 ans et 12 autres pour lesquels l’épilepsie était rebelle aux traitements antiépileptiques. 5 enfants avaient des troubles du comportement à type de syndrome autistique (2 cas), d’hyperactivité avec troubles attentionnels (2 cas). 2 enfants présentaient des troubles du sommeil à type d’insomnie. 1 enfant avait des rétractions des ischio-jambiers et devait bénéficier de la chirurgie. COMMENTAIRES L’infirmité motrice d’origine cérébrale est un problème de santé publique et plusieurs facteurs de risque sont connus et peuvent se retrouver chez un même patient. Dans notre série, 82,6% des enfants avaient un ou plusieurs facteurs de risque identifiés. Parmi ces facteurs de risque, la consanguinité parentale est incriminée par certains auteurs, la plupart asiatiques (1,5,15). Elle est retrouvée dans 23,8 à 51,7% des séries. Al-Rajeh et al (1) avaient trouvé en Arabie saoudite que les principaux facteurs de risque identifiés étaient un antécédent familial d’IMOC et une consanguinité des parents. Ils étaient 29,4% dans notre série à être issus d’un mariage consanguin. Ce pourcentage de 29,4% est dans la moyenne des publications mais reste largement inférieur au taux de consanguinité dans la population générale sénégalaise qui est de 43,02% (9). Il est donc peu probable que la consanguinité parentale soit un facteur de risque indépendant d’autant plus qu’il n’avait pas été retrouvé de récurrence familiale d’IMOC dans notre série. Ces cas signalés, seraient-ils des encéphalopathies fixées ou lentement progressives dans le cadre d’une maladie métabolique?. Dans notre série si l’asphyxie néonatale est retrouvée chez 1/5 des patients, la prématurité est plus rarement en cause. Dans la littérature, l’asphyxie néonatale est rapportée dans 24 à 34,6% des cas, la prématurité et/ou le petit poids de naissance dans 22 à 40,5% des cas (1,3,5,11,16). Dans une précédente enquête au Sénégal, Ndiaye et al (8) avaient trouvé une nette prédominance des anomalies de la grossesse et de l’accouchement, 44,08%. Ceci est probablement dû à la qualité de l’offre de soins aux femmes en grossesse : 53% des femmes sénégalaises accouchent à domicile sans l’assistance d’un personnel de santé (4). Beaucoup parmi celles qui accouchent dans une structure sanitaire, surtout en zone sub-urbaine et rurale, sont assistées par les « matrones », personnel communautaire non qualifié. Du fait de cette précarité des soins périnataux, les accouchements dystociques sont fréquents avec leur corollaire de souffrance néonatale et beaucoup de prématurés meurent, ce qui explique leur faible proportion dans notre série. Les infections post-natales du système nerveux central qui constituaient la deuxième grande cause d’IMOC au Sénégal (8) ne sont retrouvées que chez 6,2% des patients de notre série. Le jeune âge des patients, essentiellement des nourrissons, explique en partie cette faible prépondérance. Ces infections sont rarement en cause dans la plupart des séries de la littérature (1,3,5). Les interactions entre les infections durant la grossesse et la survenue d’IMOC sont maintenant des sujets prioritaires de recherche (6). Les autres facteurs de risque, en particulier anténataux comme les malformations cérébrales, les infections anténatales, les traumatismes crâniens «domestiques » (2,6,7,10,12) sont plus rarement retrouvés dans notre série. Sur le plan clinique, l’hypotonie axiale (48,04%) et les formes pyramidales (49%) étaient les plus représentées alors que les formes extrapyramidales étaient rares dans notre série (2,9%). Suvanand et al (16) avaient trouvé dans une population d’enfants âgés de moins de 5 ans, 86.4% de tétraplégie. La surreprésentation de l’hypotonie axiale est liée à la précocité du diagnostic avec 43% des enfants de notre série qui avaient entre 3 et 12 mois au moment du diagnostic. Dans une population plus âgée, de nombreux auteurs ont trouvé une prédominance des formes spastiques (3,5,8) alors que l’hypotonie axiale était faible. A coté des troubles moteurs, d’autres signes sont fréquemment associés, en particulier l’épilepsie qui est retrouvée dans 33 à 46,23% des séries (3,8,18). Notre taux se trouve dans la fourchette. Outre l’épilepsie, il est important de dépister tous les nombreux signes associés chez les enfants IMOC. Leur prise en charge est aussi essentielle que celle des troubles moteurs. Sigurdardóttir et al (14) avaient trouvé des troubles visuels chez 19% de leurs patients et des troubles l’audition chez 6%. La faible fréquence de troubles neuro-sensoriels dans notre série pourrait s’expliquer par le fait que très peu de nos enfants avaient bénéficié d’un examen électro-physiologique (PEA-PEV). Ces explorations éléctrophysiologiques sont nécessaires pour dépister des signes infracliniques à cet age, tout comme l’imagerie cérébrale qui donne une cartographie des lésions cérébrales séquellaires. La tomodensitométrie (TDM) cérébrale était normale chez un tiers des patients qui avait bénéficié d’une exploration neuroradiologique et anormale chez 2/3 des enfants. Les anomalies tomodensitométriques identifiées étaient à type d’atrophie corticale et/ou sous corticale, d’hypodensités focales de topographie vasculaire, de calcifications cérébrales et malformations cérébrales. Bringas-Grande et al (3) avaient trouvé les mêmes anomalies chez 4/5 des patients alors que la TDM était normale chez 23,8% autres enfants. Les anomalies neuroradiologiques sont fréquentes chez les enfants IMOC. La moitié des prématurés et les 2/3 des enfants nés à terme ont des anomalies neuroradiologiques à type d’infarctus focaux, de malformations cérébrales, de leucomalacies péri-ventriculaires (10,13). Beaucoup de patients ont été perdus de vue, seuls 14,12% des enfants ont eu un suivi régulier pendant au moins 1 an. Dans une série nigériane, 58,7% des patients étaient perdus de vue (17). La prise en charge est longue, difficile avec des implications financières énormes. Les structures de rééducation motrice sont d’accès difficile, n’existent que dans quelques villes et sont rarement spécialisées dans la prise en charge des handicaps neurologiques de l’enfant. Les soins sont coûteux pour la plupart des familles des enfants IMOC. Les techniciens de l’orthophonie et de l’ergothérapie n’existent pratiquement pas dans nos pays en voie de développement. L’unique structure scolaire nationale spécialisée qui s’occupe de ces enfants a une capacité d’accueil très limitée. CONCLUSION L’infirmité motrice cérébrale reste un problème de santé publique. Les facteurs de risque sont connus et dominés par les anomalies de la grossesse et de l’accouchement et les infections du système nerveux central. L’insuffisance des ressources humaines et matérielles constitue une limite objective à la prise en charge des enfants IMOC. La prévention reste le meilleur moyen de diminuer l’incidence de cette affection. Tableau 1 : Facteurs de risque et antécédents personnels et familiaux chez les enfants IMOC
Tableau 2 : Anomalies neuroradiologiques chez les enfants IMOC
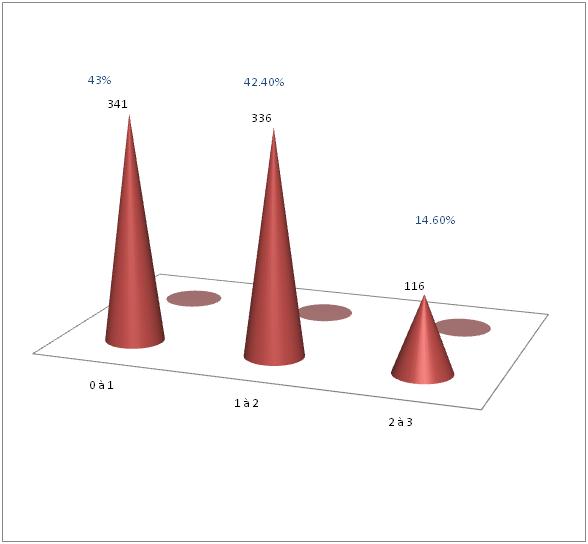 Figure 1 : Age des patients au moment du diagnostic 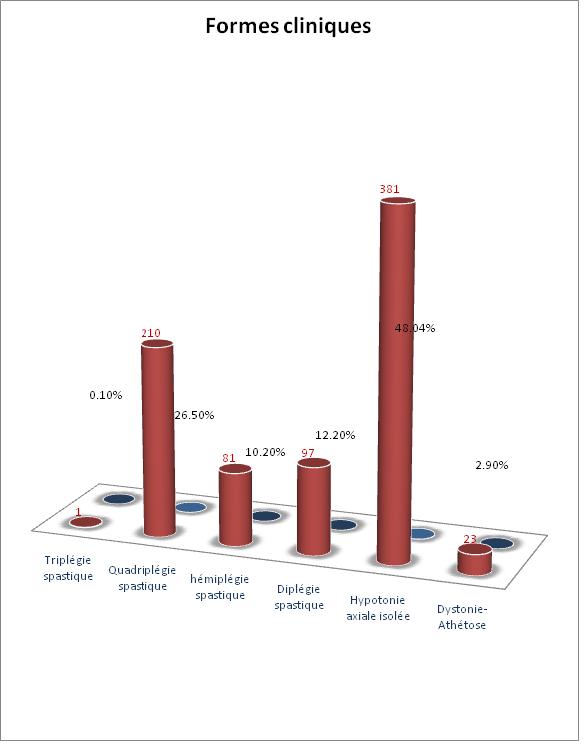 Figure 2 : Formes cliniques des enfants IMOC BIBLIOGRAPHIE
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647