
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REVIEW / MISE AU POINT
LA MALADIE DE CHARCOT-MARIE-TOOTH DE TYPE I (CMT1)
CHARCOT-MARIE-TOOTH TYPE I DISEASE (CMT-1)
E-Mail Contact - ADOUKONOU Thierry Armel :
adoukonouthierry@yahoo.fr
RESUME La maladie de Charcot-Marie-Tooth de type 1 (CMT1) est la neuropathie héréditaire la plus fréquente ; il en existe plusieurs formes ou sous-types. La littérature foisonne de données récentes grâce surtout aux avancées des analyses de biologie moléculaire et aux études corrélatives des données cliniques, électrophysiologiques et microscopiques. Dans cette revue, les auteurs présentent une mise au point des aspects génétiques, biologiques, cliniques, histologiques, neurophysiologiques et thérapeutiques des différentes formes de la maladie de Charcot-Marie-Tooth de type 1, ainsi que des formes apparentées. Cette revue se veut avant tout didactique, résumant les principales données actuelles sur la question. Mots clés: neuropathie héréditaire, maladie de Charcot-Marie-Tooth, classification, histologie, génétique, neurophysiologie ABSTRACT Charcot-Marie Tooth disease is the most frequent and common inherited neuropathy with the various forms and subtypes. Recently more data are available on this disease because of the recent advances in it genetic, electrophysiology, and histological, therapeutic aspects. In this review we focus on the main aspects of the disease and update the knowledge on the Charcot-Marie-Tooth type1 disease. The CMT-1A is the most frequent form of the disease and represents more than eighty percent of the all subtypes. The clinical features of all and the electrophysiological pattern can help physician to distinguish the genetic form of the different subtypes of the disease. Key words: hereditary neuropathy, Charcot-Marie-Tooth disease, genetic, histology, electrophysiology. INTRODUCTION Décrite à la fin du XIXème siècle par les Français Jean-Martin Charcot et Pierre Marie [1], et le Britannique Howard Tooth [2], la maladie de Charcot-Marie-Tooth (CMT) est la forme la plus commune de neuropathies héréditaires. Dans la population générale, sa prévalence est estimée entre 1/1214 [3] et 1/2500 [4] en Norvège, mais des prévalences plus faibles ont été constatées en Espagne (1/3500) [5], en Italie (1/5700) [6], en Islande (1/8300) [7] et au Japon (1/9200) [8]. La classification actuelle des neuropathies de CMT est avant tout basée sur le caractère de la transmission de l’anomalie génétique et les données électro-cliniques. Ces variations épidémiologiques pourraient ainsi en partie être expliquées par des modes de recensement différents en fonction des pays, en sachant que des spécificités ethniques sont vraisemblables [9]. On distingue 3 types de transmission (autosomique dominant, autosomique récessif et lié à l’X) et 3 types électrophysiologiques (démyélinisant, axonal et intermédiaire). On identifie ainsi classiquement 7 catégories de CMT (Tableau 1) [10]. Certains signes spécifiques se rencontrent des formes particulières (paralysie des cordes vocales, insuffisance respiratoire, anomalie cutanée, néphropathie, atrophie optique, syndrome pyramidal, …) [11]. D’autres signes sont communs à de nombreuses formes de CMT; c’est par exemple le cas des anomalies pupillaires observées dans diverses forme de CMT (CMT1A, CMT1B, CMT2A2, CMT2J, CMTX1, CMT5, et CMT6), dans le syndrome de Déjerine-Sottas (SDS), la neuropathie hypomyélinisante congénitale (NHC), mais aussi dans la neuropathie héréditaire par hypersensibilité aux points de pression (NHPP) [12]. L’ensemble de ces données permet donc de classer relativement simplement la cinquantaine de formes actuellement connues de CMT; malgré tout, cette classification reste imparfaite et mériterait des aménagements. Les gènes impliqués codent pour des protéines présentes dans différentes structures du nerf, tant au niveau de l’axone que de la cellule de Schwann. Le CMT1 est plus fréquemment rencontré que le CMT2: respectivement 60% et 26% dans une étude allemande [13], et 80,4% et 25,2% dans une étude britannique [14]. Si l’on s’attache au caractère héréditaire, une étude Norvégienne a montré que les formes de transmission autosomique (36/100000) étaient plus fréquentes que les formes de transmission autosomique récessive (1,4/100000) ou liées à l’X (3,6/100000) [4]. La maladie de Charcot-Marie-Tooth de type 1 (CMT1) est d’expression clinique très variable, allant de formes pauci-symptomatiques ou d’intensité modérée (parfois de révélation tardive) à des formes très sévères et précoces, comme le SDS et la NHC [15]. Elle se caractérise électrophysiologiquement par une atteinte démyélinisante homogène et symétrique, alors qu’au cours des neuropathies démyélinisantes acquises, comme les polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC), les lésions de démyélinisation sont hétérogènes (car multifocales et de distribution aléatoire) [16]. On distingue 6 formes de CMT1 (classées de A à F), dont les principales caractéristiques sont indiquées dans le Tableau 2, ainsi que trois formes de neuropathies héréditaires démyélinisantes (à transmission autosomique dominante) assimilables à des variantes de CMT1 [17]. La suite de notre propos va s’attacher à montrer les principales caractéristiques des différentes formes de CMT 1. Devant la richesse de la littérature nous proposons une synthèse des données à travers une revue générale qui se veut avant tout un outil didactique. CMT1A (MIM 118220) Génétique/Biologie: Cette entité est la forme la plus fréquente de CMT, représentant 80,4% de l’ensemble des CMT [14]. Elle est associée à une duplication (d’une taille de 1,5 mégabases) du bras court du chromosome 17 (17p12) contenant le gène PMP22 [18]. Ce gène a été identifié dans les années 1990 [19-21]. PMP22 est une protéine membranaire de petite taille (22 kDa), et l’un des constituants de la myéline compacte du système nerveux périphérique. Elle est constituée de 160 acides aminés, et contient quatre domaines transmembranaires TM1-4, deux bras cytoplasmiques, une courte boucle intra-cellulaire et deux boucles extracellulaires (l’une d’entre elles portant l’épitope L2/HNK1, médiateur d’adhésion). Cette protéine PMP22 est d’expression diffuse au stade embryonnaire, y compris dans le système nerveux central. En revanche, à l’âge adulte, si elle est évidemment exprimée nettement dans les cellules de Schwann (où elle représente 2 à 5% de la myéline compacte), elle est aussi très faiblement exprimée dans le système nerveux central (cortex, tronc cérébral, moelle épinière), en particulier au niveau des noyaux moteurs des nerfs crâniens et des noyaux des motoneurones périphériques, ainsi que dans certains tissus non nerveux (muscle squelettique, cur) [18]. Outre le fait qu’elle soit un constituant de la myéline compacte, la fonction de cette protéine reste encore mal connue. Elle pourrait notamment jouer un rôle essentiel dans le fonctionnement des neurones (l’exprimant aux stades précoces du développement embryonnaire) dans l’initialisation de la myélinisation puis dans la maintenance myélinique, comme suggéré au travers d’observations sur des souris Trembler et des souris dépourvues de PMP22 [22]. Clinique: Cette neuropathie se manifeste habituellement précocement durant la vie (avec toutefois une importante variabilité d’expression et de sévérité), restant relativement stable à l’âge adulte [23, 24]. Des formes pauci-symptomatiques de révélation tardive ont pu aussi être décrites, comme le cas d’un ancien cycliste professionnel espagnol pour lequel cette maladie a été diagnostiquée à l’âge de 75 ans [25]. Le phénotype clinique correspond à celui classiquement décrit, associant une amyotrophie et une faiblesse distales des membres inférieurs, une aréflexie ostéo-tendineuse (le plus souvent généralisée), des pieds creux et une atteinte sensitive modérée [26]. Rarement, une duplication du gène PMP22 peut se manifester par un phénotype clinique de type NHPP (neuropathie héréditaire par hypersensibilité à la pression, OMIM 162500) les manifestations cliniques sont des épisodes récurrents de paralysie tronculaire [27-41]. Dans ces phénotypes NHPP, l’IRM des troncs nerveux peut objectiver des hypersignaux ou des élargissement focaux [27]. Neurophysiologie/radiologie: Dans la plupart des cas, les vitesses de conduction motrices sont inférieures à 30 m/s, et les latences distales allongées (> 5 ms) au niveau des nerfs médians [42, 43]. Des blocs de conduction moteurs (ou des ralentissements plus importants des vitesses de conduction nerveuse (VCN) peuvent être observés aux points de passage physiologiques (canal carpien, gouttière cubitale, …) dans les phénotypes NHPP [27]. Anatomo-pathologie: Le CMT1A se distingue par la présence de très nombreuses proliférations en « bulbes d’oignon » témoignant d’un processus chronique de démyélinisation-remyélinisation [44]: chacune d’entre elles correspond à une prolifération concentrique de fragments cytoplasmiques (nucléés ou non) de cellules de Schwann, voire de fragments de membrane basale (surtout chez l’enfant), organisées autour de fibres nerveuses dont la gaine de myéline apparaît trop fine par rapport au diamètre de l’axone qu’elle entoure [45]. D’une manière générale, ces lésions caractérisent les « neuropathies hypertrophiques » (les nerfs augmentent de volume et deviennent palpables). De tels aspects ne sont pas spécifiques au CMT1A et peuvent aussi se rencontrer dans d’autres formes de CMT comme le CMT1B lié à une mutation du gène MPZ (et dans le syndrome SDS), mais est aussi observé dans 10 à 43% des neuropathies acquises de type PIDC (polyneuropathie inflammatoire démyélinisante chronique) [46]. Toutefois, dans le CMT1A, les formations en « bulbe d’oignon » (Figure 1) sont beaucoup plus diffuses [47] et sont le siège d’une immuno-réactivité pour la PMP22 (non observée dans les « bulbes d’oignon » des PIDC) [48]. Ces aspects de démyélinisation segmentaire peuvent aussi être observés en « teasing » sous la forme d’une « mise à nu » plus ou moins complète et extensive de l’axone entre deux nuds de Ranvier successifs (avec augmentation de taille du noyau des cellules de Schwann) [45]. Dans le CMT1A (comme dans le CMT1B), la démyélinisation semble stable dans le temps, alors que la perte axonale évolue avec la durée et donc l’âge [44]. Une autre lésion rarement observée dans le CMT1A est la « tomacula » caractérisée par une hypermyélinisation (Figure 2): ces processus donnent un aspect en « chapelet de saucisses » à la fibre nerveuse myélinisée, et sont en fait le plus souvent rencontrés dans les NHPP. Dans le CMT1A, leur diamètre moyen est de 14,1µm (± 3,5), et leur longueur moyenne de 77,4 µm (± 16,1) [49]. Enfin, quelques éléments inflammatoires peuvent être observés sur des biopsies nerveuses de patients atteints de CMT1A [50]. Désormais, comme il s’agit de la forme la plus fréquente des CMT, la biologie moléculaire permet un diagnostic facile et rapide, si bien que la biopsie nerveuse n’est plus réalisée dans cette indication. Orientations thérapeutiques pour le CMT1A: Basé sur des considérations physiopathologiques, un certain nombre de thérapeutiques ont été essayées, in vivo ou in vitro, pour tenter de ralentir la progression du CMT1A [51]. Chez les souris transgéniques sur-exprimant PMP22, l’acide ascorbique semble limiter la sévérité de la neuropathie [52]; in vitro, elle favoriserait la myélinisation et diminuerait l’expression de PMP22 [53]. Pour ces raisons, un essai thérapeutique s’est attaché à prouver une efficacité de l’acide ascorbique (à la posologie de 1500 mg/jour pendant 24 mois) chez des patients atteints de CMT1A, en vain [54]. De même, une posologie journalière plus importante d’acide ascorbique (4000 mg/jour pendant 24 mois) n’a pas montré non plus de différence statistiquement significative par rapport au placebo [55]. La thérapie génique est une autre voie à l’étude dans le traitement du CMT1A. Ainsi, l’administration d’un vecteur dérivé de virus adéno-associé permettant la synthèse de neurotrophine-3 (NT-3) chez des souris Trembler (modèle de CMT1A) permet d’améliorer la fonction motrice et la conduction nerveuse de ces souris [56]: ces résultats sont bien évidemment encourageants, mais méritent d’être confirmés (en attendant peut-être des applications futures chez l’homme). Récemment, l’utilisation de diadénosine homo-dinucléotide P18 (favorisant la diminution de la concentration de calcium à l’intérieur des cellules de Schwann) a permis d’observer (in vitro) une amélioration du processus de myélinisation dans un modèle expérimental de CMT1A [57]. In vitro, la progestérone est capable, d’augmenter l’expression des gènes PMP22 et MPZ [58], d’où l’idée de tester l’effet d’injections sous-cutanées quotidiennes de progestérone et d’onapristone (antagoniste de la progestérone) durant 7 jours chez des modèles transgéniques de rat CMT1A [59]: ceci a permis de montrer que l’onapristone permettait de réduire la perte musculaire et de prévenir la perte axonale, sans pour autant modifier l’épaisseur de la gaine de myéline [60]. Toutefois, l’utilisation d’un antagoniste de la progestérone apparaît trop toxique pour pouvoir être utilisé sans risque chez l’être humain. Une autre molécule prometteuse dans le traitement du CMT1A est la curcumine, celle-ci jouant un rôle stimulant pour la translocation de certaines protéines du réticulum endoplasmique vers la membrane plasmique (réduisant ainsi la toxicité cellulaire des protéines mutantes) [61]: l’administration orale de curcumine chez la souris Trembler (modèle de CMT1A) permet ainsi d’inhiber l’apoptose des cellules de Schwann, mais aussi d’augmenter le calibre des axones et l’épaisseur des gaines de myéline (cet effet étant dose-dépendant et réversible à l’arrêt du traitement) [62]. Les résultats d’un essai randomisé contre placebo de phase II, réalisé chez 80 malades provenant de six centres français ont été récemment présentés [63]; le médicament utilisé par voie orale (PXT3003) est constitué d’une association de GABA (baclofen), d’un récepteur opioid (naltrexone hydrochloride) et du métabolite naturel D-sorbitol. Ce composé a montré expérimentalement son aptitude à abaisser la PMP22. Cet essai affirme la non toxicité du produit et met en évidence un effet modeste à 12 mois sur le score CMTNS (Charcot-Marie-Tooth Neuropathy Score), ce qui justifierait l’instauration d’un essai de phase III. CMT1B (MIM 118200) Génétique/biologie: Cette forme de CMT résulte de mutations du gène MPZ (situé dans la région q22-q23 du chromosome 1) codant pour la glycoprotéine P0: ces mutations peuvent provoquer un gain de fonction, un effet dominant négatif, une perte partielle de fonction ou une hyperglycosylation [64]. P0 est majoritairement exprimée dans les cellules de Schwann, et représente environ 50% des composants protéiques de la gaine de myéline du système nerveux périphérique: il s’agit d’une protéine transmembranaire d’un poids de 29 kDa (composée de 219 acides aminés), comportant trois domaines distincts: un domaine extra-cellulaire glycosylé (immunoglobulin-like), un domaine membranaire, et un domaine intra-cellulaire [65]. En fait, P0 est un membre de la famille des immunoglobulines jouant un rôle de molécule d’adhésion essentielle dans le maintien de la structure de la gaine de myéline: plus précisément, elle participe au maintien de la myéline compacte au niveau des lignes périodiques [65]. Lors du processus de myélinisation, P0 favoriserait la compaction de la myéline en excluant la protéine MAG [44]. Clinique/neurophysiologie: Le profil électro-clinique de cette entité est similaire à celui du CMT1A. Néanmoins, quelques rares cas présentant des signes électriques d’une atteinte axonale ont été rapportés, leur mécanisme n’étant pas clair [66]. Par ailleurs, une mutation du gène MPZ peut rarement se manifester par un phénotype clinique de NHPP [67]. Anatomo-pathologie: Tout comme pour le CMT1A, l’étude histologique de nerfs de patients atteints de CMT1B révèle une diminution de la densité des fibres myélinisées, des signes de démyélinisation segmentaire, des formations en « bulbes d’oignon » et l’absence d’altération des fibres amyéliniques [44]. Cependant, souvent leur aspect se distingue de celui du CMT1A par la présence d’une part d’une décompaction d’une partie de quelques lamelles myéliniques, et d’autre part par l’existence de proliférations aberrantes focales (ou « foldings ») des gaines myéliniques [68], ces deux aspects pouvant parfois apparaître simultanément (ou non) sur une même biopsie [69]. Bien que les patients atteints de CMT1B puissent parfois présenter des neuropathies canalaires, ces « foldings » sont différents des tomaculae [70]. Les « foldings » sont des proliférations aberrantes (présentes le long de la totalité des fibres myélinisées), correspondant à des replis internes (« infoldings ») ou externes (« outfoldings »), de la gaine de myéline [71]. Ceci les distingue des « tomaculae » dont les contours sont réguliers [72]. Lorsqu’ils sont très nombreux, ces « foldings » peuvent donner un aspect de « neuropathie globulaire » [73]. Concernant l’aspect de décompaction myélinique, il se traduit par un élargissement des lignes denses des parties interne ou externe (parfois de la totalité) de la gaine de myéline (par dissociation des lignes périodiques appariées) [74]. Toutefois, de tels aspects de décompaction myélinique ne sont pas spécifiques du CMT1B, et peuvent se rencontrer dans des neuropathies acquises telles que le syndrome POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, M-protein, Skin changes) [75], les neuropathies liées à une gammapathie monoclonale IgM (immunoglobuline M) et une activité anti-MAG [76], ou plus rarement celles associées à des gammapathies monoclonales de type IgA ou IgG [76]. Comme pour le CMT1A, des éléments inflammatoires peuvent être observés sur la biopsie de nerf de ces patients, ce qui pourrait expliquer pourquoi quelques malades se trouvent améliorés par la cortisone [77]. CMT1C (MIM 601098) Génétique/biologie : Cette neuropathie est associée à des mutations du gène LITAF (Lipopolysaccharide-Induced TNF Factor), également appelé SIMPLE (Small Integral Membrane Protein of Lysosome/late Endosome) ou PIG-7 (P53 Inductible Gene-7), situé sur le chromosome 16p13.1 [78]. Initialement, deux transcrits différents furent rapportés, LITAF et SIMPLE [15]; mais, le transcrit LITAF résultant en fait d’une erreur de séquençage de l’ADN, seul le transcrit SIMPLE reste le véritable transcrit de ce gène [79]. SIMPLE correspond à une protéine précoce des endosomes (d’un poids de 18 kDa), particulièrement exprimée dans les cellules de Schwann [80]. Ainsi, un déficit en LITAF est à l’origine d’une part d’une accélération de la destruction de la myéline et de l’émergence d’une repousse axonale, et d’autre part d’une augmentation du nombre de macrophages lors du processus de dégénérescence wallerienne [81]. Anatomo-pathologie : L’aspect est proche de ce qui est observé dans le CMT1A [44]. CMT1D (MIM 607678) Génétique/biologie: Il s’agit d’une forme rare de CMT1 causée par des mutations du gène EGR2 (Early Growth Response 2) situé sur le chromosome 10q21-q22 [82]. Si le CMT1D est bien de transmission autosomique dominante, des cas de mutations EGR2 à transmission autosomique récessive ont pu être observés [83]. EGR2 (également appelé KROX20), en collaboration avec SOX10 (qui régule EGR2), joue un rôle primordial dans la formation et la maintenance myélinique [84]: il s’agit d’un facteur de transcription en « doigt de zinc » (Cys2-His2) permettant de réguler l’expression des gènes codant pour les protéines myéliniques telles que P0, connexine 32, MBP et PMP22 [85]. Clinique: L’expression clinique du CMT1D est très variable, allant de formes modérées à début tardif à des formes sévères à début précoce (SDS ou NHC) [82, 86]. Anatomo-pathologie: Sur la biopsie de nerf sural, on constate une raréfaction sévère en fibres myélinisées, associée à de très nombreuses formations en « bulbe d’oignon » [87]. Par ailleurs, l’absence complète en EGR2 (transmission autosomique récessive) engendre un tableau de NHC du fait d’une absence totale de myéline, d’ou la dénomination de « syndrome d’amyélinisation congénitale » [88]. CMT1E (MIM 118300) Génétique/biologie : Cette entité représente seulement 1 à 5% des CMT1, et est associée à des mutations ponctuelles du gène PMP22 [18]. Initialement, ces cas furent considérés comme cliniquement plus sévères que les cas en lien avec une duplication du gène PMP22 (CMT1A) [89]. Clinique : En réalité, les CMT1E englobent un large spectre de phénotypes cliniques, avec des manifestations allant de formes modérées de phénotype NHPP à des formes sévères de type SDS ou NHC [18]. Si les mutations du gène PMP22 induisent bien des neuropathies démyélinisantes, il semblerait que l’une d’entre elle (mutation R159C) puisse déterminer un profil « axonal » [90]. Par ailleurs, certains patients peuvent présenter des pieds plats, une scoliose ou une surdité bilatérale [91]. Anatomo-pathologie : Les lésions microscopiques des formes précoces et sévères sont superposables à celles observées en cas de duplication du gène PMP22, avec une raréfaction sévère en fibres myélinisées et une profusion de « bulbes d’oignon ». Dans le cas des phénotypes de type NHPP, des tomaculae peuvent être observées (en cas de mutation ponctuelle) [92], voire une réduction de l’épaisseur de la myéline sans formation en « bulbe d’oignon » (en cas de mutation non-sens) [34]. Enfin, un aspect de décompaction de la myéline, avec régions internodales courtes (entrecoupées de régions ou l’axone est dénudé) peut être aussi observé [91]. CMT1F (MIM 607734) Génétique/biologie: Cette forme de CMT1 est due à des mutations du gène NEFL (Neurofilament protein light polypeptide) encodant les chaînes légères des neurofilaments (NF-L), constituant majeur des filaments intermédiaires, jouant un rôle déterminant dans l’assemblage et la maintenance du cytosquelette axonal [93]. Clinique/neurophysiologie: Initialement, de telles mutations ont été décrites comme des formes axonales de transmission autosomique dominante (CMT2E) [94]. Cependant, certains de ces patients présentaient clairement un profil électrophysiologique de type démyélinisant, en cohérence avec les aspects anatomo-pathologiques observés. Pour cette raison, cette entité est parfois qualifiée de CMT2E/1F. Anatomo-pathologie: Quelques formations en « bulbes d’oignon » (avec aspect trop fin des gaines de myéline par rapport au calibre de l’axone correspondant) ont été observées [95]. Autres neuropathies héréditaires de transmission autosomique dominante ayant les phénotypes CMT1 : Syndrome de Roussy-Levy (MIM 180800) Ce tableau clinique, également dénommé « dystasie aréflexique héréditaire », fut décrit pour la première en 1926 par Gustave ROUSSY et Gabrielle LEVY comme l’association d’une ataxie héréditaire de transmission autosomique dominante, associée à des tremblements [96, 97]. Ces patients présentent un profil électrophysiologique de neuropathie démyélinisante; l’analyse histologique objective de nombreuses formations en « bulbe d’oignon », plus rarement un aspect d’hypertrophie focale de la myéline ou une perte majeure en fibres myélinisées [98]. Ainsi, cette entité est considérée comme une variante de CMT1. Cliniquement, ces patients présentent une ataxie proprioceptive, des pieds creux, une aréflexie ostéo-tendineuse généralisée, plus rarement un tremblement postural ou des troubles sensitifs thermo-algiques modérés [99]; parfois, une hypertrophie des racines nerveuses peut être mise en évidence à l’IRM [100]. Le syndrome de Roussy-Levy peut être indifféremment secondaire à une duplication [99] ou à des mutations [101] du gène PMP22, plus rarement à des mutations du gène MPZ [98]. En fait, il a été prouvé génétiquement que la famille initialement décrite en 1926 était finalement porteuse d’une mutation du gène MPZ, forme plus rare de cette maladie associée histologiquement aux cas d’hypertrophie focale de la myéline et à une raréfaction majeure des fibres myélinisées [98]. Neuropathie de type CMT associée aux mutations du gène Fibulin-5 Génétique/biologie: Le gène FBLN5 (Fibulin-5) code pour une glycoprotéine liée au transport du calcium, régulateur clé du développement et de la maintenance des tissus riches en fibres élastiques, élément indispensable de l’élastogenèse. Les mutations de ce gène engendrent un tableau de « cutis laxa » (associant hyperlaxité cutanée, dégénérescence maculaire liée à l’âge, et anomalies portant sur les fibres élastiques d’autres organes comme le cur) [102]. Clinique/neurophysiologie/anatomo-pathologie : Récemment, des cas de polyneuropathie démyélinisante de type CMT1 ont pu être liés à cette mutation, caractérisés par une association à une hyperlaxité cutanée et une dégénérescence maculaire liée à l’âge [102]. A ce jour, aucune analyse microscopique des nerfs de ces patients n’a été rapportée. Neuropathie de type CMT associée aux mutations du gène GJB3 Génétique/Biologie : Les mutations du gène GJB3 (Gap Junction protein Beta-3) sont à l’origine d’une pathologie dermatologique (erythrokeratodermia variabilis et progressiva, ou EKV; OMIM 133200) et des atteintes cochléaires telles que la surdité autosomique dominante de type 2B (OMIM 612644) et la surdité digénique GJB2/GJB3 (OMIM 220290). GJB3 code pour la protéine appelée « Connexine 31 », composant essentiel des jonctions communicantes au niveau du tissu cutané, de la cochlée, mais aussi des cellules de Schwann [103]. Clinique : Les premiers cas de CMT liés à une mutation du gène GJB3 ont été identifiés dans une famille espagnole: ces patients présentaient une polyneuropathie sensitivo-motrice associée à une surdité de transmission autosomique dominante; des ulcérations cutanées plantaires (à l’origine d’amputations) ont parfois été rapportées [104]. Neurophysiologie/anatomo-pathologie : Malgré des lésions de démyélinisation/remyélinisation sur la biopsie de nerf sural (avec de fréquentes formations en « bulbe d’oignon »), le profil électrophysiologique s’avérait plutôt mixte (avec des amplitudes diminuées et des VCN peu ralenties) [104]. Figure 1 : Biopsie nerveuse, CMT1A. Micrographie électronique, section transversale. Raréfaction très sévère des fibres myélinisées ; prolifération intense de cellules de Schwann autour de quelques fibres myélinisées restantes ; l’axone myélinisé de gauche a une gaine de myéline trop fine par rapport à son diamètre axonal. 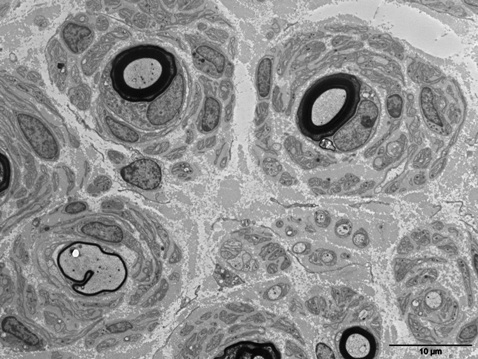 Figure 1 Figure 2 : biopsie nerveuse, CMT1A. Micrographie électronique, section transversale. Lésion tomaculaire caractérisée par une épaisseur anormalement importante de la gaine de myéline qui comprime l’axone. 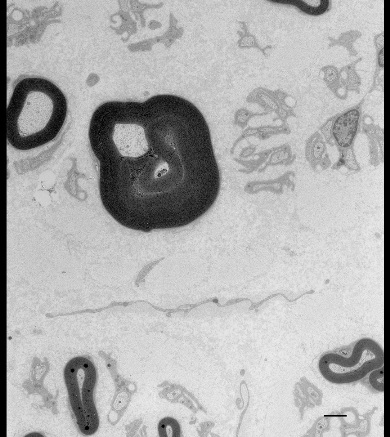 Figure 2 Tableau 1. Principales catégories de maladies de Charcot-Marie-Tooth (CMT).
Tableau 2. Principales caractéristiques des différentes formes de CMT1.
REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647