
|
|
|
CASE REPORT / CAS CLINIQUE
LE XANTHOASTROCYTOME PLEOMORPHE ANAPLASIQUE – A PROPOS D’UN CAS
PLEOMORPHIC XANTHOASTROCYTOMA - ABOUT ONE CASE
E-Mail Contact - BOUAZIZ Mourad :
mbouaziz@hotmail.com
ABSTRACT We report a case of anaplastic pleomorphic xanthoastrocytoma occurred in a male of 13 years, who presented a syndrom of intracranial hypertension for a year and a half. CT-scan and MRI revealed a cystic and solid tumor in the left parietal lobe. The surgical resection was total. Histopathological examination demonstrated a pleomorphic xanthoastrocytoma with malignant transformation. Seven months later, the patient has a deterioration of his general condition, the CT revealed a tumor recurrence, which was reoperated. The patient died a few days after surgery. This rare case of anaplastic pleomorphic xanthoastrocytoma is presented, discussed and illustrated in this paper. Key words: xanthoastrocytoma, surgery, recurrence. RESUME Nous rapportons un cas de xanthoastrocytome pléomorphe anaplasique chez un garçon de 13 ans. Il présentait un syndrome d’hypertension intracrânienne depuis un an et demi. L’imagerie a visualisé une lésion à double composante kystique et charnue de localisation pariétale gauche. L’exérèse chirurgicale a été totale. L’examen histologique a revélé un xanthoastrocytome pléomorphe anaplasique. Sept mois plus tard, le patient a présenté une altération de l’état général, et le scanner encéphalique a montré une récidive tumorale qui a été réopérée. Le patient est décédé quelques jours après l’intervention. Mots clés : xanthoastrocytome, chirurgie, récidive. INTRODUCTION Le xanthoastrocytome pléomorphe (XAP) a été décrit pour la première fois par Kepes en 1979 (7). Il s’agit d’une tumeur astrocytaire habituellement rencontrée chez l’enfant et l’adulte jeune. Il s’agit d’une tumeur sus-tentorielle, de localisation corticale superficielle essentiellement temporale ou temporo-pariétale (7). Nous rapportons un cas observé dans notre service. OBSERVATION Le patient B.C, âgé de 13 ans, originaire de Guelma, cadet d’une fratrie de 2 enfants, issu d’un mariage consanguin. Il a été transféré du CHU de Constantine. L’histoire de la maladie notait que le patient présentait des céphalées permanentes depuis 18 mois, évoluant par poussées rémission avec une installation d’un flou visuelle ces derniers mois. Les examens neuroradiologiques montraient à la TDM une image à double composante kystique et charnue cortico-souscorticale temporo-pariétale gauche, à limites irrégulières et rehaussée de façon inhomogène au produit de contraste avec foyers hémorragiques intratumoraux. A l’IRM, il a été visualisé une tumeur à double composante en T1 ; la partie charnue en hyper signal et la partie kystique en hypo signal. Un dème péri tumoral en séquence flair. L’effet de masse était évident (fig. 1, 2,3). 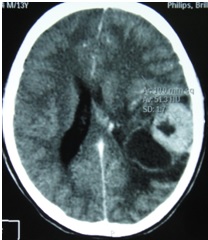 Figure 1 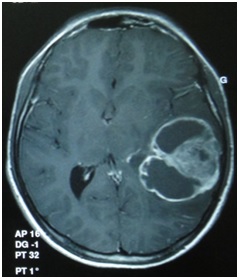 Figure 2 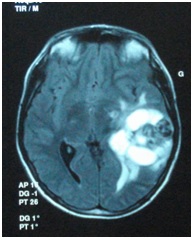 Figure 3 Le patient a été opéré. La tumeur présentait un plan de clivage peu net, de couleur grisâtre, friable, hypervascularisée, mal limitée, infiltrant parenchyme cérébral. Le contenu kystique était jaune citrin avec une gliose réactionnelle péritumorale. L’exérèse était totale (fig. 4 et 5). 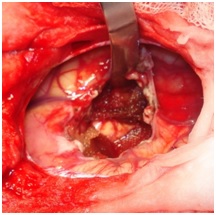 Figure 5 L’examen anatomopathologique a montré : une prolifération tumorale gliale astrocytaire pléomorphe comportant des aspects anaplasiques. Le néoplasme est fait d’un fond fusiforme constitué d’éléments atypiques allongés et parsemé de nombreuses cellules géantes multinuclées et de cellules de grande taille, peu nombreuses à cytoplasme vacuolisé. Des figures monstrueuses sont observées et les mitoses sont nombreuses (fig. 6). Absence de nécrose tumorale. Les vaisseaux ne comportaient pas de signes de prolifération endothéliocapillaire avec par endroits, des foyers hémorragiques riches en sidérophages. La glie adjacente était le siège d’une gliose modérée. L’étude immunohistochimique montrait une positivité modérée à la GFAP, positivité discrète à la synaptphysine et le Ki67 est assez élevé 15-25% (fig. 7). 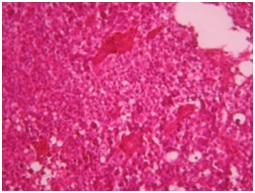 Figure 6 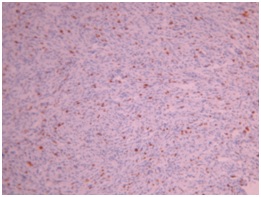 Figure 7 L’évolution a été simple. Le malade a été confié à la radiothérapie et bénéficié de 27 séances pour une dose totale de 50 gray. Sept mois après, la patient a présenté une altération de l’état général. La TDM a révélé une récidive tumorale (fig. 8). Malgré la réintervention, le patient est décédé quelques jours plus tard. L’anatomopathologie montrait une récidive. 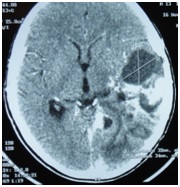 Figure 8 DISCUSSION Le XAP représente moins de 1% des tumeurs astrocytaires. Moins de 200 cas ont été rapportés dans la littérature (5). La première description de cette tumeur a été faite par Kepes (7) en 1979 avec une série de 12 cas. Le premier cas observé semble être antérieur, en 1930 (2). La localisation de la tumeur est souvent supratentorielle, 98% des cas selon Giannini (5) et une prédilection pour le lobe temporal (3, 5, 7, 11, 14,18). Des localisations cérébelleuses ont été décrites (10,16). Dans notre cas la localisation était temporo-pariétale. Il s’agit d’une tumeur de l’enfant et de l’adolescent (5, 11,14), la majorité des ces tumeurs étaient diagnostiquées avant l’âge de 18 ans (4), bien que le XAP puisse parfois être diagnostiqué beaucoup plus tardivement (13). La manifestation clinique la plus rapportée est la crise d’épilepsie (3, 5, 7, 11,14). Notre patient était âgé de 13 ans présentait un syndrome d’HIC, mais pas de crises d’épilepsie. A la TDM, le XAP est en hypo ou isodense et peut être, bien ou mal limitées. Un petit dème entoure la tumeur. Les calcifications sont rares. Grâce à sa localisation superficielle, il peut causer des lésions de l’os sus-jacent (9). A l’IRM, en T1, il est en iso ou hyposignal avec un réhaussement de la partie charnue à l’injection de Gadolinium. La composante solide de la tumeur augmente l’éclat des leptoméninges dans plus de 70% des cas. En T2, il est iso ou hyperintense entouré d’un petit dème péri tumoral (9). Le XAP est une tumeur d’origine astrocytaire (3, 5, 7, 11, 14), pour laquelle est retrouvée souvent une attache leptoméningée. Elle était absente dans notre cas. Il s’agit d’une tumeur qui associe un polymorphisme cellulaire, avec une coexistence de cellules astrocytaires parfois multinuclées, xanthomateuses (aspect dû à la présence de vacuoles lipidiques intracytoplasmiques) (8). Ces cellules présentent une positivité à la GFAP. Il s’y associe un réseau réticulinique intercellulaire dense (important pour le diagnostic), avec parfois la présence d’un infiltrat lymphocytaire et de corps granuleux éosinophiles. Elle peut dans certains cas être confondue avec un gliome de haut grade (11). En effet, certains constituants habituellement retrouvés dans le XAP peuvent se rencontrer (à un degré moindre cependant) dans le gliome de haut grade et le glioblastome à cellules géantes. L’ultrastructure des cellules tumorales peut alors permettre d’ajuster le diagnostic par la présence des agrégats, de lysosomes secondaires et les corps granuleux éosinophiles. Des aspects de nécrose et quelques mitoses peuvent s’observer. Parfois, une différentiation neuronale peut être présente (6, 11). Dans notre cas, l’étude histologique a permis d’établir le diagnostic. L’origine du XAP est discutée. L’hypothèse d’une tumeur développée à partir des astrocytes de la couche sous-piale (7) n’est pas certaine, car la présence de membrane basale peut être observée également dans le glioblastome. Boldorini et al. (1) ont mis en évidence, au sein de la tumeur d’un enfant de 9 ans, plusieurs régions génomiques du virus JC par la technique de PCR (polymerase chain reaction). La génétique est encore mal connue. Les éventuelles altérations génomiques pouvant concourir à la formation du XAP semblent néanmoins différentes de celles impliquées dans la tumorogénèse des astrocytomes de bas grade (15). Yin formule l’hypothèse d’une localisation au niveau des chromosomes 7 et 8 de gène pouvant être impliqués dans la genèse du XAP (17). Le traitement admis naturellement est la chirurgie avec pour but une exérèse totale (7, 11, 14, 18), d’autant qu’il existe généralement un plan de clivage entre la tumeur et le cerveau. Dans notre cas l’ablation tumorale était totale. La plupart des auteurs recommandent de ne pas utiliser la radiothérapie comme traitement adjuvant (11). Nous avons tenté une radiothérapie et 45 grays ont été délivrés. Ces séances n’ont pas apporté une amélioration de l’état du patient. Le pronostic est généralement favorable (3, 11, 14, 18). Pour Giannini (5), le taux de survie est de 81% à 5 ans et de 70% à 10 ans. De même, le pronostic fonctionnel (disparition des crises) est très favorable. Le XAP est une tumeur susceptible de récidiver, notamment sur un mode agressif. Notre cas a récidivé, et malgré la reprise chirurgicale, le décès est survenu dans les jours suivant le geste opératoire. CONCLUSION Le xanthoastrocytome pléomorphe est une tumeur astrocytaire rare, affectant surtout l’adulte jeune. Elle est caractérisée par une topographie superficielle, corticale, essentiellement temporale, envahissant les leptoméninges. Le diagnostic repose à la fois sur des aspects histologiques précis et bien définis, mais d’autres facteurs peuvent concourir à celui-ci et doivent être pris en compte : l’âge du patient, la localisation tumorale, l’aspect iconographique de la lésion et la clinique. La chirurgie est le traitement de choix. Le pronostic favorable est la règle. Le risque imprévisible de transformation maligne rend la surveillance clinique et iconographique à long terme indispensable. REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647