
|
|
|
CASE REPORT / CAS CLINIQUE
MENINGO-ENCEPHALITE AMIBIENNE PRIMITIVE CHEZ UN JEUNE ADULTE APRES ACCIDENT DE PLONGEE
PRIMITIVE AMOEBIC MENINGOENCEPHALITIS IN A YOUNG ADULT AFTER ACCIDENT OF DIVING
E-Mail Contact - BOUKASSA Léon :
lboukassa@hotmail.com
RESUME Les méningo-encéphalites primitives (MEAP) sont des infestations de l’encéphale et de ses enveloppes par une amibe libre appelée Naegleria fowleri. Il s’agit d’une affection hydrique rare et grave qui est contractée par les enfants et les adultes jeunes lors d’un bain dans une eau douce contaminée. Nous rapportons un cas de cette affection chez un adulte de 46 ans qui avait été admis pour céphalées, fièvre et crises convulsives. Ce tableau était apparu 10 jours après un traumatisme crânio-encéphalique avec perte de connaissance initiale dans un contexte d’accident de plongée dans un étang. L’examen clinique avait conclu à un syndrome méningé fébrile. Le scanner crânio-encéphalique avait mis en évidence un œdème cérébral diffusL Le liquie cérébro-spinal (LCS) trouble obtenu par ponction lombal avait objectivé des globules blancs à 770 éléments, les protéines 3,6g/l, le glucose à 0,45 g/l et surtout la présence d’amibes à l’examen direct. Traitée avec de l’Amphotéricine B en IV, l’évolution s’est faite vers le décès au troisième jour d’hospitalisation. En l’absence du test de flagellation, la notion de baignade dans un étang, le tableau clinique, la présence des amibes à l’examen direct et l’évolution rapide vers le décès, nous ont fait retenir le diagnostic de méningo-encéphalite primitive à Naegleria fowleri. Mots clés : Méningo-encéphalite, amibes, Naegleria fowleri. ABSTRACT Primitive meningoencephalitis (MEAP) is an infestation of the brain and its envelopes by a free amoeba called Naegleria fowleri. It is a rare and serious water condition that is contracted by children and young adults while bathing in contaminated fresh water. We report a case of this condition in a 46-year-old adult who admitted to headache, fever and seizure. This signs appeared 10 days after a cranio-encephalic trauma with initial loss of consciousness, by a dive accident in a pond. The clinical examination concluded that there was febrile meningeal syndrome. The cranio-encephalic CT had demonstrated a diffuse cerebral edema. In the CSF obtained by a lumbar puncture there were blood cells to 770 elements, proteins 3.6 g / l, glucose to 0.45 g / l and amoebae on direct examination. In spite of a treatment with Amphotericin B in IV, the patient died on the third day of hospitalization. In the absence of the flogging test, the notion of bathing in a pond, the clinical status, the presence of amoebae at a direct examination and the rapid evolution towards death, made the diagnosis of meningo- primitive encephalitis to Naegleria fowleri. Key words: Meningoencephalitis, amoeba, Naegleria fowleri. INTRODUCTION Les méningo-encéphalites primitives (MEAP) font partie des infestations de l’encéphale et de ses enveloppes par des amibes libres ou telluriques [7]. Ces amibes libres se différencient des amibes intestinales par le fait qu’elles peuvent accomplir la totalité de leur cycle dans la nature sans recourir à un d’hôte [7,13]. Appelées aussi amibes amphizoïques, elles ont une répartition ubiquitaire et sont pathogènes dans les espèces suivantes : Naegleria fowleri responsable de La MEAP et, Acanthamoeba sp et Balamuthia mandrillaris à l’origine de l’Encéphalite Granulomateuse Amibienne (EGA) et de la Kératite amibienne [7,13]. La pathogénie de Naegleria fowleri a été rapportée pour la première fois en 1965 par Fowler et Carter en Australie [9,18]. La contamination de l’homme sain, immunocompétent, se fait souvent lors d’un bain en eau douce, tiède et stagnante, réservoir naturel de ces amibes libres. Les fosses nasales constituent la porte d’entrée [4,7,12]. Il s’agit d’une affection dont l’intérêt réside dans sa rareté et sa gravité extrême. Nous rapportons un cas observé dans notre service. OBSERVATION Un patient de 45 ans, résident malien au Congo depuis 7 ans, admis pour céphalées vomissements, fièvre puis crise comitiales, évoluant depuis 03 jours. Il avait été victime dix jours avant d’un traumatisme crânien avec une brève perte de connaissance initiale, suite à un accident de plongée lors d’une baignade. Suite à ce traumatisme, il avait bénéficié des soins locaux de la plaie frontale, une sérothérapie et un traitement antalgique. Il était sans antécédent pathologique particulier. L’examen physique avait permis de noter un trouble de la conscience (score de Glasgow à 10), une fièvre à 38°7, une raideur de la nuque avec les signes de Kernig et Brudzinski présents. La pression artérielle était à 114/62 mm Hg, le pouls à 98 pulsations/mn. Le scanner crânio-encéphalique avait montré un dème cérébral diffus (Figure 1). Aucun épanchement intracrânien était retrouvé et les ventricules étaient légèrement collabés. Au niveau sanguin, la glycémie était à 0,95 g/l, le taux d’hémoglobine à 10 g/dl, les leucocytes à 11000 GB/mm3, la CRP à 110 mg/l et la sérologie rétrovirale était négative. Le liquide cérébro-spinal (LCS) était trouble et contenait 770 leucocytes à prédominance lymphocytaire, 3,5 g/l de protéine, 0,40 g/l de glucose et des amibes à l’examen direct et après coloration à l’Hématoxyline Eosine (Figures 2 et 3). L’examen bactériologique direct et après culture était négatif. Le traitement a comporté du phénobarbital, Ceftriaxone et Gentamicine à l’arrivée. Les difficultés d’acquisition des antiamibiens par voie générale, nous ont fait débuter le traitement à l’Amphotéricine B avec un retard de 48 heures. L’état clinique du patient, chez qui persistait le syndrome méningé, s’était progressivement dégradé avec aggravation du trouble de la conscience (coma avec un score de Glasgow à 6) et de la fièvre à 39°, le pouls était à 120 pulsations/mn, la pression artérielle à 100/60 mm de Hg. Le bilan biologique avait montré une hyperleucocytose à 13.000 GB/mm3, une glycémie à 1,02 g/l, une créatinine à 15 mg/l ; la CRP à 102 mg/l. A J3 d’hospitalisation le patient, toujours fébrile à 40°, et a installé progressivement un tableau de choc septique et l’évolution a été défavorable. COMMENTAIRES La consultation neurochirurgicale de ce patient a été motivée par la suspicion d’un hématome sub-dural devant le tableau neurologique apparu 10 jours après son traumatisme crânio-encéphalique avec perte de connaissance initiale. Si la relation entre traumatisme crânio-encéphalique et MEAP est difficile à établir, la perte de connaissance brève lors de son traumatisme a pu être à l’origine d’une inhalation d’une certaine quantité de cette eau. Cette circonstance de contamination a été rapportée par Gyori [8] chez une victime d’un accident de jet ski. L’étang, lieu très probable de la contamination de notre patient, est comme le marais, les piscines mal entretenues, la terre humide, un milieu à contenu propice au développement des amibes libres. Ce mode de contamination fait de la MEAP une maladie hydrique [7]. Des contaminations à partir des eaux domestiques et même en dehors de pays tropicaux sont de plus en plus rapportées [7,11]. L’extension de ces zones de contamination serait une des conséquences du changement climatique [18]. Le bain n’est plus le seul moyen de contamination, des irrigations nasales dans le cadre des rituels religieux ou traditionnels sont également incriminées [4,14,21]. Le Naegleria fowleri existe sous trois formes : végétative sa forme active, la forme flagellée qui est son état intermédiaire et, la forme enkystée qui est sa forme de résistance et non infectieuse. Le problème du nombre réduit de ces infestations se pose malgré le fait que les amibes libres sont retrouvées dans une zone géographique débordant largement les tropiques. Le rôle protecteur de l’immunité humorale de ces populations a été évoqué par certains auteurs [5,6]. La maladie surviendrait dans le cadre d’une défaillance de cette immunité, comme le cas rapporté par Jaffar-Bandjee [9] chez un enfant aux antécédents d’adénoïdectomie et de paracentèse. D’autres ont trouvé une réponse immunitaire inconstante dans les populations étudiées [12,20]. Les études tendant à explorer cette immunité sont de réalisation difficile car confrontées à la rareté des cas. La maladie surviendrait chez des enfants et des adultes jeune immunocompétents contrairement aux autres amibes libres. Les fosses nasales représentent la seule porte d’entrée pour tous les auteurs. Au contact de la muqueuse nasale, ces amibes entrent dans cavité crânienne en suivant les filets olfactifs qui passent par la lame criblée de l’éthmoïde [7,12,18]. Dans l’encéphale et ses enveloppes, leur présence induit un recrutement important des leucocytes par les macrophages. Ces acteurs de l’inflammation vont libérer en grande quantité des substances destructrices de tissus à l’origine d’une importante réaction démateuse [1]. Ces amibes vont également être à l’origine de la nécrose hémorragique du tissu nerveux. Les lésions vont se localiser préférentiellement au niveau des parties basales du cerveau [12]. En dehors de ces effets, ces amibes dans leur forme enkystées, peuvent offrir refuge à d’autres agents pathogènes comme les bactéries, les virus et les champignons, dont la co-infection serait une autre explication à la gravité de cette affection [3]. La MEAP avec 440 cas rapportés de 1962 à 2015 est une affection rare [17]. Après une période d’incubation dont la durée varie de trois jours à 3 semaines, surviennent les symptômes de la maladie [4,7,12]. Le tableau clinique identique à celui des méningo-encéphalites bactériennes non spécifiques, explique son retard diagnostic et, par conséquent thérapeutique. Aux USA, ce diagnostic n’a été posé avant le décès des patients que dans 27% des cas [4]. Pour le diagnostic de ces MEAP, l’imagerie médicale moderne (TDM, IRM) n’est pas contributive. Elle ne montre que des lésions non spécifiques à type d’hypodensités associées ou non à des hémorragies, d’dème cérébral diffus ou d’hydrocéphalie [7,8]. Cette imagerie trouve surtout son intérêt dans l’élimination des contre-indications de la ponction lombale, comme l’hématome sub-dural chez notre patient ou les suppurations intracrâniennes. Le LCS qui est d’un apport important. L’examen direct, quand il fraichement prélevé et conservé à une température de 25° environ, permet de faire très rapidement ce diagnostic. Il s’agit d’une procédure facile et peu coûteuse, qui met en évidence le protozoaire (parasite) mobile, comme chez notre malade [2,15,20]. Le test de flagellation réalisé par la suite, permet de différencier le Naegleria fowleri responsable de La MEAP qui fait apparaitre une flagelles, d’Acanthamoeba sp et de Balamuthia mandrillaris à l’origine de l’EGA chez lesquels ce test est négatif [7,20]. Des cultures sur Gélose à 2%, enrichie d’une suspension d’E. Coli tués, peuvent également être réalisées. La recherche des antigènes solubles est un très bon examen mais, moins sensible que les PCR. Ces derniers sont devenus des examens courants dans certains laboratoires [4,7,13]. Ces examens peuvent se faire également sur des biopsies cérébrales faites lors des autopsies [4,7,20]. Sur le plan thérapeutique, des succès ont été obtenus en traitant ces patients tôt avec des associations médicamenteuses [7,17]. C’est le cas de l’association Amphotéricine B, Fluconazole et Rifampicine [19] pendant 21 jours, utilisée par Sood [17] et qui a été à l’origine d’une amélioration clinique au 5ème jour de traitement. L’auteur attribue ce bon résultat au fait que la prise en charge diagnostique et thérapeutique était rapide. Eviter des bains en eaux douces douteuses, porter les masques de protection ou les pinces nasales, surveiller les piscines et traiter les eaux domestiques à l’eau de javel, produit efficace sur toutes ces amibes, sont des mesures préventives qui peuvent être conseillées aux populations à risque et aux touristes [7,10,16]. CONCLUSION La MEAP est une affection grave dont la clinique ne présente aucune particularité, et le diagnostic de certitude peut être fait à l’examen direct. Cependant, sa rareté qui contraste avec la distribution ubiquitaire des parasites en fait probablement une affection sous diagnostiquée. Il est donc important de l’évoquer, devant une méningo-encéphalite purulente avec négativité des examens bactériologiques. 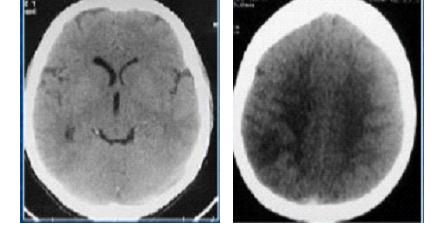 Figure 1 : TDM en coupes axiale sans injection : Œdème cérébral diffus 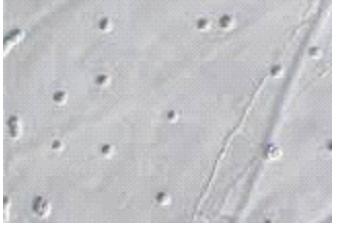 Figure 2 : Examen direct LCS : Mise en évidence des kystes d’amibes libres (x40) 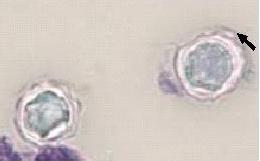 Figure 3 : Kystes d’amibes libres dans le LCS après coloration à l’hématoxyline Eosine (x100) (Flèche noire) REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647