
|
|||||||||||||
|
ORIGINAL PAPERS / ARTICLES ORIGINAUX
RADIOCHIRURGIE DES MALFORMATIONS ARTERIO-VEINEUSES DU TRONC CEREBRAL
STEREOTACTIC RADIOSURGERY FOR BRAINSTEM ARTERIOVENOUS MALFORMATIONS
E-Mail Contact - FAYE Mouhameth :
fayeneurochir92@gmail.com
RESUME Introduction Matériels et méthodes Résultats Conclusion Mots clefs: malformations artério-veineuses, tronc cérébral, radiochirurugie ABSTRACT Introduction Methods Results Conclusion Key words: arteriovenous malformations, brainstem, radiosurgery. INTRODUCTION Les malformations artério-veineuses ou angiomes cérébraux sont des anomalies vasculaires congénitales qui se définissent par la présence d’une communication (shunt) artério-veineuse anormale. Le shunt artério-veineux s’effectue au sein du nidus par une ou plusieurs connections artériolo-veinulaires sans interface capillaire entrainant une diminution des résistances vasculaires responsable d’une artérialisation de la (des) veine(s) de drainage qui reçoit(ven.) t précocement du sang artériel à haute pression [2,4, 20, 23, 32]. Elles sont diagnostiquées dans les deux sexes autours de la 3ème et 4ème décade de la vie, avec une incidence variable de 1/100.000 [2, 4,32]. Les malformations du tronc cérébral représentent environs 1-13% de l’ensemble des MAV [11, 21, 22,32]. Certaines localisations comme le tronc cérébral et les ganglions de la base constituent un vrai challenge sur le plan chirurgical au vu des risques encourus par les patients [19, 23, 31, 33]. Ces difficultés liées à leur exérèse microchirurgicale amènent certains auteurs à les considérer comme inopérables [14]. Les localisations profondes comme les ganglions de la base et le tronc cérébral ont une histoire naturelle plus agressive avec un risque hémorragique de 10-34% par an contre 2-4% pour les autres localisations [5, 32]. Le principal mode révélation est une hémorragie dans 75 – 91% selon les séries contre environ 50-67% pour les autres localisations et une mortalité d’environ 62% [3, 30,32] d’où la nécessité d’un traitement curatif. La radiochirurgie est une modalité thérapeutique qui a une bonne tolérance avec cependant un taux d’oblitération possiblement inférieur aux autres localisations [11, 13, 15, 16, 21,22]. L’embolisation est souvent considérée comme un traitement complémentaire de la radiochirurgie, elle ne permet une oblitération complète que dans 15% des cas [8, 21,22]. Dans la littérature les études concernant les MAV du tronc cérébral sont rares avec des cohortes peu significatives [9, 10, 11, 12, 114, 26,31]. L’oblitération totale en une ou plusieurs procédures radiochirurgicales varie entre 50-76% et nécessite un délai de 2 à 5 ans avec durant cette période la persistance du risque hémorragique [11, 13, 14, 21,22 ,26]. Outre le défi qu’implique la prise en charge de ces malformations, il est intéressant de pouvoir prédire le résultat du traitement pour en informer les patients. Le grading de Spetzler – Martin est adapté pour la microchirurgie. Pour la radiochirurgie, il est intéressant d’utiliser le score prédictif RBAS (radiosurgery based AVM score) publié par Pollock [25]. L’objectif de ce travail rétrospectif est d’analyser le taux d’oblitération pour les patients traités pour une malformation du tronc cérébral dans le service de radiochirurgie de la Timone / Marseille et de le mettre en relation avec ce score prédictif. Nous avons choisi ce groupe car cette localisation est pondérée à 1 dans la formule du calcul du score RBAS (radiosurgery based AVM score) alors que les autres localisations sont pondérées à 0. METHODES 1- Patient Entre Janvier 1992 et Décembre 2010, 1557 patients ont été traité par radiochirurgie pour une malformation artérioveineuse cérébrale dont 61 étaient (3.91%) localisées au niveau du tronc cérébral. Le sexe ratio était de 38 hommes pour 23 femmes avec un âge moyen de 35.8-/+16.6 ans (4-75). Dans cette cohorte de 61patients, 16 patients avaient bénéficié d’une embolisation préradiochirurgicale (26.23%) et 7 patients (11.47%) avaient eu une chirurgie d’exérèse partielle et 2 patients avaient eu une irradiation antérieure (3.3%). Le mode de découverte était une hémorragie pour 53 patients (87%), des troubles neurologiques pour 7 patients (diplopie, névralgie, céphalées occipitales, vertige) (11.47%), fortuit pour 1 patient (1.63%). Parmi les patients ayant eu une hémorragie, 36 patients présentaient un déficit neurologique le plus souvent à type d’hémiparésie ou de diplopie en rapport avec la localisation ou l’étendu l’hématome. La malformation était associée à un anévrysme intranidal chez 3 patients. Le grading de Spetzler-Martin était de II pour 4 patients (6.55%), de III pour 28 patients (46%), de IV pour 16 patients (26.23%) de V pour 13 patients (21.31%). Le score de Pollock-Flickinger modifié a été utilisé pour évaluer le grading de la malformation et calculé avec la formule suivante: Score = (0.1) (volume en cm3) + (0.02) (âge en années) + (0.5) (localisation: tronc cérébral = 1). Les indications de traitement par radiochirurgie gammaknife ont été validées de façon collégiale par une équipe multidisciplinaire incluant des neurochirurgiens, des radiothérapeutes, des neuroradiologues interventionnels. 2-Traitement La procédure comportait en premier lieu la pose d’un cadre de stéréotaxie (Leksell) sous anesthésie locale et protocole antalgique. L’imagerie en condition stéréotaxique comportait : une IRM avec séquence pondérée en T1 millimétrique avec gadolinium et une séquence pondérée en T2 coronal ; une tomodensitométrie cérébrale injectée ; et une artériographie cérébrale. Les enfants étaient sous anesthésie générale pendant toute la procédure. Pour les traitements informatisés (61), l’imagerie stéréotaxique a été localisée dans le logiciel Gamma Plan et d’éventuelle imagerie antérieure coregistrées. Sur 61 dossiers, 57 ont été planifiées avec un logiciel informatique permettant de calculer le volume moyen de traitement qui était de 1.43+/-1.96 cm3 (0.09-14.20). Le score RBAS était en moyenne de 1.36 +/-0.34 (0.64-2.35). Le contourage avait pour objectif de cibler le pied de la veine de drainage et le nidus. La dose moyenne de prescription à l’enveloppe isodose 50% délivrée était de 22.9 +/-2.9 Gy (12-30), la dose médiane était de 24 Gy. Le nombre moyen d’isocentre était de 3 (1-12). Tableau 1. 3- Analyse statistique La totalité des facteurs pouvant avoir une incidence sur l’oblitération de la malformation, les saignements après la procédure ainsi que la survenue de complications ont été analysé avec le logiciel statistique software SPSS 10 de Windows. Les paramètres avec un p < 0.05 étaient statiquement signifiants. 4-Résultats Parmi les 61 patients, 4 patients ont effectué un suivi à l’étranger pour lequel nous n’avons pas pu récupérer de données de suivi. Sur les 57 patients restant, 3 patients (4.9%) sont décédés dans les 2 ans qui ont suivi le traitement dont un par suicide à 6 mois, un d’une hémorragie de sa MAV et 1autre d’un carcinome rénal. 2 (3.27%) autres patients sont considérés comme perdus de vue, et une patiente n’a pas refait d’imagerie et vit en institut. Sur les 55 patients restants, le délai moyen de suivi est de 56.7 mois+/-43.3 (8.1-251.7). 4-1 : Oblitération L’oblitération après traitement était évaluée par l’artériographie (absence de nidus et d’une veine de drainage) et par une IRM à défaut en cas de refus de la part du patient. Au total sur 58 patients suivis décès inclus 26 patients ont une oblitération complète (44.83%) confirmées par artériographie et 4 par IRM avec un délai de 42.7+/-42.5 mois (8.1-251.7) en moyenne après la première procédure. Pour le reste des patients avec une oblitération incomplète confirmées par artériographie et ou IRM une autre procédure de radiochirurgie a été proposée. Sur les 25 patients qui ont accepté cette stratégie, 12 ont eu une oblitération complète, 8 restent occlus partiellement après 3 ans de suivis et 5 n’ont pas encore de suivi suffisant pour conclure. Parmi les 16 patients suivis ayant eu une embolisation, 9 patients (56.25%) ont oblitéré leur MAV après le traitement. Après analyse statistique, les facteurs en rapport avec une oblitération complète étaient les MAV de siège pédonculaire qui ont un taux d’oblitération de 54.5% contre 47.8% pour celles mésencéphaliques avec un p=0.048, un score RBAS <1.5 (p= 0.012), une dose supérieure à 20Gy (p=0.034). La rupture de la MAV avant le traitement avec un p = 0.0522 n'était pas un facteur qui influence l'oblitération du nidus dans notre travail comme le rapporte Dale Ding [3] dans sa série de malformations de grade III toutes localisations confondues. 4-2 : Retraitement Le délai moyen entre la première et la seconde procédure est de 37.45 mois. Le volume moyen de traitement était de : 1.21 cm3 (0.7-3.97cm) La dose moyenne de prescription à l’isodose de 50% était de 20.54Gy (12-25), et la dose médiane de 16Gy. Après une ou deux procédures dans notre centre, 37 patients ont occlus leur MAV sur 55 patients suivis (décès exclus), soit taux d’occlusion complète de 67.27%. Le score RBAS moyen des 3 patients décédés potentiellement d’une rupture de leur MAV était de 1.75. Le score moyen des MAV oblitérées était de 1.23+/-0.3 (0.64-1.90). Le score moyen des MAV non oblitérées était de 1.42+/-0.34 (0.70-2.35). 4-3 : Hémorragie post-thérapeutique Parmi les 3 patients décédés, un décès est due à une rupture de MAV à 1.5ans, 2 autres décès survenus à 1 et 1.5 ans ont été classés de causes inconnues mais pourraient être dans l’incertitude lié aussi à une rupture de leur MAV. Ce qui ferait un taux de mortalité lié à une hémorragie de 1.63 à 4.9. %. Parmi les 55 patients suivis, 4 ont présenté une hémorragie avec nouveau déficit neurologique à 4, 8, 10 et 11 ans d’une première procédure gammaknife. Ce qui fait un taux d’hémorragie de 7.27%. Les facteurs en rapport avec une hémorragie post radio chirurgicale étaient essentiellement un en rapport avec la taille du nidus. La totalité des patients ayant saigné ou chez qui un saignement avait était suspecté avait un score RBAS moyen de 1.75. (p= 0.038). D’autres facteurs comme la localisation superficielle et drainage veineux unique sont souvent liés à une hémorragie après traitement [3]. Dans notre analyse statistique l’architecture de la malformation n’était pas un facteur prédictif de saignement après procédure. (p=0.0623). 4-4 : Complications Deux patients (3.27%) ont présenté des effets radio induits symptomatiques. Ces patients avaient sur l’IRM une prise de contraste en cocarde sur les séquences pondérées en T1 associée à un hyper signal périlésionel sur les séquences pondérées en T2. Pour l’un des patients, ces effets sont survenus à 8 mois après une 3ème procédure de radiochirurgie sur une MAV du tronc cérébral latéro-pédonculaire gauche. L’autre patient a présenté 7 mois après la 2ème procédure de radiochirurgie d’une malformation artério veineuse de type V de Spetzler trans mésencéphalique, une diplopie avec un syndrome de Arnaud, une ophtalmoplégie internucléaire, et rapportait des douleurs névralgiques. L’évolution a été marquée par l’apparition d’une hydrocéphalie 2 mois après le début de ces nouveaux symptômes. Celle-ci était due à une occlusion de l’aqueduc de Sylvius, et a été opéré par ventriculo-ciscternostomie(VCS). Tous les patients ont eu des traitements par corticoïdes pendant plusieurs mois. Ces nouveaux déficits étaient résistant aux corticoïdes et permanent après au moins 2ans de suivis. Dans notre travail le risque d’effets radio-induits était essentiellement lié au volume de traitement élevé p= 0.048 ; le volume moyen de traitement des deux patients ayant fait des effets radio-induits était de 7.9 cm3 lors du second traitement et surtout la survenue antérieure d’un traitement par rayons. DISCUSSION Dans notre série l’âge moyen au diagnostic était de 35 ans comparables aux séries de Ding [3] Kano [9, 10] qui avaient une moyenne à 31 ans de moyenne d’âge. Les malformations du tronc cérébral comme celles des ganglions de la base ont une histoire naturelle plus agressive. Leur risque hémorragique et leur morbi-mortalité est largement supérieur autres localisations [3, 11, 32]. Dans les séries de Kano [9, 10], le taux d’hémorragie est de 76% et 85%, Kiran [11] rapporte un taux de 81% de saignement au diagnostic. Dans notre étude 87% des patients ont saignés à une ou plusieurs fois avant le traitement ; ce taux est largement supérieur au 64% de Potts et al. [27, 28]. Le traitement des malformations cérébrales en zone éloquente et profonde en particuliers au niveau du tronc cérébral est difficile et reste un challenge [27, 29, 31]. La radiochirurgie est une technique qui comporte moins de risque que la microchirurgie dans ces localisation [14, 22,26] mais nécessite en revanche un délai d’action de plusieurs années. Une stratégie combinée par chirurgie puis par radiochirurgie en cas de résidu peut aussi s’envisager [29]. Potts et al.[27] propose en première intention la chirurgie par un abord trans-sylvien pour les patients jeunes avec une MAV des ganglions de la base rompue , une taille de nidus supérieur à 3cm et porteur d’un déficit neurologique pour réduire dans un premier temps le volume de la lésion et secondairement faire une radiochirurgie permettant un taux d’oblitération de 78% contre seulement 71% et 23% pour chaque technique isolée. Gross et al. [7] indique que la chirurgie reste un traitement de choix pour les MAV thalamiques et des ganglions de la base permettant de l’exérèse complète du nidus dans 91% des patients avec une mortalité de 2.4% ce qui n’est pas envisageable pour le tronc cérébral selon Yasargil [33] au vu des complications. Pour les MAV situées au niveau du tronc, la chirurgie semble inacceptable. Elle est indiquée initialement avec un objectif d’évacuation d’un hématome responsable d’une symptomatologie clinique, l’exérèse de la MAV s’effectuant en même temps et secondairement en cas de résidu, la radiochirurgie permet de tendre vers l’oblitération [9, 10, 14, 26]. Dans toutes les séries publiées pour les MAV profondes le pourcentage d’oblitération complète sur embolisation seule ne dépasse pas 15% [8, 15] avec une morbidité pouvant atteindre 40%. Dans la stratégie de prise en charge de ces MAV, l’embolisation permet de diminuer parfois le volume du nidus, de ralentir le débit. Il est nécessaire ensuite de compléter la prise en charge par une radiochirurgie pour augmenter les chances d’oblitération [11, 12, 21, 26]. L’inconvénient est parfois la difficulté de visualisation du nidus masqué par le produit d’embolisation (Onyx), ce qui a une conséquence de sous couvrir certaine zone de la MAV et donc de diminuer le taux d’oblitération. Il est donc préférable dans le cas de MAV de faible volume de proposer une radiochirurgie en première intention même si l’embolisation est possible partiellement [12, 13, 17,18]. L’artériographie cérébrale est la méthode de référence pour juger d’une oblitération complète. Elle a pu être réalisée pour 93% de nos patients. Les patients refusant cet examen ont eu une IRM qui est concordante avec l’artériographie dans 90% des cas selon Pollock et al. [26] et H. Kano [9,10]. Le pourcentage d’oblitération après radiochirurgie pour les malformations du tronc cérébral, des ganglions de la base et le thalamus après une procédure varie entre 23 à 70% selon les données de la littérature. A 3 ans de suivi Potts et. al [28] notait une oblitération complète de 23% sur 42 patients traité uniquement par radiochirurgie ce pourcentage passait à 45% à 5ans et 63% après une 2ème procédure. Kurita [13] rapporte dans sa série de 27 patients de MAV du tronc une oblitération totale à l’artériographie de 44% à 3 ans. Massager et al [16] retrouve un taux de 52% à trois ans. Kano [10] dans sa série de 67 patients de MAV du tronc cérébral rapporte un taux de 41%, 70% et 76% à 3, 5 et 10 ans respectivement après le premier traitement sur des données IRM. Pollock [26] rapporte une oblitération totale pour les MAV dans les ganglions de la base (10 cas), thalamus (30 cas), du tronc cérébral (16 cas) de 43% après 45 mois de suivi. Ce pourcentage pour les oblitérations complètes confirmées par IRM ou par artériographie associé après une ou plusieurs procédures était de 47% et 66% à respectivement 3 et 4 ans. Ces variations du taux d’oblitération semblent se plafonner après 5 ans, en effet dans la série de MAV du thalamus et des ganglions de la base le taux d’oblitération était de 57%, 70%, 72% et 72% à 3, 5, 7 et 10 ans respectivement sur des critères IRM Kano et all.[9,10]. Koga [12] rapporte un taux de 81% d’oblitération à 5 ans. Dans notre série, le pourcentage global d’oblitération était de 67.27 % pour les patients suivis. La différence que nous observons avec certaines séries pourrait être due aux possibles faux positifs des données d’IRM utilisées comme examen de référence [25,26]. Cette différence pourrait être expliquée par notre pourcentage de patient ayant eu une embolisation avant le traitement radiochirurgical plus élevé (26.23%) que d’autres séries (3% et 18% dans les deux séries de Kano [9,10]), or l’embolisation est un facteur pouvant réduire le taux d’occlusion après radiochirurgie [15]. Notre pourcentage de patients ayant présenté un saignement avant procédure dans notre étude est sensiblement égal aux séries de la littérature [9, 10, 11, 24, 25]. Or une MAV hémorragique semble un facteur prédictif de l’oblitération pour certains auteurs [3, 15, 17, 21, 22, 26] même si ce facteur n’est pas significatif dans notre travail. Les autres paramètres de traitement (dose, volume traitement, le nombre d’iso centres) ainsi que les autres caractéristiques de la malformation étaient presque similaires. Le score RBAS bas inférieur 1.5 est reconnu par tous les auteurs comme étant le principal facteur qui influence l’occlusion complète du nidus dans toutes les localisations possibles [3, 9, 12 ,25]. Ding et al dans sa série de malformations de grade de III de localisation sus et sous tentorielles [3] avaient retrouvé 69% d’occlusion complète en une procédure avec un RBAS bas. Pollock [25], une malformation avec un score RBAS inférieur à 1.5 (classe 1) a deux fois plus chance se s’occlure en une procédure que le classes 2 > 1.5. La dose prescrite en vue d’une efficacité optimale est en théorie de 24 Gy. Cependant en zone fonctionnelle ce qui est le cas du tronc et du thalamus et en fonction du volume de la MAV, la prescription est modulée à la baisse pour diminuer le risque d’effet radio-induit. Cela explique les limites inférieures de prescription dans notre série mais que l’on retrouve aussi dans la série de Kano [9,10] qui a une dose moyenne de 20 Gy (14-25.6) et dans la série de Potts [24] qui a une dose moyenne de 17 Gy (15-20). Pour Kano, une dose supérieure ou égale à 17Gy serait suffisante pour occlure une MAV profonde. Le risque hémorragique après traitement radiochirurgical est variable selon les séries entre 1.3-9.5%. Dans notre série, le pourcentage d’hémorragie était de 7.27% au dernier suivi. Il faut cependant noter que le risque est surtout présent durant les 2 premières années tant que la MAV n’est pas occluse. Trois patients sont probablement décédés d’une hémorragie dans les 2 ans qui ont suivis (3/57 : 4.9%). Le délai de survenue de cette hémorragie est variable la plupart des hauteurs rapporte une survenue précoce avant l’occlusion de la malformation. Ding et.al [3] rapporte une survenue précoce avant la fin de la deuxième année. Kano et .al [9,10] rapporte que le risque de saignement existe toujours tant que la malformation n’est pas guérie même si ce risque est plus élevé pendant les deux ans suivant le traitement. Dans notre étude trois (3) sur 4 ont saigné entre 8 et 11ans après le traitement. Potts et.al [29] retrouve 3.9% de resaignement après la radiochirurgie dans sa série un taux de mortalité de 4%. Kurita [11] rapporte dans sa série de MAV du tronc cérébral un risque de 4%. Kano [10] retrouve un taux de 1.9% de risque hémorragique avec une mortalité de 4.5%. Le traitement radiochirurgical malgré une tolérance prouvée par la plupart des auteurs est parfois source de complications à types d’effets radio-induits. Flickinger [6] rapporte que les patients porteurs d’une MAV profonde (thalamus, fosse postérieur) avaient plus de risque de développer des effets radio-induits que dans les autres localisations avec un coefficient passe de susceptibilité de 8.33 pour la fosse postérieure à 2.35 pour la région frontale. Massager [16] rapporte que ce risque de développer des phénomènes radio-induits qu’ils soient transitoires ou permanents était de 5%. Le risque de lésions secondaires permanentes liées au traitement pour les MAV des ganglions de la base et du tronc cérébral varie entre 4 à 11.9% selon les séries [1, 9, 10, 15, 26, 31]. Kano [10] dans sa série consacrée aux MAV du tronc, un taux de 10% et 6% de déficit permanent et transitoires respectivement. Ces effets sont corrélés à une dose élevée selon Flickinger [6] pour lui une dose de traitement supérieure à 12Gy est source de complications alors que pour Pollock [24,25] la dose efficace serait aux alentours de 18Gy et au-delà de 20Gy le risque d’effets radio-induits est majoré. Nos données sont cohérentes avec ceux de la littérature puisque nous retrouvons un risque de 3.27% d’effets radio-induits avec nouveaux déficits neurologiques permanents chez deux patients qui ont déjà eu des traitements radio chirurgicaux antérieurs. Il nous semble exister un effet cumulatif de dose responsable de ces effet radio-induits comme le rapporte Pollock [25]. Des kystes au niveau des zones irradiés sont souvent retrouvés après traitement radiochirurgical et sont le plus souvent asymptomatique Pollock [24,25]. CONCLUSION La radiochirurgie est maintenant devenue incontournable dans le traitement des malformations du tronc cérébral en raison des difficultés et des risques dus au traitement microchirurgical même s’il existe un risque hémorragique persistant jusqu’à la guérison (3.5% d’hémorragie après procédure). Le taux d’oblitération complète est de 67.27% confirmé par artériographie à 86.3% et le reste par une IRM. Malgré son innocuité apparente la radiochirurgie présente parfois des effets radio-induits (3.2%) avec des déficits pouvant être transitoires ou définitifs. La mortalité est de 1.63% après la procédure le plus souvent en rapport avec un resaignement. Les malformations les plus sensibles à la radiochirurgie sont celles avec un score RBAS bas traitées par de fortes doses, supérieurs à 20Gy. Tableau 1: paramètres du traitement radiochirurgical (parameters of radiosurgical traitment).
Figure 1 : 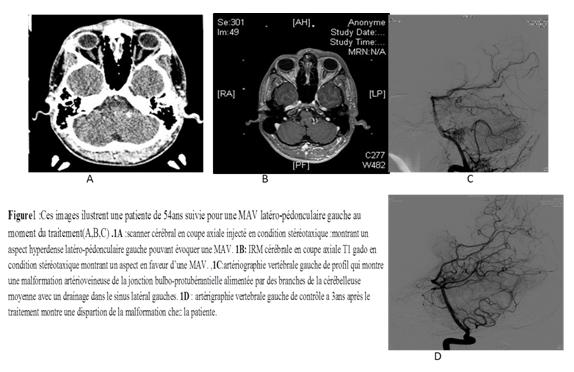 Figure 1 1A: Stereotactic injected brain scanner : showing an appearance suggestive of a AVM 1B: MRI: stereotactic brain in sequence T1 gado: showing in favor of a AVM 1C: Artegraphy, left vertebral stereotactic of profile which shows a mav of the bulbo-protuberantial junction fed by branches of the middle cerebellar artery with drainage in the lateral sinus. 1D: left vertebral arteriography of control 3 years of radiosurgical treatment which shows a complete disappearance of the AVM. Abréviations: RBAS : (radiosurgery based AVM score) MAV: malformations artério-veineuses. NB: Les valeurs avec un p < 0.05 sont statistiquement significatives. REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647