
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CLINICAL STUDIES / ETUDES CLINIQUES
TRAITEMENT DES HEMATOMES SOUS- DURAUX CHRONIQUES A LIBREVILLE (GABON) : REVUE DE 102 CAS
TREATMENT OF CHRONIC SUBDURAL HEMATOMAS AT LIBREVILLE (GABON): REVIEW OF 102 CASES
E-Mail Contact - MWANYOMBET OMPOUNGA Lucien :
ompoungalucien@yahoo.fr
RESUME Objectif Patients et Méthode Résultats Conclusion Mots clés : Hématome sous-dural chronique, traitement chirurgical, Gabon. ABSTRACT Objective Patients and Method Results Conclusion Key words: Chronic subdural hematoma, surgical treatment, Gabon. INTRODUCTION L’hématome sous-dural chronique (HSDC) de la convexité est une collection sanguine enkystée, occupant l’espace virtuel sous-dural entre l’arachnoïde cérébrale en dedans et la face interne de la dure-mère en dehors (2). Cet hématome se constitue sur plusieurs semaines, voire des mois, à la suite d’un traumatisme crânien généralement bénin, passé parfois inaperçu (2,3,8). Complication tardive post-traumatique fréquente, l’HSDC a déjà fait l’objet de nombreux travaux en Afrique subsaharienne, notamment à Dakar (12,16) et à Yaoundé (5). La tomodensitométrie (TDM) ou scanner cérébrale est l’examen indispensable au diagnostic (2,7). Le traitement de cette affection est avant tout neurochirurgical (1, 2, 3,4, 5,8,12,16,17). Le but de ce travail est de : METHODOLOGIE Cette étude rétrospective a été réalisée dans le service de Neurochirurgie de la Fondation Jeanne EBORI (FJE), à Libreville (Gabon), sur une période de 10 ans (Juin 1998 à avril 2008). La majorité des patients provenait de différents hôpitaux de Libreville, les autres de l’intérieur du pays et de la sous-région (Congo, Cameroun, Sao- Tome et Principe). Lorsque la présentation clinique évoquait un HSDC ou posait des problèmes de diagnostic différentiel, un examen morphologique était, bien entendu, effectué. Tous les patients ont bénéficié d’un bilan préopératoire comportant notamment : numération de la formule sanguine (NFS), glycémie, bilan de coagulation et bilan phosphocalcique, ionogramme sanguin, fonctions hépatique et rénale, sérologie rétrovirale au VIH, R-X poumons, ECG. L’intervention chirurgicale fut pratiquée en urgence ou programmée, selon le mode de présentation clinique et/ou les résultats du bilan paraclinique. Seuls les patients possédant un dossier médical complet et ayant bénéficié d’un suivi (clinique et tomodensitométrique) pendant au moins 3 mois après la chirurgie ont été retenus dans cette étude. RESULTATS Aspects généraux 102 des 160 cas d’hématomes sous-duraux chroniques (HSDC) observés remplissaient les critères d’inclusion précités. L’âge moyen de ces patients était de 58 ans, avec des extrêmes allant de 3 à 84 ans. La tranche la plus représentée allait de 60 à 65 ans (80%). 80,3% (82/102) provenaient des hôpitaux de Libreville, 14,7% (15/102) de l’intérieur du pays et 5% (05/102) de la sous-région. La prédominance masculine était nette : 82 hommes pour 20 femmes, soit un sexe ratio de 4/1. 46% des patients étaient des sujets retraités. La notion de traumatisme crânien mineur a été observée chez 65 patients (63,7%). 20 autres malades présentaient des antécédents de chutes-10 cas, traumatismes crâniens sévères par accidents de la voie publique (AVP)-4, agressions-4 et rixes-2. Une consommation d’alcool a été notée dans 66 cas (64,7%). Aucune notion de traumatisme crânien n’a été signalée chez 17 malades (16,6%). Présentation clinique La durée d’évolution de la symptomatologie avant l’hospitalisation a varié de 4 à 24 semaines (moyenne : 13 semaines). Les tableaux I et II résument respectivement la Examens complémentaires Deux (2) patients étaient diabétiques ; trois (3) séropositifs au VIH (2%). Il n’a pas été retrouvé de trouble de la coagulation. 98 malades avaient bénéficié d’un examen morphologique avant l’intervention chirurgicale, chronologiquement : angiographie cérébrale-19 (19,3%), TDM-76 (77,5%) et IRM-3 (3%). L’hématome sous-dural chronique était unilatéral 80 fois, bilatéral 22 fois. Il apparaissait hypodense-43 (56,6%), hétérogène (mixte)-17 (22,3%) ou isodense-16 (21%) (Fig. 1). Il existait souvent un effet de masse- 80 et parfois un cloisonnement de l’hématome- 8. Traitement Les indications opératoires sont résumées dans le tableau IV. Trente huit patients (37%) ont bénéficié d’une intervention neurochirurgicale en urgence ; les 64 (63%) restants ont été opérés surtout dans les 24 heures et exceptionnellement dans les 48 heures, selon leur état général. Les techniques opératoires ont varié dans le temps selon la forme anatomo-clinique et notre expérience. Elles ont consisté en la pratique essentiellement de deux trous de trépan-88 (86%) ou parfois d’une craniotomie standard (volet ostéoplastique)-14 (13,7%) pour ablation des fausses membranes épaisses et/ou de cloisonnements de l’HSDC objectivés par TDM, ou pour certaines récidives, suivis, dans tous les cas, d’un rinçage de l’espace sous-dural et d’un drainage non aspiratif. Ce dernier fut réalisé au moyen de deux segments de sonde urinaire souples sortis par une contre-incision, leurs extrémités distales enfouies dans un pansement non compressif, la tête du patient étant placée en position légèrement déclive pendant 48 heures. L’antibiothérapie prophylactique a été instituée, associée à une réhydratation utilisant le sérum physiologique salé ou le lactate Ringer pendant trois à cinq jours, selon l’évolution clinique, afin de favoriser l’expansion cérébrale postopératoire. Un traitement anti-comitial a été prescrit suivant le terrain. Les patients, diabétiques, hypertendus et séropositifs au VIH, ont été pris en charge par les services compétents. Evolution Il n’a pas été observé de complications durant l’opération. Les patients présentant des troubles de la conscience avant l’intervention chirurgicale, furent gardés en réanimation pour surveillance jusqu’à l’amélioration de l’état neurologique. Ils furent ensuite transférés dans le service de Neurochirurgie où ils bénéficièrent également de la rééducation fonctionnelle. Le suivi postopératoire moyen a été de 24 semaines, avec des extrêmes allant de 12 et 96 semaines. Des complications postopératoires immédiates dans les 14 premiers jours suivant l’intervention ont été observées : méningites-4, pneumopathies-10 et empyèmes sous- duraux-2. Une récidive d’hématome sous-dural-4 (aggravation de l’état neurologique et TDM avec / sans injection positive) a nécessité une ré-intervention. L’HSDC était sous pression dans tous les 4 cas. Nous avons déploré 6 décès (6%), consécutifs à l’aggravation postopératoire d’un syndrome de l’uncus- 4 cas et la survenue, chez deux patients séropositifs, d’une pneumopathie pour l’un et d’un choc septique pour l’autre, tous résistants à l’antibiothérapie. 11 des 96 patients guéris (11,4%) ont gardé des séquelles intellectuelles- 5 ou motrices-6 à court et moyen terme. Aucun patient n’a présenté de crise convulsive. DISCUSSION L’ HSDC revêt souvent le caractère d’une urgence chirurgicale. Notre discussion portera sur cinq points qui nous paraissent essentiels : Epidémiologie La fréquence de l’HSDC est certainement sous-estimée en Afrique subsaharienne (5,12,16). Les causes sont multifactorielles : pauvreté, recours à la médecine traditionnelle en première intention, sous-médicalisation, absence d’assurance maladie, éloignement des patients des grands centres urbains. Cette affection s’observe à tout âge, mais concerne surtout les patients âgés de plus de 65 ans (2,8,12,17). Selon Guénot (8), on compte dans la population générale 13,1 HSDC pour 100.000 habitants et par an. Cette proportion augmente après 65 ans, passant de 3,4/ 100.000 chez les patients âgés de moins de 65 ans à 58,1/ 100.000 après 65 ans (2,8). De 1998 à 2008, nous avons opéré 160 patients porteurs d’un HSDC, soit une moyenne de 16 patients/ an, ce qui corrobore les résultats de Maïga, Sakho, Bâ et al. (12). L’âge moyen dans notre étude est de 58 ans avec des extrêmes de 3-84 ans, la tranche la plus représentée allant de 60 à 65 ans (80%); le sexe ratio est de 4/1 ; ce qui est proche de la majorité d’études africaines (5,12,16) et occidentales (2,3,8,17). La prédominance masculine est classique. . Etiopathogénie Dans cette étude, l’alcoolisme a constitué le principal facteur précipitant les traumatismes crâniens mineurs (64,7%) et même la survenue des HSDC ; il est impliqué dans 20 à 30% des cas dans l’étude de Guenot (8). En effet, la consommation d’alcool à long terme est à l’origine des tableaux cliniques neuropsychiatriques assez bien connus, ainsi que des lésions neuro-anatomiques et de nombreuses perturbations neurochimiques et moléculaires. L’hépatopathie alcoolique est un facteur majeur de risque d’hémorragie intracrânienne et elle aggrave le pronostic (3). Dans 16,16 % des cas, les causes de la maladie n’ont pas été clairement identifiées. En l’absence de notion traumatique, l’initiation du cercle vicieux menant à la constitution de l’hématome reste obscure, la rupture d’une amarre veineuse cortico-durale semble l’hypothèse la plus probable (2,3). Trois phénomènes concomitants seraient à l’origine de l’accroissement en volume de l’hématome au fil du temps : extravasation plasmatique, hémorragies répétées, hyperactivité fibrinolytique du sang dégradé (2). L’activation simultanée excessive des facteurs intrinsèques de la coagulation et de la fibrinolyse contribue à entretenir les microhémorragies, car elle aboutit à une consommation excessive des protéines de la coagulation, à la dégradation rapide de la fibrine et du caillot (2,6,10). Par ailleurs, il a été mis en évidence au niveau de la membrane externe la présence d’activateurs extrinsèques de la fibrinolyse. L’activation locale du système kallicréine-kinine en serait l’origine (6,10). La prise continue d’antiagrégants plaquettaires ou d’anticoagulants favorisent aussi l’apparition et le développement d’un hématome sous-dural chronique après un traumatisme crânien bénin (2). Aucun de nos patients n’avait été mis auparavant sous traitement antiagrégants plaquettaires de façon continue, ni sous anticoagulants. La présence d’une déshydratation, (24,5% de cas dans notre étude), facilite le collapsus cérébral et entretient la cavité liquidienne dans l’espace sous-dural (2,8). Cette déshydratation peut être le résultat d’un défaut d’apport liquidien quotidien et marque la dysrégulation de la fixation de l’eau du cerveau, surtout chez les patients dont l’âge dépasse 65 ans (2). Plus rarement, le traumatisme initial est beaucoup plus important avec un authentique hématome sous-dural aigu qui se transformera en un HSDC au-delà du 20ème jour post traumatique (3) ; tel est certainement le cas chez 20 de nos patients victimes d’un traumatisme crânien sévère (19,6 %). Présentation clinique Le début des signes cliniques est souvent insidieux et progressif, à l’instar de tout processus pseudo-tumoral intracrânien évolutif (2,18). Dans notre étude, la durée moyenne d’évolution de la symptomatologie avant l’hospitalisation est de 13 semaines. En cas d’antécédent de traumatisme crânien, la présence des signes suivants évoque un HSDC : Ces trois ordres de signes cliniques peuvent être intriqués ou restés isolés. On doit aussi évoquer le diagnostic chez un patient âgé de plus de 60 ans présentant des troubles de la vigilance, un état confusionnel aigu, une crise convulsive, des chutes à répétition (2,5,8,12,17). La séméiologie est d’autant plus bruyante et prompte à apparaître que le patient est jeune, ce qui s’explique par l’atrophie cérébrale liée à l’âge, qui aboutit chez le sujet âgé à la constitution d’hématomes sous-duraux chroniques volumineux ou bilatéraux longtemps bien tolérés (2,8). Cependant, le diagnostic de l’HSDC est difficile en l’absence de TDM, du fait de son polymorphisme clinique, surtout chez le sujet âgé, éthylique ou sous anticoagulants (1,2,3). D’autres formes cliniques peuvent être rencontrées (2,7,8) : Le nourrisson peut subir des traumatismes crâniens mineurs dont les conséquences ne sont pas immédiates. Le traumatisme crânien de l’enfant secoué en est un exemple. Avant le 6ème mois, le tableau clinique est celui d’une hypertension intracrânienne évolutive avec retard psychomoteur (3). Après le 6ème mois, les signes de l’hypertension intracrânienne (HIC) sont moins évidents ; l’apparition d’un déficit moteur est alors souvent révélateur (2,17). Ce tableau clinique de l’enfant maltraité, rare en Occident, est encore observé dans certains milieux africains. Dans notre étude, le syndrome d’HIC est constant et souvent décompensé avec troubles de la vigilance (66,6%), voire un syndrome de l’uncus (8%). 58 patients (57%) présentent un déficit hémicorporel, 30 (29,%) des crises convulsives. La majorité des patients fut transférée tardivement dans notre service. Imagerie La TDM, disponible au Gabon depuis janvier 1998, est l’examen idéal pour le diagnostic de l’HSDC ; réalisée sans injection de produit de contraste en première intention, sa sensibilité est de plus 90% (7). Classiquement, l’HSDC est décrit comme revêtant la forme d’une collection péricérébrale convexe en dehors et concave en dedans (en croissant de lune), écrasant plus ou moins les gyri en regard et exerçant un effet de masse (syndrome de masse) plus ou moins important. Ce décollement intéresse une large étendue de la convexité cérébrale supratentorielle, sinon sa totalité (2,7). Il n’est pas toujours uniforme, comme s’il existait des zones d’accolement entre cortex et dure-mère. Au plan morphologique, plusieurs formes peuvent être distinguées, notamment en termes de densité de la collection : Le diagnostic différentiel se pose particulièrement avec l’HSDC isodense bilatéral qui demeure un piège, à moins de pratiquer une IRM (7). Cependant, certains indices scano-graphiques peuvent être utiles : injection d’iode, afin de visualiser la membrane, réalisation des coupes coronales, aspect fin et pointu des cornes ventriculaires frontales (2,7). Aussi, distinguer entre HSDC hypodense et hydrome compressif est une situation parfois délicate. L’hydrome a normalement une densité moindre que celle de l’HSDC et prédomine habituellement dans les régions frontales (7). L’empyème sous-dural sera suspecté sur les données cliniques (11), alors que l’injection de produit de contraste permet parfois de conforter le diagnostic en cas de rehaussement intense des membranes et de réaction arachnoïdienne (7). Ainsi, la TDM est devenue l’outil-diagnostic essentiel, permettant très souvent, à elle seule, de poser le diagnostic d’HSDC, d’évaluer son ancienneté, d’élaborer la stratégie thérapeutique et d’en assurer le suivi (2,7,16): Le diagnostic de l’HSDC a été posé à l’aide de l’angiographie cérébrale chez nos 19 premiers patients (19,3%), ensuite par TDM (77,5%) et IRM (3%). Ce dernier examen, disponible à Libreville depuis près de 12 ans, a permis de mettre en évidence un HSDC isodense bilatéral dans 3 cas. L’IRM, d’une sensibilité proche de 100% pour ce qui concerne l’HSDC, ne devrait pas être prescrite en première intention (7), a fortiori dans notre contexte socio-économique, excepté dans quelques cas bien particuliers tels qu’une localisation très inhabituelle de l’hématome, ou encore la suspicion d’une pathologie vasculaire ou tumorale sous-jacente. Traitement Le traitement de l’HSDC est avant tout chirurgical (1,2,3,4,5,12,16,17). Classiquement, le principe est d’évacuer la collection hématique sous-dural et de rincer abondamment la cavité pour en chasser le contenu anticoagulant et fibrinolytique, afin d’assurer la décompression cérébrale et de permettre le retour à une hémostase locale normale (2). L’indication chirurgicale sera posée dès lors que l’hématome est symptomatique. Toutefois, le degré d’urgence doit être nuancé (8) selon l’état général (états neurologique, somatique et biologique) du patient. Il sera parfois nécessaire de le conditionner et de rétablir des paramètres de coagulation avant d’intervenir (2,8). 37% de nos patients ont bénéficié d’une intervention neurochirurgicale en urgence dans l’heure qui a suivi le diagnostic ; dans 63 % de cas, l’intervention a été pratiquée dans les 24 heures. Plusieurs modalités techniques peuvent être préconisées : trous de trépan (2,4,5,17,18), tréphine (4,12), twist drill (9), ponction percutanée (19), endoscopie (13), craniotomie (3,17). Mais les questions essentielles sont celles du principe et de la durée du drainage sous-dural (8,18). La technique la plus courante et la plus simple consiste à effectuer un ou deux trous de trépan sur la convexité crânienne en regard du décollement indiqué par la TDM, ouvrir la dure-mère, puis les fausses membranes et rincer abondamment la cavité en laissant pour quelques heures un drainage externe en circuit fermé (2,3,19). Cette intervention peut se pratiquer sous anesthésie locale ; ce qui allège le geste chirurgical, principalement chez les patients âgés ou fragilisés (2). Certains auteurs recommandent une craniotomie plus élargie (volet) avec ablation des fausses membranes et/ou de cloisonnements de l’hématome sous-dural, même si son efficacité demeure discutée (2,3,17). Cette dernière technique a été abandonnée dans notre service depuis près de douze ans, car jugée lourde, surtout chez les patients âgés. A l’opposé, l’évacuation de l’HSDC, par voie endoscopique, semble s’avèrer une technique simple, et prometteuse (3,13). L’acquisition de ce matériel moderne dans un avenir proche nous permet de présager des résultats thérapeutiques meilleurs. Aussi, le drainage après évacuation d’un HSDC fait l’objet de controverses (2,3,17, 19). Récemment, une étude randomisée (18) a confirmé son efficacité dans les HSDC évacués par trous de trépan, de sorte que la recommandation est désormais systématique dans ce cas de figure (18). Tous nos malades ont bénéficié d’un drainage non aspiratif de l’espace sous- dural au moyen d’un système simple, sûr et peu onéreux. Parallèlement au geste chirurgical, certaines mesures médicales nous paraissent cruciales : Une corticothérapie – dont l’apport thérapeutique est discuté – peut être d’une certaine utilité, lorsque la clinique tarde à s’améliorer après évacuation et qu’un début de récidive est à craindre (2,3,8). Résultats et réinsertion sociale Dans l’ensemble, le résultat global du traitement de nos 102 cas d’HSDC se rapproche de ceux de la majorité évoquée dans la littérature, notamment africaine (5,8,16,17). 96 patients (94%) ont été guéris, dont 11 avec des séquelles intellectuelles-5 ou motrices-6. Six (6) patients sont décédés (6%). Il ne nous a pas été rapporté de crises convulsives durant la période de suivi de nos patients. Dans les grandes séries rapportées dans la littérature, le résultat est étroitement lié à l’état neurologique du patient au moment de l’intervention chirurgicale (3). Par contre, le volume de l’hématome, l’effet de masse et la présence d’un hématome résiduel en postopératoire ne semblent pas affecter significativement l’évolution (3) ; de même, l’influence de l’âge sur le devenir du patient opéré pour HSDC reste controversée (3). Les consultations tardives et les problèmes d’accessibilité aux soins sont, en partie, responsables des décès. Le problème de la réinsertion des patients est loin d’être résolu en Afrique, en général, et au Gabon en particulier (14). La prise en charge des malades doit être pluridisciplinaire, à la fois cohérente dans son projet et son déroulement. CONCLUSION Le diagnostic de l’HSDC est difficile en l’absence de TDM, du fait de son polymorphisme clinique, surtout chez le sujet âgé, éthylique ou sous anticoagulants. Il importe d’y penser devant des signes cliniques parfois trompeurs, pouvant orienter vers un accident vasculaire cérébral, une démence ou une encéphalite d’origine virale. Le traitement est avant tout chirurgical et urgent, afin de réduire la mortalité et la morbidité. Toutefois, le degré d’urgence doit être nuancé (2, 8), selon l’état général du patient. Dans un proche avenir, les résultats thérapeutiques seront certainement meilleurs dans notre service, grâce à la mise en place par l’Etat d’une Caisse nationale d’Assurance-Maladie et de Garantie sociale depuis trois ans. Tableau I : Symptomatologie clinique à l’admission (n=102)
Tableau II : Examen neurologique à l’admission (n=102)
Tableau III : Score de Glasgow des patients à l’admission (n=102)
Tableau IV : Indications opératoires (n=102)
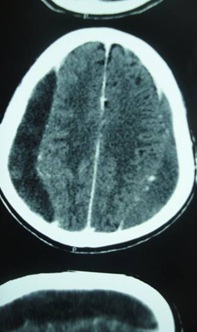 Figure n° 1a 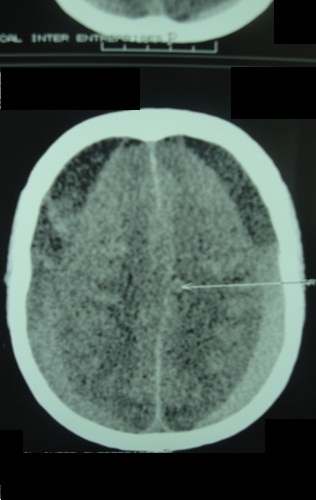 Figure n° 1b 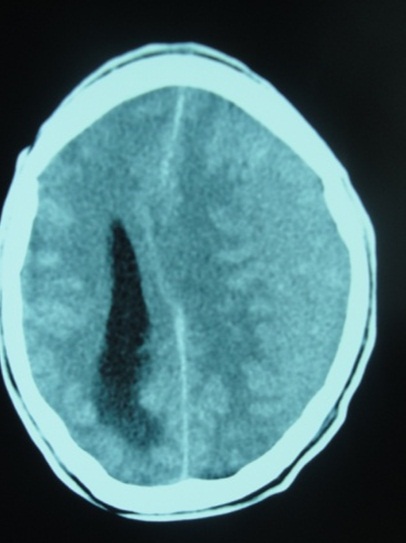 Figure n° 1c REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647