CLINICAL STUDIES / ETUDES CLINIQUES
TRAITEMENT DES INFARCTUS CEREBRAUX PAR RT-PA AU CHU DE LIMOGES (FRANCE)
THROMBOLYSIS WITH RT-PA IN ACUTE ISCHEMIC STROKE IN UNIVERSITY TEACHING HOSPITAL OF LIMOGES (FRANCE)
- Service de Neurologie Centre Hospitalier Régional et Universitaire Duyputren de Limoges
RESUME
L’utilisation du rt-PA a modifié la prise en charge des infarctus cérébraux à la phase aigüe. L’objectif de cette étude est de rapporter l’expérience du CHU de Limoges.
Méthodes: Les données des 47 premiers cas fibrinolysés dans le service ont été analysées. Les caractéristiques cliniques, radiologiques, le devenir et les complications étaient recueillies. Tous les patients avaient bénéficié d’une IRM cérébrale. Nous avons analysé spécifiquement les données concernant les sujets de plus de 80ans ainsi que ceux traités après 3h.
Résultats
Il s’agit de 24 hommes et 23 femmes, âgés de 39ans à 84ans avec un âge moyen de 65,6ans. 4 étaient traités par voie intra-artérielle. Ils étaient tous indépendants à 1semaine.
Chez les 43 autres traités par voie IV, 42% avaient une amélioration de plus de 5 points du score NIHSS à J7, 25,6% étaient retournés à domicile indépendants. 8 patients avaient une transformation hémorragique dont 3 symptomatiques (7%), 6 patients étaient décédés à un mois.
15 (34,9%) patients étaient traités après 180min et 5 (11,6%) âgés de plus de 80ans constituant une violation du protocole NINDS. Aucun de ces cas n’était lié à un pronostic péjoratif.
Conclusion
Les résultats comparables à ceux de la littérature suggèrent le bénéfice du rt-PA après 3h et chez les sujets de plus de 80ans et donc la nécessité de revoir les critères de sélection.
Mots clés : infarctus cérébral, thrombolyse, rt-PA
ABSTRACT
Objective
Efficacity of rt-PA to treat ischemic stroke has been established. We aimed to reported Limoges Hospital’s experience.
Method
Data for 47 first cases were collected. MRI was used as diagnosis imaging. Specifically we analysed the data for patients older than 80years and those who were treated after 3hours.
Mean age was 65.6years; 4 were treated in intrartery and had good outcome.
Results
Among those who received rt-PA in intravenous 42% had neurological recovery after 1 week, 25.6% were discharged home self-sufficiencily, 3 (7%) cases of symptomatic intracerebral hemorrhage, the one-month mortality rate was 6 (13.9%).
15 (34.9%) were treated after 3 hours and 5 were older than 80years. Those cases were not significantly associated with hemorrhage and poor outcome.
Conclusion
This study suggested benefit of rt-PA in ischemic stroke after 3hours at onset symptoms and among patients older than 80years.
Key words: elderly, ischemic stroke, rt-PA, thrombolysis therapy
INTRODUCTION
L’efficacité du traitement des infarctus cérébraux par rt-PA en intraveineux dans les 3heures est établie [6,5,1]. Mais aujourd’hui des méta-analyses montrent que la fenêtre thérapeutique pouvait être élargie [3,14,15]. Certaines études observationnelles chez des sujets de plus de 80ans laissent envisager le traitement chez ces patients avec une sécurité [7,11]. La question de la fibrinolyse au delà des 3heures et chez des sujets de plus de 80ans est aujourd’hui objet de controverses. En attendant les résultats de l’étude ECASS III (European Cooperation Acute Stroke Study) et du registre IST3 [10] ces deux éléments font l’objet de débats dans la communauté médicale et constituent des indications hors AMM (autorisation de mise sur le marché). Plusieurs centres ont réalisé ce traitement de part le monde depuis la publication de l’étude NINDS (National Institue of Neurological Disorders and Stroke).
L’objectif de ce travail est de rapporter d’une part l’expérience du Centre hospitalier Universitaire (CHU) de Limoges et d’autre part d’étudier le pronostic chez les sujets de plus de 80ans et ceux traités après 3h aux autres.
PATIENTS ET METHODES
Il s’agit d’une étude transversale de type descriptif portant sur les données des patients admis au CHU de Limoges pour un infarctus cérébral et ayant bénéficié de la thrombolyse du 1er Février 2004 au 30 Juin 2006 quel que soit leur devenir.
L’inclusion était faite selon les critères de l’étude NINDS (National Institue of Neurological Disorders and Stroke) [10] avec une exception pour l’âge et le délai chez certains patients. Le consentement était obtenu chez tous les patients.
Tous les patients avaient comme imagerie diagnostique avant traitement une IRM cérébrale comprenant les séquences diffusion (DWI), FLAIR, T1 et T2, T2*, et ARM 3DTOF. Ils ont en outre bénéficié d’un bilan biologique comprenant: glycémie, numération formule sanguine, bilan d’hémostase et plaquettes, un électrocardiogramme (ECG) et un monitoring cardiaque et de la pression artérielle. Une IRM cérébrale avec les mêmes séquences était effectuée systématiquement à 24h du traitement ou avant si complication.
Le choix de la voie intra-artérielle était guidé par la présence de contre-indication à la fibrinolyse par voie intraveineuse (délai trop tardif, chirurgie récente, occlusion en T chez un patient, une occlusion basilaire).
La surveillance clinique neurologique était effectuée à l’aide de l’échelle NIHSS (National Institute of Health Stroke Scale).
Les données recueillies étaient outre les données sociodémographiques, les facteurs de risque, les données temporelles (délai d’admission, délai de traitement) le score NIHSS avant traitement et à plusieurs instants après traitement, les constantes cliniques avant le traitement, les données de l’imagerie, les complications post-fibrinolyse (transformation hémorragique, aggravation neurologique, décès) et le devenir de chaque patient ainsi que le RANKIN à 3mois.
Pour l’analyse descriptive les données étaient présentées en pourcentage avec un intervalle de confiance à 95% pour les variables qualitatives et en moyenne avec écart-type pour les variables quantitatives. Plus spécifiquement nous avons analysé les données des sujets de plus 80ans et ceux traités après 3heures. Les tests statistiques usuels étaient utilisés pour l’analyse univariée: test de chi-deux pour les variables qualitatives et celui de Student pour les variables quantitatives. Pour l’analyse univariée l’odds-ratio ainsi que son intervalle de confiance à 95% étaient calculés. Le test ANOVA était utilisé pour comparer les scores NIHSS aux différents temps. Une régression logistique fut utilisée pour étudier la relation entre certains paramètres et le risque de transformation hémorragique et celui d’amélioration clinique.
Le logiciel SPSS version 10.0 (Inc. Chicago, USA) était utilisé pour l’analyse statistique. Pour ces tests un p<0,05 était considéré comme significatif.
RESULTATS
Quarante sept patients étaient traités dont 4 par voie intra-artérielle et 43 par voie intraveineuse. Il s’agit de 24 hommes et 23 femmes; ils étaient âgés de 39ans à 84ans avec un âge moyen de 65,6ans (+9,9). Le score NIHSS médian avant traitement était de 15 avec une moyenne de 13,9 (+5,4). Les caractéristiques générales de la population sont résumées dans le tableau 1.
Pour les 4 patients traités par voie intra-artérielle le délai médian de traitement était de 211,5min avec des extrêmes de 119min et 270min, ils avaient un score NIHSS médian de 12; les sièges étaient 1 sylvien superficiel, 1 sylvien profond, 1 sylvien total et 1 tronc basilaire. Le pronostic était bon chez tous car 3 sont rentrés directement à domicile indépendants et le dernier après un bref séjour de deux semaines en rééducation.
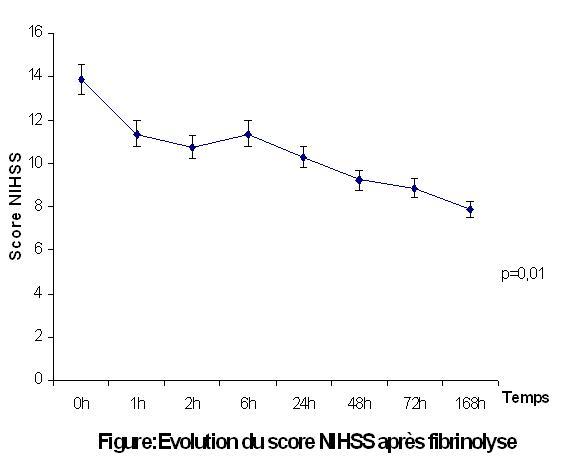
Les données spécifiques concernant les 43 sujets traités par voie intraveineuse sont résumées dans le tableau 2. La figure 1 traduit l’évolution du score NIHSS chez ces sujets pendant la première semaine.
Concernant le devenir 11 patients (25,6%) étaient rentrés directement à domicile, 18 (41,9%) en rééducation, 6 (13,9%) décédés (dans un délai de 1 mois). Vingt sept patients (62,8%) étaient indépendants à 1 mois (RANKIN <2).
Huit patients (18,6%) avaient une transformation hémorragique dont 3 (7%) symptomatiques (avec aggravation neurologique). Seul un score NIHSS supérieur à 15 (p=0,02) avant traitement et la notion d'hypertension artérielle (p=0,05) étaient associés au risque de transformation hémorragique.
Les patients de plus de 80ans n'avaient ni plus de transformation hémorragique ni un mauvais pronostic par rapport aux sujets de moins de 80ans (Tableau 3).
Les sujets traités après 3heures n'avaient pas plus un mauvais pronostic par rapport à ceux traités avant 3 heures (Tableau 4).
Les données du RANKIN à 1 mois suivant le délai de traitement est résumé dans le tableau 5.
COMMENTAIRES
Nous avons réalisé une étude descriptive dont l’objectif était de rapporter l’expérience du CHU de Limoges. Il ne s’agissait nullement de démontrer l’efficacité de ce traitement. Plusieurs données de la littérature l’ont clairement prouvé. La force de notre étude réside d’une part dans l’utilisation de l’IRM cérébrale comme imagerie diagnostique. Cet outil offre plus de sécurité dans le traitement par rt-PA que le scanner [8,9]. Toutefois une utilisation rationnelle de cet outil s’impose car elle pourrait dans certains cas exclure certains patients potentiellement éligibles pour la fibrinolyse. En effet dans notre expérience plusieurs patients ont été exclus sur la base de l’importance du volume de l’anomalie en diffusion alors que ces patients n’avaient aucun signe précoce d’ischémie cérébrale au scanner réalisé chez certains d’entre eux. Dans une étude sur la validité du score ASPECTS et les éléments pronostics du devenir de 203 patients ayant eu la fibrinolyse intraveineuse Barber et al. retrouvèrent une corrélation entre les scores ASPECTS et NIHSS avant thrombolyse d’une part et entre le score ASPECTS à 24h et le RANKIN [2]. En définitive la thrombolyse sur la base du scanner garde tout son intérêt si cet examen est pratiqué et interprété par un radiologue ayant une expérience sur la neuro-imagerie vasculaire à la phase aiguë des accidents vasculaires cérébraux. D’ailleurs la plupart des études et essais réalisés sur la fibrinolyse intraveineuse à la phase aiguë des AVC ischémiques l’ont été sur les données scannographiques.
Concernant le devenir 13,9% des patients étaient décédés. Ce taux est inférieur au 17% de l’étude NINDS [6]. Le taux de transformation hémorragique symptomatique était de 7% qui est semblable au 6,4% rapporté dans l’étude NINDS. La petite différence pourrait en partie être expliquée par les scores NIHSS et par la violation de protocole. Toutefois nous avons montré que la violation du protocole sur l’âge et le délai de traitement n’avait pas entraîné une augmentation significative du risque de transformation hémorragique.
Les sujets de plus de 80ans n’avaient guère plus de transformation hémorragique ni plus souvent décédés que les autres. Le pronostic est donc similaire dans ces classes d’âges. La question de la fibrinolyse après 80ans soulève aujourd’hui beaucoup de passions. Les données de la littérature sont contradictoires. Oostenbrugge et al [7] en reprenant tous les cas de fibrinolyse à l’hôpital de Maastricht entre 1998 et 2004 et comparant les sujets de moins de 80ans à ceux ayant plus de 80 ans retrouvèrent des résultats très intéressants. Les hémorragies intracérébrales étaient significativement plus fréquentes chez les sujets de plus de 80 ans avec un odds-ratio de 4,22 mais chez 3 des 5 sujets âgés de plus de 80ans l’hémorragie étaient en dehors de la zone infarcie alors que les 5 cas d’hémorragie chez les sujets de moins de 80ans sont tous des transformations hémorragiques et plus fréquentes chez ceux ayant un score NIHSS initial élevé. Ce résultat pourrait être expliqué par une plus grande utilisation d’antithrombotique, une fréquence plus accrue de microangiopathie. Par contre d’autres études n’ont pas retrouvé de différence de risque [8,12,13]. La thrombolyse chez les sujets de plus de 80ans est hors AMM. Mais lorsqu’on sait qu’environ 25% des AVC survinrent chez ces sujets et qu’ils sont rarement inclus dans les essais cliniques et au vu des résultats de plusieurs études observationnelles la décision de fibrinolyse chez ces sujets devrait être envisagée au cas par cas et si possible guidée par une IRM. Ces patients ne devraient pas être systématiquement exclus uniquement sur le seul critère de l’âge. Les résultats de l’étude IST-3 [10] devrait apporter une solution à la question.
L’autre résultat intéressant de l’étude est l’absence de risque de transformation hémorragique et de mauvais pronostic suivant le délai de traitement. Toutefois signalons que tous les sujets avaient bénéficié d’une IRM cérébrale parfois avec la séquence de perfusion et que les sujets présentant un faible mismatch et ceux ayant des lésions importantes déjà visibles sur la séquence FLAIR étaient exclus. Il s’agit sûrement d’une sécurité chez nos patients. Ceci n’a donc pas permis de retrouver le gradient de risque suivant le délai de traitement rapporté dans la littérature. Mentionnons toutefois que la plupart des essais sur le rt-PA ont été effectués sur la base du scanner qui n’offre pas la même sécurité que l’IRM. D’ailleurs l’étude poolée des principaux essais cliniques [1] a montré que le bénéfice du traitement persiste jusqu’à 4h30 après le début des symptômes. Aussi faudrait-il ajouter que près de 75% des sujets victimes d’un infarctus cérébral possèdent un mismatch à 6h de leur déficit [15]. Les résultats de l’étude ECASSIII ont montré le bénéfice du traitement après 3h et jusqu’à 4h30 [16]. Ainsi l’European Stroke Organization (ESO) a-t-elle modifié ses recommandations au vu des résultats de ECASS III publiés en Septembre 2008. Toutefois on attend la prochaine extension AMM du rt-PA entre 3 et 4h30. Les nouvelles techniques d’imagerie cérébrale (IRM cérébrale de diffusion et perfusion, scanner de perfusion…) donnant une évaluation plus objective de la pénombre ischémique pourraient permettre de mieux sélectionner les patients même après 3h.
La limite essentielle de ce travail est le faible effectif des sujets de plus de 80ans dans notre échantillon. Nous manquons peut-être de puissance pour mettre en évidence certaines associations rapportées dans la littérature telles l’hypertension artérielle et risque de transformation hémorragique.
En conclusion cette étude montre la faisabilité et la sécurité du traitement des infarctus cérébraux par rt-PA au CHU de Limoges et suggère aussi que ce traitement est possible après 3h et même chez les sujets de plus de 80ans.
Tableau 1: Caractéristiques générales des patients
| Caractéristiques |
Fréquence |
| Age (moyenne+/-écart-type) |
66,4ans (+9,2) [47ans-84ans] |
| Sexe (masculin) |
23 (53,5%) |
Mode de transport
SAMU
Sapeurs pompiers
Ambulances
Autres |
24 (51%)
8 (17%)
7 (15%)
8 (17%) |
Délai
Délai d’admission
Délai de réalisation IRM
Délai de traitement |
95,5 (+46,6)
135 (+41,1)
169,5 (+38,0) |
NIHSS
< 10
10-14
15-19
20-24 |
12 (25,5%)
11 (23,4%)
17 (36,2%)
7 (14,9%) |
Facteurs de risque
HTA
Diabète
Dyslipidémie
Tabac
AIT/AVC
Cardiopathies |
34 (72,3%)
11 (23,4%)
22 (46,8%)
15 (31,9%)
3 (6,4%)
15 (31,9%) |
Constantes avant traitement
PA systolique (mmHg)
PA diastolique (mmHg)
Glycémie (mmol/l) |
158,8 (+26,2)
80,0 (+16,9)
7,36 (+2,3) |
Siège de l’infarctus
Sylvien superficiel
Sylvien profond
Sylvien total
Vertébrobasilaire |
21 (44,7%)
18 (38,3%)
5 (10,6%)
3 (6,4%) |
AIT : accident ischémique transitoire, AVC : accident vasculaire cérébral, HTA :hypertension artérielle, PA : pression artérielle
Tableau 2: Caractéristiques des patients traités par rt-PA en intraveineuse
| Variables |
Moyenne |
Ecart-type |
[Min.- Max] |
| Age (ans) |
66,37 |
9,22 |
[47- 84] |
| Sexe (masculin) |
23 |
|
|
| Délai d’arrivée à l’hôpital |
95,07 |
46,59 |
[0 – 200] |
| Délai thrombolyse (min) |
169,59 |
51,96 |
[90-240] |
| NIHSS médian avant thrombolyse |
15 |
|
[5- 24] |
| PA systolique (mmHg) |
160,88 |
25,85 |
[115-250] |
| PA diastolique (mmHg) |
81,16 |
17,02 |
[46- 124] |
| Glycémie (mmol/l) |
7,48 |
2,25 |
[4-15] |
Tableau 3: Comparaison des patients âgés de plus de 80ans aux autres.
| |
< 80ans
n=38 |
> 80 ans
n=5 |
OR (IC95%) |
p |
| Sexe (masculin) |
22 (57,9%) |
1 (20%) |
0,2 [0,0-1,8] |
0,1 |
| Antécédent HTA |
29 (76,3%) |
4 (80%) |
1,2 [0,1-12,6] |
0,6 |
| Antécédent diabète |
9 (23,7%) |
2 (40%) |
2,1 [0,3-14,9] |
0,4 |
| Délai thrombolyse (min) |
169,2 (+39,8) |
172 (+22,5) |
1,0 [0,9-1,0] |
0,9 |
| NIHSS avant traitement |
13,8 (+5,5) |
15,2 (+4,8) |
1,1 [0,9-1,3] |
0,5 |
| PA systolique (mmHg) |
161,4 (+26,1) |
156,6 (+26,3) |
1,0 [0,9-1,0] |
0,7 |
| PA diastolique (mmHg) |
81,5 (+17,1) |
78,4 (+18,3) |
1,0 [0,9-1,0] |
0,7 |
| Glycémie (mmol/l) |
7,4 (+2,3) |
7,8 (+1,9) |
1,1 [0,7-1,6] |
0,7 |
| Amélioration (> 4points sur NIHSS)* |
21 (55,3%) |
3 (60%) |
1,2 [0,2-8,1] |
0,6 |
| Transformation hémorragique |
7 (18,4%) |
1 (20%) |
1,1 [0,1-11,5] |
0,7 |
| Devenir |
|
|
|
|
| Décès |
5 (13,2%) |
1 (20%) |
1,7 [0,2-17,9] |
0,5 |
| Retour à domicile |
10 (26,3%) |
1 (20%) |
0,7 [0,1-7,0] |
0,6 |
IC :intervalle de confiance ; * Variation du score à 1semaine
Tableau 4: Comparaison des patients suivant le délai de traitement.
| |
< 180min
n=28 |
> 180 min
n=15 |
OR |
p |
| Age |
66,4 (+9,7) |
66,3 (+8,6) |
1,0 [0,9-1,1] |
1 |
| Sexe (masculin) |
17 (60,7%) |
6 (40%) |
0,4 [0,1-1,6] |
0,2 |
| Antécédent HTA |
20 (71,4%) |
13 (86,7%) |
2,6 [0,5-14,2] |
0,2 |
| Antécédent diabète |
7 (25%) |
4 (26,7%) |
1,1 [0,3-4,6] |
0,6 |
| NIHSS avant traitement |
13,5 (+5,8) |
14,8 (+4,5) |
1,1 [0,9-1,2] |
0,4 |
| PA systolique (mmHg) |
160,9 (+29,0) |
160,9 (+19,5) |
1,0 [1,0-1,0] |
1 |
| PA diastolique (mmHg) |
80,8 (+18,0) |
81,8 (+19,5) |
1,0 [1,0-1,1] |
0,9 |
| Glycémie (mmol/l) |
7,9 (+2,5) |
6,6 (+1,4) |
0,7 [0,4-1,1] |
0,1 |
| Amélioration*(> 4points sur NIHSS) |
17 (60,7%) |
7 (46,7%) |
0,6 [0,2-2,0] |
0,3 |
| Transformation hémorragique |
5 (17,9%) |
3 (20%) |
1,2 [0,2-5,7] |
0,6 |
| Devenir |
|
|
|
|
| Décès |
4(14,3%) |
2 (13,3%) |
0,9 [0,1-5,7] |
0,9 |
| Retour à domicile |
10 (35,7%) |
1 (6,7%) |
0,1 [0,0-1,1] |
0,06 |
*Variation du score à 1 semaine
Tableau V : Taux d’indépendance (RANKIN<2) à 3mois en fonction du délai de traitement
| |
<120min
N (%) |
[120-180[
N (%) |
[180-210[
N (%) |
[210-240]
N (%) |
p |
| Indépendant (RANKIN<2) |
2 (50%) |
15 (78,9%) |
6 (42,9%) |
4 (66,7%) |
0,18 |
| Dépendant ou décès |
2 (50%) |
4 (21,1%) |
8 (57,1%) |
2 (33,3%) |
|
REFERENCES
- ALBERS GW, CLARK WM, MADDEN KP, HAMILTON SA. The ATLANTIS Trial: Results for patients treated within three hours of stroke onset. Stroke 2002; 33: 493-6.
- BARBER PA, DEMCHUK MA, ZHANG J, BUCHAN AM (ASPECTS Study group). Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolysic therapy. Lancet 2000; 35:1670-4.
- HACKE W, DONNAN G, FIESCHI C, KASTE M, VON KUMMER R, BRODERICK JP, BROTT T, FRANKEL M et al. Association of outcome with early stroke treatment : pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet 2004, 363: 768-74.
- KIDWELL CS, ALGER JR, SAVER JL. Beyond mismatch: evolving paradigms in imaging the ischemic penumbra with multimodal magnetic resonance imaging. Stroke 2003; 34:2729-35.
- MORI E, YONEDA Y, TABUCHI M, YOSHIDA T, OHKAWA S, OHSUMI et al. Intravenous recombinant tissue plasminogen activator in acute carotid artery territory stroke. Neurology 1992; 42(5): 976-82
- National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Eng J Med. 1995; 333:1581-7.
- OOSTENBRUGGE RJ-V, HUPPERTS RMN, LODD J. Thrombolysis for acute stroke with special emphasis on the very old: experience from a single Dutch center. J Neurol. Neurosurg. Psychiatry 2006; 77: 375-7.
- SAMSON Y, CROZIER S, DELTOUR S et al. L’IRM en urgence avant la thrombolyse. Rev. Neurol. (Paris) 2002 ; 158 :1S20.
- SAMSON Y, DELTOUR S, CROZIER S, OBADIA M, MANAÏ R, OPPENHEIM C et al. Existe-il des contre-indications IRM à la thrombolyse ? Rev . Neurol. (Paris) 2003 ; 159 :1, 1S25-6.
- SANDERCOCK P, LINDLEY R, WARDLAW JM, DENNIS M, LEWIS S, VENABLES G, KOBAYASHI A et al. for the IST-3 collaborative group. The third International Stroke Trial (IST-3) of thrombolysis for acute ischaemic stroke: Study protocol. Trials 2008, 9:37:1-17.
- SYLAJA PN, COTE R, BUCHAN AM, HILL MD on behalf Canadian Alteplase for Stroke Effectiveness Study (CASES) investigators. Thrombolysis in patients older than 80 years with acute ischaemic stroke: Canadian Alteplase for Stroke Effectiveness Study. J Neurol. Neurosurg. Psychiatry 2006; 77: 826-9.
- TANNE D, GORMAN MJ, BATES VE, KASNER SE, SCOTT P, VERRO P, BINDER JR, DAYNO J et al. Intravenous Tissue Plasminogen Activator for acute ischemic stroke in patients aged 80 years and older. The tPA Stroke Survey Experience. Stroke 2000; 31:370-375.
- TONI D, LORENZANO S, AGNELLI G, GUIDETTI D, ORLANDI G, SEMPLICINI A, TOSO V. et al. Intravenous thrombolysis with rt-PA in acute ischemic stroke patients aged older than 80 years in Italy. Cerebrovasc Dis. 2008; 25(1-2):129-35.
- WARDLAW JM, WARLOW CP, COUNSELL C. Systematic review of evidence on thrombolytic therapy for acute ischaemic stroke. Lancet 1997, 350: 607-14.
- WARDLAW JM, SANDERCOCK DM, BERGE E. Thrombolytic therapy with Recombinant Tissue Plasminogen Activator for Acute Ischemic stroke. Where do we go from here? A cumulative meta-analysis. Stroke 2003; 34:1437-42.
- WERNER HACKE MD, KASTE M, and al. Thrombolysis with alteplase 3 to 4.5 hours after Acute Ishemic Stroke (ECASS-III). N Engl J Med 2008; 359 : 1317-1329.
|
|

