TECHNIQUES
COMPLICATIONS DE LA VENTRICULOCISTERNOSTOMIE ENDOSCOPIQUE (VCE) DU 3ème VENTRICULE
COMPLICATIONS OF ENDOSCOPIC THIRD VENTRICULOSTOMY
- Service de Neurochirurgie CHU de FANN, Dakar, Senegal
E-Mail Contact - THIAM Alioune Badara :
RESUME
Introduction
La ventriculo-cisternostomie (VCS) représente une technique endoscopique utilisée pour le traitement de l’hydrocéphalie. Elle rentre dans le cadre de la neurochirurgie mini-invasive et peut être émaillée de complications variables.
But
Faire une mise au point sur les complications de la VCS au service de neurochirurgie du CHN de Fann de Dakar.
Méthode
Les auteurs ont revu sur une période de 52 mois (février 2010 à mai 2014) toutes les complications relatives à la VCS. Les patients étaient opérés par un endoscope rigide. Le suivi était en moyenne de 8 mois, avec des extrêmes de 3 mois et 2 ans 1/2.
Résultats
Quarante-deux patients ont présenté des complications soit 27,1 %. La sténose de l’aqueduc de Sylvius était la principale étiologie de l’hydrocéphalie. La fréquence des complications selon les années était décroissante. Un saignement a été rapporté chez 4 patients (2,58%). La fuite de LCS était la principale complication : 9,68%. La méningite a été rapportée dans 6 cas et une suppuration de la plaie opératoire chez un patient. Un patient a présenté une hyperthermie postopératoire, un autre un diabète insipide et une sténose de la stomie a été constatée dans 2 cas. L’imagerie postopératoire a révélé un cas de pneumencephalie, et un d’hygrome. Nous avons répertorié 2 décès soit 1,29%. Un patient a présenté une association de complications. La procédure a été abandonnée chez 15 patients.
Conclusion
Les complications sont essentiellement dominées par la fuite du LCS et fonction de l’expérience du chirurgien. La sténose de l’aqueduc de Sylvius est l’étiologie dominante de l’hydrocéphalie des complications au cours de notre étude.
Mots clés : hydrocéphalie, ventriculo-cisternosmie, complication
ABSTRACT
Introduction
The endoscopic third ventriculostomy (VCS) is a technique used for the endoscopic treatment of hydrocephalus.
Aim
To Make a focus on the complications of VCS in Neurosurgery CHN Fann Dakar.
Method
The authors reviewed over a period of 52 months (February 2010 to May 2014) all the complications related to the VCS. Patients were operated on by a rigid endoscope. Follow-up was an average of 8 months with a range of 3 months and 2 ½ years.
Result
Forty-two patients had complications whether 27.1%. Stenosis of the aqueduct of Sylvius was the main etiology of hydrocephalus. The complication rates according years was decreasing. Bleeding has been reported in 4 patients (2.58%). LCS leakage was the main complication: 9.68%. Meningitis was reported in 6 cases and a suppuration of the surgical wound in a patient. One patient had a postoperative hyperthermia, another a diabetes insipidus and stenosis of the stoma was observed in 2 cases. The post-operative imaging revealed a pneumocephalus case, and a hygroma. We have listed two deaths or 1.29%. One patient had a combination of complications. The procedure was discontinued in 15 patients.
Conclusion
Complications are mainly dominated by the leakage of CSF and depending on the surgeon’s experience. Stenosis of the aqueduct of Sylvius is the dominant etiology of hydrocephalus complications in our study.
Keys words: hydrocephalus, ventriculostomy complication
INTRODUCTION
La ventriculo-cisternostomie (VCS) représente une technique endoscopique de traitement de l’hydrocéphalie rentrant dans le cadre de la neurochirurgie mini-invasive [36]. Elle a l’avantage d’être simple, d’éviter les risques infectieux et mécaniques liés à l’implantation d’une valve, ainsi que de rétablir une circulation du liquide céphalo-spinal (LCS) proche de la normale. Elle peut néanmoins être émaillée de diverses complications qui sont quelques fois fatales [4, 33,34]. Nous analysons les différentes complications liées à la réalisation de la VCS chez 155 patients pris en charge pour hydrocéphalie.
METHODOLOGIE
Les auteurs ont effectué une étude rétrospective sur une période de 52 mois (février 2010 à mai 2014) portant sur toutes les complications résultant de la réalisation d’une VCS. Les patients décédés après l’intervention, mais dont la cause n’était pas rattachable à la VCS ont été exclus. L’hydrocéphalie a été mise en évidence par IRM ou scanner. Tous les patients étaient opérés sous anesthésie générale par des différents chirurgiens mais selon le même protocole. Le trou de trépan était réalisé au point de Kocher et obturé en fin d’intervention au surgicel. Lorsque la membrane de Liliequist était présente, elle était fenestrée. Le suivi des patients était en moyenne de 8 mois, avec des extrêmes de 3 mois et 2 ans ½.
RESULTATS
Nous avons répertorié 167 patients ayant bénéficié d’une VCS dont 155 disposaient de toutes les données nécessaires à cette étude. Ceux ayant présenté des complications étaient 42 soit 27,1%. Il y avait une prédominance masculine (25 patients) avec un sex-ratio de 1,47. La tranche d’âge la plus représentative était celle des moins de 6 mois (24.5%) avec une moyenne d’âge de 10 ans (119 mois) et des extrêmes de 2 mois et 68 ans (876 mois). L’hydrocéphalie était causée par une sténose de l’aqueduc dans 22 cas, une malformation de Dandy Walter dans 6 cas, post-méningitique dans 5 cas, une tumeur de la fosse cérébrale postérieure dans 5 cas, une tumeur pinéale dans 3 cas et un kyste du V3 dans 1 cas (fig.1).
Nous avons recensé 15 patients chez qui la VCS a été abandonnée en per opératoire (9.7%) pour diverses raisons (fig.2).
La fréquence des complications a été plus importante durant l’année qui a suivi le début de la pratique de la VCS (fig.3).
Complications per opératoires
Les saignements sont survenus chez 4 patients soit 2.6%. Ils étaient essentiellement liés à une blessure des plexus choroïdes (1 cas), une lésion des veines cortico-durales (1 cas) et non précisés pour les 2 cas restants. Ces saignements étaient de moyenne abondance.
Complications post opératoires
La fuite du LCS était retrouvée dans 15 cas soit 9,68%. L’âge des patients variait de 2 mois à 38 ans avec une moyenne de 10.56 ans. Les étiologies retrouvées étaient : 3 cas de sténose de l’aqueduc de Sylvius, 6 cas de Dandy Walker, 4 cas de tumeur de la FCP, 1 cas post-méningite et une tumeur de la région pinéale. Le délai moyen de survenue était de 14.5 jours. La prise en charge a consisté à une suture secondaire chez 9 patients dont l’un a bénéficié en plus d’une antibiothérapie. Une dérivation ventriculo-péritonéale (DVP) a été réalisée chez 2 patients, et une dérivation ventriculo-externe (DVE) chez 3 patients.
L’infection a concerné 7 patients soit 4,52%. Il s’agissait de la méningite dans 6 cas avec un délai moyen de survenue de 25,5 jours secondaire à une fuite du LCS dans 1 cas, et liée à un manque d’asepsie au cours des soins prodigués aux patients dans les suites post-opératoires dans 5 cas.
L’âge des patients variait de 4 mois à 35 ans avec une moyenne de 8.52 ans. Les étiologies de l’hydrocéphalie étaient la sténose de l’aqueduc de Sylvius dans 3 cas, 1 cas post méningitique, une tumeur kystique du V3 dans 1 cas et une tumeur de la région pinéale. Le délai moyen de survenue était 25.5 jours. La prise en charge de ces patients a consisté à une antibiothérapie adaptée, et à la pose d’une DVE chez un patient et d’une DVP chez un autre. Une suppuration de plaie opératoire a été constatée chez une patiente âgée de 11ans, porteuse d’une sténose de l’aqueduc de Sylvius après un délai de 6 jours. Elle a été traitée par antibiothérapie (céphalosporine de 3ème génération) associée aux soins locaux.
Un patient de 11 mois, porteur d’une hydrocéphalie post méningitique a présenté une hyperthermie à 38°7 un jour après son opération sans signe clinique ni bactériologique de méningite. Il avait bénéficié d’un traitement symptomatique à base d’un antipyrétique. L’évolution était favorable.
Un cas de diabète insipide avait été diagnostiqué chez une femme de 68 ans porteuse d’une sténose de l’aqueduc de Sylvius 2 jours après son intervention. La symptomatologie a régressé après un traitement médical.
Complication rare, la pneumencephalie avait été diagnostiquée dans 1 cas (fig.4). Elle siégeait en région frontale prédominante à droite. Il s’agissait d’une patiente de 38 ans qui présentait une hydrocéphalie secondaire à une sténose de l’aqueduc de Sylvius. Après intervention elle avait eu un retard de réveil. Elle avait été mise en position de Trendelenburg et avait bénéficié d’une oxygénation au masque 100%. L’évolution avait été marquée par une régression totale de la symptomatologie au 3ème jour postopératoire.
Un échec de la VCS a été rapporté dans 11 cas soit 7,1% dont 7 patients de sexe masculin. L’âge des patients variait de 5 mois à 25 ans, avec une moyenne de 8,1 ans. L’étiologie de l’hydrocéphalie était dominée par la sténose de l’aqueduc de Sylvius (8 patients). Le délai moyen de survenue était de 6.56 mois. Une DVP secondaire a été faite pour 9 d’entre eux, une reprise de la VCS pour 1 et une abstention thérapeutique dans 1 cas.
Une obstruction secondaire a été notée chez 2 patients âgés de 3 et 4 mois. Les étiologies retrouvées étaient une malformation de sténose de l’aqueduc de Sylvius et une tumeur de da FCP. Le délai moyen de survenue était de 12 mois. La prise en charge a été une DVP et une reprise de la VCS, avec une évolution favorable dans 1 cas (celui de la DVP).
Un hygrome sous dural a été rapporté dans un cas chez un patient de 4 ans ayant présenté une hydrocéphalie triventiculaire active dont l’étiologie était une tumeur de la région pinéale (fig.5). Il a présenté au 20ème jour postopératoire une fuite du LCS après avoir développé un hygrome post VCS qui a été évacué. Une méningite s’est installée, puis prise en charge par antibiothérapie et par pose d’une DVE. Au 34ème jour postopératoire le décès a été constaté. Ce patient a associé 3 complications.
Nous avions enregistré au cours de cette étude 2 décès soit 1,29%. Le premier patient âgé de 30 ans, porteur d’une sténose de l’aqueduc de Sylvius, était décédé au 3ème jour postopératoire suite à une hémorragie non contrôlée. Le second patient âgé de 4 ans, avait développé une méningite suite à une fuite du LCS et est décédé au 34ème jour.
DISCUSSION
Considérée comme une alternative à la dérivation du LCS (shunt), la VCS est le traitement de choix des hydrocéphalies obstructives ; cependant elle peut être émaillée de certaines complications.
Sur 155 patients traités, 42 ont présenté des complications soit 27,1%. Ce taux se rapproche de celui de Proust : 26% [29] et d’Ersahin : 25% [9]. Selon certains auteurs, le taux de complication de procédures endoscopiques varie de 0 à 20% [7,33]. La sténose de l’aqueduc de Sylvius représente l’étiologie de l’hydrocéphalie la plus fréquemment retrouvée au cours de notre étude : 52,4% des complications. Ersahin et al [9] par contre ont retrouvé un taux de complication important chez les patients ayant une obstruction du 4ème ventricule (V4) (68%) et moindre chez ceux ayant une malformation de Chiari type I et une tumeur. Le taux de complication durant notre étude a été plus important au cours de la 2ème année de la pratique, et décroissant sur le reste de la période. Ceci a été également rapporté par différentes équipes [8,25] et s’expliquerait par l’accroissement de la maitrise de la technique par les chirurgiens : il s’agit de la courbe d’apprentissage de la procédure neuroendoscopique. Le taux d’abandon de notre étude (9,68%) est dans les limites rapportées par la littérature : 0 à 26% [5,39]. Les raisons d’abandon étaient essentiellement l’hémorragie et les variations anatomiques tel le cloisonnement du foramen de Monro.
Complications per operatoires
La principale complication peropératoire rencontrée était le saignement (2,58%). Il représentait 0,53% au cours de l’étude de Schroeder [33] et 2,9% au cours de celle de Sokal [36]. L’hémorragie intraventriculaire émanant des petits vaisseaux sous-épendymaires par impact des instruments endoscopiques est la plus fréquemment rapportée [5,12]. L’hémostase a été obtenue comme l’a suggéré Walker [41]: irrigation et patience dans 2 cas. Pour les 2 autres, le recours à la DVP a été indispensable. Le pronostic était défavorable chez un patient. Nous n’avons pas eu de cas de saignement de gros vaisseaux. Pour la plupart des auteurs, les lésions des gros vaisseaux sont rares et représentent environ 1% des VCS [21,33].
Complications post operatoires
La fuite du LCS a concerné 15 de nos patients soit 9,68% et est la complication la plus fréquente au cours de notre étude comme lors de celles de plusieurs autres auteurs [30,33, 40] et peut mener à une ventriculite ou une méningite [28]. Une fuite ou un épanchement sous-cutané du LCS signe un échec [9]. Une augmentation de la pression intracrânienne se traduisant par une fuite du LCS peut survenir dans la période postopératoire précoce car la restauration du mécanisme de résorption des granulations arachnoïdiennes n’est pas immédiate, il faudra pour cela un temps d’adaptation [3,26]. Des ponctions lombaires sont nécessaires durant cet intervalle. Kombogiorgas et Sgouros [19] pensent que la fuite du LCS dans la période postopératoire immédiate est au contraire associée à une réussite de la VCS. La prise en charge de nos patients a été dominée par la suture secondaire de la plaie opératoire associée à des ponctions lombaires déplétives.
L’infection a concerné 7 patients soit 4,52%. Schroeder et al [34] ont rapporté un cas de suppuration de plaie ayant entrainé une méningite puis un décès par défaillance multi viscérale 4 semaines après la procédure. Sanoussi et al [31] sur 144 patients ayant bénéficié d’une VCS n’ont rapporté aucun cas d’infection.
Un cas d’hyperthermie à 38,7°C a été détecté chez un patient. L’hyperthermie transitoire peut être liée à un dysfonctionnement hypothalamique ou à une inflammation aseptique de l’épendyme et persister 48 heures après la VCS. Notons également qu’elle pourrait être liée à la résorption des hémorragies. L’hyperthermie postopératoire sans signe clinique ni bactériologique de méningite n’est toujours pas considérée comme une complication [34].
Un patient a développé un diabète insipide qui a été pris en charge avec une évolution favorable. Cette situation pourrait être liée à un traumatisme de la tige pituitaire. Di Rocco et al [7] quant à eux, ont rapporté le cas d’un enfant de 2 ans porteur d’une malformation de Dandy Walker ayant eu un diabète insipide définitif après VCS.
Une patiente de 38 ans (0,65%) a présenté en période postopératoire immédiate une pneumencephalie sous tension. La pneumencephalie a été rapportée dans la littérature [32]. Elle pourrait être expliquée chez notre patiente par une perte importante du LCS, suite à une irrigation insuffisante provoquant un décollement sous dural. La fréquence des pneumocéphalies après une VCS est mal évaluée dans la littérature.
L’échec de la procédure a été constaté dans 11 cas (7,1%). Selon Yadav [43], on parle d’échec de la VCS quand il y a une persistance de la symptomatologie ou une progression de la dilatation ventriculaire avec une pression intracrânienne élevée. L’hydrocéphalie est dans ces cas la résultante d’une obstruction de la circulation et d’une absorption défectueuse du LCS : on parle alors d’hydrocéphalie complexe. L’incidence est beaucoup plus élevée chez les patients ayant eu une méningite tuberculeuse. Elle est une cause d’échec de la VCS [43]. Pour certains auteurs le risque d’échec est important, particulièrement chez les enfants de moins d’un an [8,30].
Selon Javadpour [15] et Fritsch [11] l’âge n’est pas une contre-indication ni un facteur de risque opératoire. La réussite de la VCS est plutôt fonction de la cause de l’hydrocéphalie. L’étiologie de l’hydrocéphalie la plus retrouvée pour les échecs durant notre étude était la sténose de l’aqueduc de Sylvius (8 cas). Elle va à l’encontre des données de la littérature selon lesquelles la sténose de l’aqueduc de Sylvius serait l’étiologie qui aurait le meilleur taux de réussite atteignant 90% [2,27]. Pour Cinalli et al [6] la plupart des échecs surviennent chez des patients porteurs d’une myeloméningocèle et d’une malformation de Chiari de type I au cours desquelles une masse intermédiaire peut cacher le plancher du V3, et chez les patients ayant souffert d’une ventriculite, car les repères anatomiques deviennent méconnaissables. Nous pourrions expliquer notre constat par le fait que la sténose de l’aqueduc de Sylvius est plus souvent observée chez les enfants. La prise en charge secondaire a consisté essentiellement à la réalisation d’une DVP. Celle-ci doit être faite chez les patients qui ont une stomie patente et une persistance de la pression intracrânienne au delà de 10 à 15 jours après 3 à 5 ponctions lombaires [44]. Les auteurs coréens [37] préconisent l’implantation simultanée d’un drain ventriculo-péritonéal et la réalisation d’une VCS comme premier choix de traitement de l’hydrocéphalie chez les patients de moins d’un an. Le cathéter ventriculaire doit être placé au niveau de citerne pré-pontine sous guidage endoscopique réduisant ainsi le risque de sténose secondaire par développement de nouvelles membranes arachnoïdiennes. Ils ont rapporté 83,9% de réussite.
On note un seul cas de reprise de VCS. Balthasar et al [1] préconisent en cas d’échec, de tenter d’abord une seconde VCS avant de poser un shunt chez les jeunes enfants, car le taux de réussite de la VCS augmente rapidement 4 mois après la naissance. L’échec précoce peut être lié à un dysfonctionnement du système d’absorption du LCS, soit par immaturité ou soit par défaillance [8,30]. Quant à l’échec tardif, il est lié à l’obstruction de la stomie [9] et varie de 2 à 15% à travers la littérature [8,10]. L’hydrocéphalie obstructive chez les patients très jeunes est généralement une combinaison de problème obstructif et d’absorption [44].
Contrairement à Cinalli et al [6] qui ont rapporté 11 cas (4,7%) d’hygromes sous-duraux, nous n’en avons rapporté qu’un seul soit 0,65%. Le mécanisme physiopathologique associerait une décroissance brutale du volume ventriculaire induite par un drainage brusque lors de la VCS et la traction du parenchyme du lobe frontal chez les patients qui ont déjà un manteau cortical mince [35]. La fenestration de kyste arachnoïdien chez les nouveau-nés est le geste le plus incriminé dans la survenue alors qu’il n’en était pas le cas chez notre patient âgé de 4 ans. Daprès Schroeder [33], les collections sous-durales sont beaucoup plus fréquentes lors de la dérivation ventriculo-péritonéale que lors des VCS.
Comme Ersahin et al [9], nous avons rapporté 2 cas de sténose secondaire de la stomie due probablement à la formation de nouvelles membranes arachnoïdiennes ou une cicatrisation. Une VCS répétitive a été faite avec succès chez un, dans leur cas. Nous avons opté dans un cas à une DVP et dans l’autre cas à une VCS. Selon Mohanty et al [23] une sténose secondaire de la stomie par gliose ou cicatrice est responsable de 6 à 15% des échecs de la VCS. Il représente 4,76% des échecs pour notre étude. Kadrian et al [17] ont rapporté des pourcentages de patients « présumés avoir une VCS fonctionnelle après 5 ans » comme suit : 41% chez des patients âgés de 1 à 6 mois au moment de l’intervention, 58% chez les patients âgés de 6 à 24 mois, et plus de 70% chez les patients âgés de plus de 24 mois. Ces résultats correspondent à ceux des autres auteurs [18].
D’autres complications ont été décrites mais non retrouvées dans notre série telles : une altération transitoire de la mémoire, des troubles du rythme cardiaque, une compartimentalisation secondaire, un syndrome d’amnésie antérograde associé à une boulimie; un désordre de la personnalité; un infarctus frontal, un hématome sous dural aigu…[9]. Schroeder et al [33] recommandent pour minimiser les complications que la stomie soit faite à mi-distance entre les récessus infundibulaires et les corps mamillaires sur la ligne médiane. Ainsi la perforation est localisée juste derrière le dorsum sellae.
Nous avons déploré 2 cas de décès (1,29 %). Ce taux concorde avec certaines données de la littérature [29,33]. Pour d’autres auteurs [33,38], le taux de mortalité est généralement inferieur à 1% et la mort survient après un saignement catastrophique des gros vaisseaux ou soit par arrêt cardiaque per opératoire [21] due à une soudaine augmentation de la pression intracrânienne lors d’une irrigation rapide. Le décès peut aussi survenir longtemps en moyenne 7 ans après la stomie [14] mais le risque est faible [16]. L’examen autopsique dans ces cas révèle une présence de prolifération gliale et de cicatrice confirmant la sténose d’où l’hypertension intracrânienne aigue expliquant le décès [13]. Pour réduire le taux de mortalité associé à un échec de VCS, Mobbs et al [22] ont suggéré de laisser un cathéter ventriculaire et un réservoir sous-cutané à la fin de l’intervention pour permettre des procédures d’urgence en cas de nécessité. L’association échec de la VCS et mort subite ne serait pas seulement liée à la technique mais au profil des patients (hydrocéphalie obstructive). Ces patients sont en fait enclin à une détérioration clinique soudaine, et des épisodes similaires ont été décrites même quand ils sont uniquement traités par DVP lors d’un dysfonctionnement [28,20].
La plus grande étude portant sur les succès de la VCS a été faite en Ouganda et concernait 153 patients âgés de moins de un an. Le taux de succès au sein de cette population était de 53%. Le taux de réussite de la chirurgie chez les patients ayant une myeloméningocele est de 40% contre 70% pour ceux ayant une obstruction aqueducale [42].
Warf et al [43] dans leur pratique en Ouganda, suite à la plus grande série de VCS jamais rapportée, ont mis sur place le CCHU ETV Succes Score’ qui est un important outil d’évaluation de la probabilité de réussite d’une VCS. Il comprend trois items : l’âge, la cause de l’hydrocéphalie et la cautérisation des plexus choroïdes. Ce score varie de 0 à 9. Plus le score est élevé, plus probable est la réussite de la VCS. La cautérisation n’a été réalisée chez aucun de nos patients. MUIR et al [24] dans leur travail intitulé la chirurgie de l’hydrocéphalie dans les pays en voie de développement’ préconisent également la réalisation systématique de la VCS couplée à la cautérisation des plexus choroïdes chez les patients âgés de moins de deux ans.
CONCLUSION
Les complications relatives à la VCS sont non négligeables, dominées par la fuite du LCS et fonction de l’expérience du chirurgien. La sténose de l’aqueduc de Sylvius est l’étiologie dominante de l’hydrocéphalie des complications au cours de notre étude. Un suivi postopératoire rigoureux et une technique bien maitrisée est indispensable pour minimiser les complications.

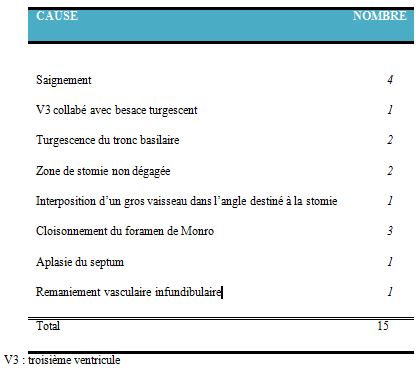
Figure 2
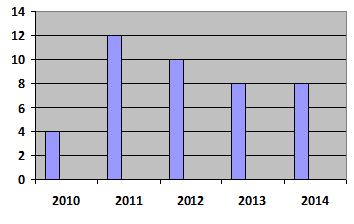
Figure 3
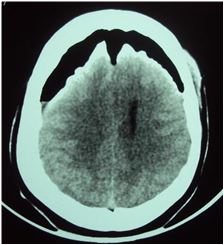
Figure 4
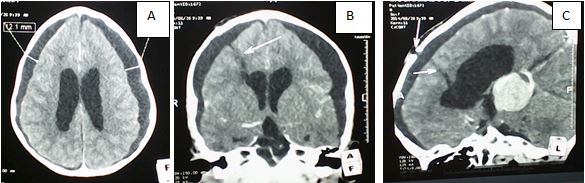
Figure 5
| Per opératoire |
nombre (%) |
post opératoire |
nombre (%) |
| Saignement |
4 (2,58) |
fuite de LCR |
15 (9,68) |
| |
|
Méningite |
6 (3,87) |
| |
|
Obstruction stomie |
2 (1,29) |
| |
|
Suppuration plaie opératoire |
1 (0,65) |
| |
|
Hyperthermie |
1 (0,65) |
| |
|
Diabète insipide |
1 (0,65) |
| |
|
Pneumocephalie |
1 (0,65) |
| |
|
Echec |
11 (7,1) |
| |
|
Hygrome sous dural |
1 (0,65) |
| |
|
Décès |
2 (1,29) |
BIBLIOGRAPHIE
- BALTHASAR AJ, KORT H, CORNIPS EM, BEULS EA, WEBER JW, VLES JS. Analysis of the success and failure of endoscopic third ventriculostomy in infants less than 1 year of age. Childs Nerv Syst:2007;23:151-5.
- BEEMS T, GROTENHUIS JA. Is the success of endoscopic third ventriculostomy age-dependent? An analysis of the results of endoscopic third ventriculostomy in children. Childs Nerv Syst:2002;18:605-608.
- BELLOTTI A, RAPANA A, IACCARINO C, SCHONAUER M. Intracranial pressure monitoring after endoscopic third ventriculostomy: an effective method to manage the ‘adaptation period’. Clin Neurol Neurosurg:2001;103:223-227.
- BUXTON N, PUNT J. Cerebral infarction after neuroendoscopic third ventriculostomy: case report. Neurosurgery:2000;46:999-1002.
- CINALLI G, SAINTE-ROSE C, CHUMAS P, ZERAH M, BRUNELLE F, LOT G, PIERRE-KAHN A, RENIER D. Failure of third ventriculostomy in the treatment of aqueductal stenosis in children. J Neurosurg:1999;90:448-454.
- CINALLI G, SPENNATO P, RUGGIERO C, ALIBERTI F, TRISCHITTA V, CONSIGLIO MB, CIANCIULLI E, MAGGI G. Complications following endoscopic intracranial procedures in children. Childs Nerv Syst:2007;23:633-644.
- Di ROCCO C, CINALLI G, MASSIMI L, SPENNATO P, CIANCIULLI E,TAMBURRINI G. Endoscopic third ventriculostomy in the treatment of hydrocephalus in pediatric patients. In: ickard JD (ed) Advances and technical standards in neurosurgery.Springer, Wien:2006;31:119-219.
- DRAKE JM. Endoscopic third ventriculostomy in pediatric patients: the Canadian experience. Neurosurgery:2007;60:881-886.
- ERSAHIN Y, ARSLAN D. Complications of endoscopic third ventriculostomy. Child Nerv Syst:2008; 24:943-948.
- FENG H, HUANG G, LIAO X, FU K, TAN H, PU H, CHENG Y, LIU W, ZHAO D. Endoscopic third ventriculostomy in the management of obstructive hydrocephalus: an outcome analysis. J Neurosurg:2004; 100:626-633.
- FRITSCH M, KIENKE S, ANKERMANN T, PADION M, MEHDORN M. Endoscopic third ventriculostomy in infants. J Neurosurg:2005;103:50-3.
- FUKUHARA T, VORSTER SJ, LUCIANO MG. Risk factors for failure of endoscopic third ventriculostomy for obstructive hydrocephalus. Neurosurgery:2000;46:1100-1111.
- HADER WJ, DRAKE J, COCHRANE D, SPARROW O, JOHNSON ES, KESTLE J. Death after late failure of third ventriculostomy in children.J Neurosurg:2002;97:211-215.
- HOPF NJ, GRUNERT P, FRIES G, RESCH KDM, PERNECZKY A. Endoscopic third ventriculostomy: outcome analysis of 100 consecutive procedures. Neurosurgery:1999;44:795-806.
- JAVADPOUR M, MALLUCI C, BRODBELT A, GOLASH A, MAY P. The impact of endoscopic third ventriculostomy on the management of newly diagnosed hydrocephalus in infants. Pediatr Neurosurg:2001;35:131-5.
- JAVADPOUR M, MAY P, MALLUCI C. Sudden death secondary to delayed closure of endoscopic third ventriculostomy. Br JNeurosurg :2003;17:266-269.
- KADRIAN D, VAN GELDER J, FLORIDA D, JONES R, VONAU M, TEO C, et al. Long-term reliability of endoscopic third ventriculostomy. Neurosurgery:2008;62:614-21.
- KOCH-WIEWRODT D, WAGNER W. Success and failure of endoscopic third ventriculostomy in young infants: Are there different age distributions? Childs Nerv Syst:2006;22:1537-41.
- KOMBOGIORGAS D, SGOUROS S. Assessment of the influence of operative factors in the success of endoscopic third ventriculostomy in children. Child Nerv Syst:2006;22:1256-1262.
- Mc DONNELL GV, Mc CANN JP. Why do adults with spina bifida and hydrocephalus die? A clinic base study. Eur J Pediatr Surg 10(Suppl):2000;1:31-32.
- McLAUGHLIN M, WAHLIG J, KAUFMAN A, ALBRIGHT A. Traumatic basilar aneurysm after endoscopic third ventriculostomy: case report. Neurosurgery:1997;41:1400-1403.
- MOBBS RJ, VONAU M, DAVIES MA. Death after late failure of endoscopic third ventriculostomy: a potential solution. Neurosurgery:2003;53:384-386.
- MOHANTY A, VASUDEV MK, SAMPATH S, RADHESH S, SASTRY KOLLURI VR. Failed endoscopic third ventriculostomy in children: Management options. Pediatr Neurosurg:2002;37:304-9.
- MUIR R.T, WANG S, WARF BC. Global surgery for pediatric hydrocephalus in the developing world: a review of the history, challenges, and future directions. Neurosurg Focus:2016;41 (5):E11
- NAVARRO R, GIL-PARRA R, REITMAN AJ, OLAVARRIA G, GRANT JA, TOMITA T. Endoscopic third ventriculostomy in children: early and late complications and their avoidance. Child Nerv Syst:2006;22:506-513.
- NISHIYAMA K, MORI H, TANAKA R. Changes in cerebrospinal fluid hydrodynamics following endoscopic third ventriculostomy for shunt-dependent noncommunicating hydrocephalus. J Neurosurg :2003; 98:1027-1031.
- OGIWARA H, DIPATRI AJJR, ALDEN TD et al. Endoscopic third ventriculostomy for obstruction hydrocephalus in children younger than 6 months of age. Child Nerv Syst:2010; 26:343-347.
- PERETTA P, CINALLI G, SPENNATO P, RAGAZZI P, RUGGIERO C, ALIBERTI F, CARLINO C, CIANCIULLI E, MAGGI G (2007) Long term results of secondary ETV in children. Retrospective analysis of 40 cases. J Neurosurg:2009;65:539-547.
- PROUST F, MELOT A, DERREY S et al. Efficacité à long terme de la ventriculocisternostomie endoscopique du 3e ventricule. Neurochirurgie:2008;54:668-686.
- SACKO O, BOETTO S, LAUWERS-CANCES V et al. Endoscopic third ventriculostomy: outcome analysis in 368 procedures. J Neurosurg Pediatrics:2010;5:68-74.
- SANOUSSI S, KELANI A, CHAIBOU MS, BAOUA M, ASSOUMANE I, SANI RM, ADDO G, ABARCHI H. Les malformations de Dandy-Walker: aspects diagnostiques et apport de l’endoscopie : à propos de 77 cas. AJNS:2013;32:3-13.
- SAXENA S, AMBESH SP, SAXENA HN KUMAR R. Pneumocephalus and convulsions after ventriculoscopy :a potentially catastrophic complication. J Neurosurg Anesthesiol:1999;11:200-2
- SCHROEDER HWS, NIENDORF W-R, GAAB MR. Complications of endoscopic third ventriculostomy. J Neurosurg:2002;96:1032-1040.
- SCHROEDER HWS, OERTEL J, GAAB MR. Incidence of complications in neuroendoscopic surgery. Childs Nerv Syst:2004;20:878-883.
- SGARAMELLA E, CASTELLI G, SOTGIU S. Chronic subdural collection after endoscopic third ventriculostomy. Acta Neurochir (Wien):2004;146:529-530.
- SOKAL P, BIRSKI M, RUSINEK M, PACZKOWSKI D, ZIELINSKI P, HARAT A. Endoscopic third ventriculostomy in treatment of hydrocephalus. Videosurgery Miniinv:2012; 7:280-285.
- STAN H, POPA C, IOSIF A, NISTOR S. Combined endoscopically guided third ventriculostomy with prepontine cistern placement of the ventricular catheter in a ventriculo-peritoneal shunt: Technical note.Minim Invasive Neurosurg:2007;50:247-50.
- TEO C, RAHMAN S, BOOP FA, CHERNY B. Complications of endoscopic neurosurgery. Childs Nerv Syst:1996;12:248-253.
- TEO C: Third ventriculostomy in the treatment of hydrocephalus: experience with more than 120 cases. Minimally Invasive Techniques for Neurosurgery. Berlin: Springer, 1998;2:73-76.
- VOGEL TW, BAHULEYAN B, ROBINSON S et al. The role of endoscopic third ventriculostomy in the treatment of hydrocephalus. J Neurosurg Pediatrics:2013;12:54-61.
- WALKER ML. Complications of third ventriculostomy. Neurosurg Clin N Am:2004;15:61-66.
- WARF BC. Hydrocephalus in Uganda: The predominance of infectious origin and primary management with endoscopic third ventriculostomy. J Neurosurg:2005;102:1-15.
- WARF BC, MUGAMBA J, KULKARNI AV. Endoscopic third ventriculostomy in the treatment of childhood hydrocephalus in Uganda: report of a scoring system that predicts success. J Neurosurg Pediatrics:2010;5:143-148.
- YADAV YR, MUKERJ G, PARIHAR V, SINHA M and PANDEY S. Complex hydrocephalus (combination of communicating and obstructive type): an important cause of failed endoscopic third ventriculostomy. BMC Research Notes: 2009;2:137.