|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CLINICAL STUDIES / ETUDES CLINIQUES
ETAT DES LIEUX DE LA NEUROMYELITE OPTIQUE (NMO) EN COTE D’IVOIRE.
CURRENT STATUS OF NEUROMYELITIS OPTICA (NMO) IN COTE D’IVOIRE.
E-Mail Contact - YAPO-EHOUNOUD Constance :
constanceyapoehounoud@gmail.com
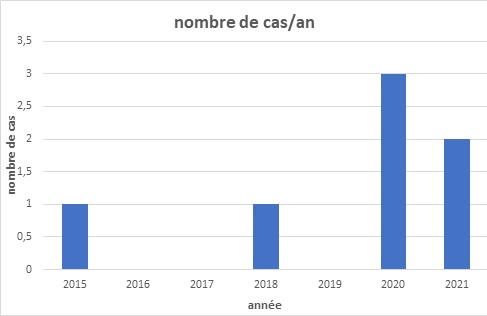
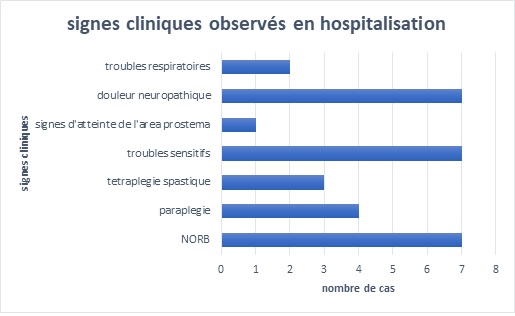
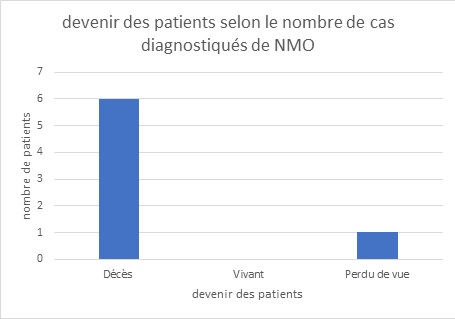
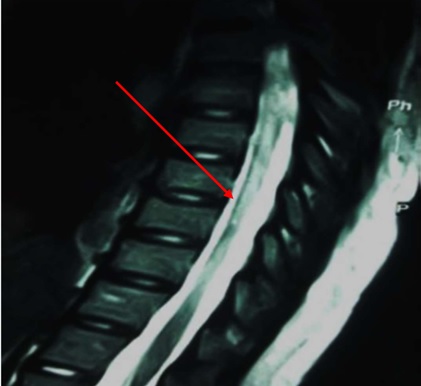
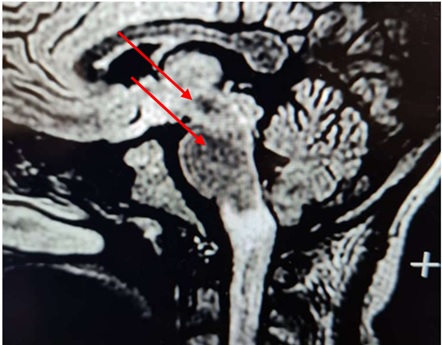
RESUME Introduction La Neuromyélite optique (NMO) est une affection chronique démyélinisante du système nerveux se manifestant par des épisodes récurrents de myélite extensive associés à une névrite optique rétrobulbaire. L’imagerie et le dosage des anticorps (Ac) anti-aquaporine 4 (AQP4) ont révolutionné le diagnostic de cette affection. Elle reste encore sous diagnostiquée dans notre contexte de travail. Objectif Décrire les aspects cliniques, paracliniques, thérapeutiques et évolutifs des patients atteints de NMO en côte d’Ivoire. Méthodologie Etude rétrospective descriptive menée de Janvier 2015 à Juin 2021 au sein du service de neurologie du CHU de Cocody (Abidjan, Côte d’ivoire) et ayant inclus tous les patients pour qui le diagnostic de NMO a été retenu. Résultats La prévalence hospitalière de la NMO était de 2‰. L’âge moyen était de 31 ans avec une prédominance féminine. La paraplégie et la névrite optique rétrobulbaire (NORB) ont été retrouvées dans la majorité des cas. Les patients répondaient aux critères de Wingerchuck et on notait une positivité des Ac anti AQP4 dans 86% des cas. Le traitement a reposé sur les corticoïdes et l’azathioprine. 86% des patients sont décédés un an après le diagnostic. Conclusion La NMO demeure une affection chronique rare et redoutable dans notre contexte de travail. Mots-clés : Neuromyélite optique, Côte d’ivoire, prise en charge. ABSTRACT Introduction Neuromyelitis optica (NMO) is a chronic demyelinating disorder of the nervous system manifested by recurrent episodes of extensive myelitis associated with retrobulbar optic neuritis. Imaging and anti-aquaporin 4 (AQP4) antibody testing have revolutionized the diagnosis of this condition. It is still under-diagnosed in our context. Aim To describe the clinical, paraclinical, therapeutic and evolutionary aspects of patients with NMO in Côte d’Ivoire. Methodology Retrospective descriptive study conducted from January 2015 to June 2021 in the neurology department of the University Hospital of Cocody (Abidjan, Ivory Coast) and included all patients for whom the diagnosis of NMO was retained. Results The hospital prevalence of NMO was 2‰. The mean age was 31 years with a female predominance. Paraplegia and retrobulbar optic neuritis were found in the majority of cases. The patients met the Wingerchuck criteria and were positive for AQP4 antibodies in 86% of cases. Treatment was based on corticosteroids and azathioprine. 86% of patients died one year after diagnosis. Conclusion NMO remains a rare and challenging chronic condition in our working context. Keywords: Neuromyelitis optica, Ivory Coast, management. INTRODUCTION La neuromyélite optique (NMO) ou maladie de Devic est une maladie inflammatoire idiopathique démyélinisante et nécrosante caractérisée par une névrite optique et une myélite transverse, simultanément ou isolément (2). Longtemps apparentée à la sclérose en plaques, cette affection neurologique chronique fait maintenant partie d’un groupe bien dissocié et distinct de pathologies inflammatoires du système nerveux central (SNC), identifiées sous le nom de NMOSD (NMO Spectre Disorders) ou encore NOMAD (NMO Associated Diseases). Elle se caractérise principalement par une myélite extensive et une atteinte optique évoluant simultanément par poussées entrecoupés de rémissions (6,11). Le NMO-IgG est le marqueur identifié à ce jour pour le diagnostic de la NMO et est à la fois sensible et spécifique (10). Le traitement en phase aiguë comprend des stéroïdes intraveineux et/ou une thérapie d’échange plasmatique (10). Les agents immunosuppresseurs sont recommandés pour la prophylaxie des rechutes. Le pronostic de la NMO est sévère, en particulier chez les personnes présentant des rechutes précoces et récurrentes (10). La neuromyélite reste le plus souvent méconnue et de diagnostic difficile (6,11). L’avènement de l’IRM et surtout des anticorps sériques spécifiques AQP4 ou anti-NMO a permis une avancée notable dans la reconnaissance de cette affection. Depuis 2015, elle a été identifiée en Côte d’Ivoire (11) et à ce jour plus de cinq cas ont été diagnostiqués. Cependant dans notre contexte tropical, sa reconnaissance et sa prise en charge demeurent encore difficiles. OBJECTIF Décrire les aspects cliniques, paracliniques, thérapeutiques et évolutifs des patients atteints de la NMO en côte d’Ivoire. METHODOLOGIE Nous avons réalisé une étude rétrospective descriptive hospitalière sur 78 mois (6 ans) allant de Janvier 2015 à Juin 2021, au sein du service de neurologie du CHU de Cocody Abidjan, principal service public de neurologie en Côte d’Ivoire (35 lits sur un total de 53 lits dans le secteur public). Nous avons inclus tout patient adulte hospitalisé pour une myélopathie extensive associée à une baisse de l’acuité visuelle, chez qui le diagnostic de NMO a été posé selon les critères de Wingerchuk 2015 (Tableau 1). Les patients ayant refusé de participer à l’étude et ceux dont les dossiers étaient incomplets n’ont pas été inclus. Les données socio-démographiques, cliniques, paracliniques, thérapeutiques et évolutives des patients ont été recueillies puis analysées. Le score EDSS (Expanded Disability Status Scale) a été utilisé pour l’évaluation du handicap. RESULTATS Données épidémiologiques Nous avons recensé 7 cas documentés de NMO sur 3556 patients hospitalisés de Janvier 2015 à Juin 2021 dans le service ce qui fait une prévalence hospitalière de 2‰. Le sex ratio était de 0,17 avec une nette prédominance féminine (6 cas/7) (Figure 1) et l’âge moyen était de 31,28 ans. Nos patients résidaient tous à Abidjan. Ils avaient un niveau d’instruction supérieur dans 58% des cas et étaient étudiants. Un cas par an en moyenne a été diagnostiqué. L’année 2020 a enregistré le plus de cas (Figure 2). Données cliniques Les données cliniques majeures de tous les 7 patients figurent dans le tableau 2. Les patients consultaient en moyenne dans un délai de 2 ans après l’apparition des premiers symptômes marqués par une baisse de l’acuité visuelle (BAV) régressive (100%). La symptomatologie clinique était dominée par une NORB dans 100% des cas (Figure 3). Le nombre moyen de poussées était de 4 au moment du diagnostic. Données paracliniques Le dosage des anticorps anti-aquaporines 4 ou anti-NMO s’est avéré positif chez 6 patients. Un seul était séronégatif. Ils présentaient tous des lésions médullaires multiples et pluri-étagés (Images 1-3) en référence aux critères de Wingerchuk 2015 (Tableau 1). L’IRM encéphalique a été réalisée dans 5 cas et montrait des lésions en hyposignal T1 dans le tronc cérébral (Image 4). L’étude du LCR a montré une pléiocytose de 15 éléments/mm³ en moyenne avec hyperprotéinorachie. La présence de bandes oligoclonales a été retrouvée pour un patient avec un index Ig G positif. Le profil électrophorétique du LCR donnait majoritairement un pic polyclonal dans 5 cas. Données thérapeutiques Tous nos patients ont reçu un bolus de prednisone 1g pendant trois jours en hospitalisation en phase aigüe (100%). L’azathioprine a été initiée en traitement de fond dans 4 cas. Une seule patiente a reçu du rituximab. Données évolutives et pronostiques Deux patientes ont présenté une infection nosocomiale pulmonaire à Klebsiella pneumoniae. Trois patientes ont présenté des troubles respiratoires réfractaires. Une patiente a bénéficié d’une prise en charge en réanimation (Figure 4). 6 patients sur 7 sont décédés (Figure 5). DISCUSSION La neuromyélite optique est une affection rare (2,6,11) comme en témoigne notre étude. Maïga et al (7) ont retrouvé une prévalence inférieure à la nôtre (4 cas en 5 ans). Gaye et al (5) en revanche dans leur série sénégalaise, ont colligé plus de cas, 16 patients en 7 ans. L’âge moyen de nos patients était de 31,28 ans avec une nette prédominance féminine, similaire à ceux rapportés dans la littérature et se superposant à ceux de Maïga et Gaye (5,7). Ailleurs en Tunisie (4), Nabli rapportait plutôt un âge moyen de 38 ans en faveur des femmes. Le délai de consultation moyen de nos patients était de 2 ans. Celui-ci explique le retard diagnostic accusé et également les présentations cliniques observées. Ce constat est identique à ceux des séries subsahariennes décrites (5,7). Les manifestations cliniques observées étaient dominées par l’atteinte médullaire et la baisse de l’acuité visuelle, tout comme rapporté par l’équipe de Fatma en Tunisie en 2018 (4). La névrite optique rétrobulbaire a été décrite dans 100% des cas. Les lésions médullaires ont été retrouvées dans tous les cas. Abdulhakeem et al ont fait des constats similaires dans leur série marocaine (1). Le diagnostic positif est affiné par l’IRM médullaire retrouvant une myélite longitudinale étendue supérieure à trois métamères ou segment vertébraux (6). L’IRM encéphalique lorsqu’elle est réalisée est anormale dans 60% des cas avec 6% de cas de lésion évocatrice d’une NMO (6). Dans notre cas, l’IRM encéphalique n’a pu être réalisée chez tous les patients du fait surtout du coût financier, à la charge des patients. La positivité des Ac Anti NMO a été l’argument majeur du diagnostic. Notre étude a rapporté cependant un cas séronégatif qui concernait le seul homme de la série. Rekik et al ont décrit 25% de cas positifs de NMO (9) associés à des atypies. Il pourrait s’agir d’une prédisposition génétique liée au sexe féminin selon Maïga et al qui notent dans leur série que la prédominance de la NMO en région tropicale suggère la présence de facteurs favorisant la NMO dans ces pays. Les difficultés diagnostiques ont été décrites dans d’autres observations en Afrique subsaharienne aussi bien par Yapo-Ehounoud (11), Kadjo, Gaye et Maïga (5,6,7). Ces difficultés diagnostiques, peuvent-être dues non seulement à la méconnaissance de cette affection mais aussi à la difficulté de la réalisation du bilan paraclinique (IRM, étude du LCR, dosage des Ac anti-NMO), dont le coût total approximatif est évalué à environ 400 000 FCFA en Côte d’Ivoire, soit environ 608€, qui est à la charge du patient. Il n’existe pas de réelle couverture sociale nationale et le salaire minimum ivoirien est de 60000 FCFA (soit ≈91€), ce qui ne permet pas de recouvrir tous les coûts engendrés par la prise en charge. Sur le plan thérapeutique, l’arsenal est diversifié et repose sur les immunosuppresseurs en traitement de fond tandis que la corticothérapie et les immunoglobines intraveineuses servent à la phase aigüe lors des poussées, à diminuer l’inflammation (3). Sur le marché ivoirien les médicaments du traitement de fond sont disponibles en majorité, mais l’azathioprine reste le moins couteux (50000 FCFA soit ≈76€). Tous nos patients ont pu bénéficier durant leurs poussées, de bolus de corticoïdes à forte dose. Selon les directives du Programme National français de Diagnostic et de Soins (PNDS) sur les NMOSD (3), une efficacité de l’azathioprine sur la réduction du risque de poussée de NMO a été montrée par plusieurs études rétrospectives. Ces études ont rapporté une diminution du taux annualisé de poussée après l’instauration de ce traitement comparé à une période sans traitement (8,10). L’efficacité parait meilleure pour une dose au moins égale à 2mg/kg/j. Le maintien d’une corticothérapie associée par voie orale durant les six premiers mois de traitement a été recommandé pour optimiser l’efficacité de ce traitement (8). Dans notre série,4 patients ont bénéficié de cette molécule car financièrement plus accessible pour eux. Gaye et al à Dakar ont également utilisé l’azathioprine. Le traitement de fond repose en 2e intention sur le rituximab (anti-CD20) devant les NMOSD réfractaires aux immunosuppresseurs plus classiques (azathioprine, mycophénolate mofétil, cyclophosphamide, mitoxantrone). Progressivement son utilisation s’est faite de plus en plus précocement (3) avec des études observationnelles montrant un contrôle des poussées possiblement supérieur au mycophénolate mofétil et à l’azathioprine (3). Enfin, l’étude de Tahara en 2020 publie sur un faible nombre de patients l’effet bénéfique du rituximab sur la prévention des poussées (11). Une seule patiente de notre série a reçu du rituximab, tout comme dans la série malienne. Ce traitement n’a été possible qu’avec un appui extérieur car extrêmement onéreux (≈1500 € la cure en Côte d’Ivoire). Le décès a été rapporté dans la majorité des cas (6/7) au bout d’un an de suivi en moyenne. Ce pronostic s’explique essentiellement par le coût de la prise en charge lourd pour les patients et leurs familles, car essentiellement étudiants, donc dépourvus de sources de revenus propres et de ce fait, soutenus par quelques personnes du cercle familial à court terme (3 mois en moyenne). Rekik et al (9), ainsi que Gaye et al trouvaient un taux de décès bien moins sombre que le nôtre en raison d’une médiane de suivi plus longue. CONCLUSION La neuromyélite optique reste rare dans notre contexte de travail car encore méconnue et sous diagnostiquée. De plus l’imagerie et le dosage des AQP4 ainsi l’arsenal thérapeutique, atouts majeurs dans la prise en charge de cette affection chronique, demeurent onéreux pour les patients, grevant ainsi le pronostic à long terme des patients atteints.
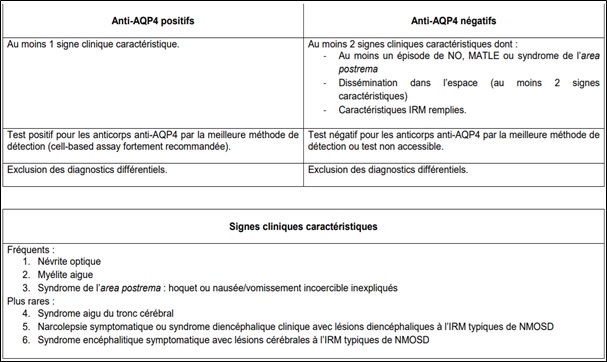
Tableaux Tableau 1 : critères de WINGERCHUK 2015
Tableau 2: Données cliniques des 7 patients chez qui le diagnostic de NMO a été retenu.
EDSS = (Expanded Disability Status Scale) ; NORB = Névrite optique rétrobulabire
FIGURES
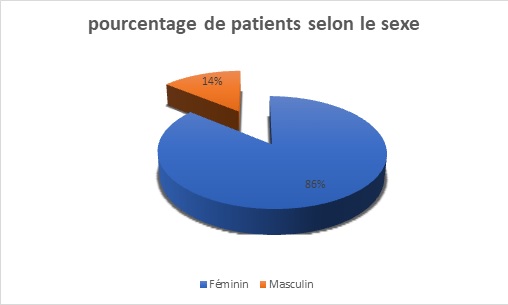 Figure 1 : répartition des 7 patients atteints de NMO selon le sexe.On note une nette prédominance féminine
Iconographies
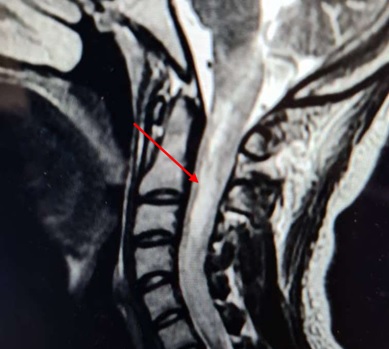 Image 1 : IRM cervicale prenant la charnière cervico-occipitale, coupe sagittale hypersignaux intramédullaires en FLAIR
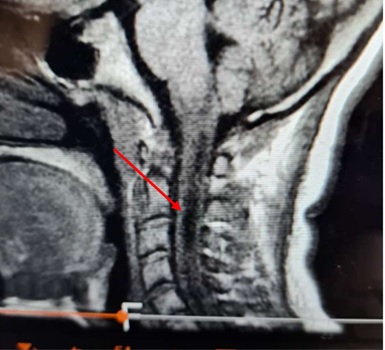 Image 2 : IRM cervicale prenant la charnière cervico-occipitale, coupe sagittale hypersignaux intramédullaires en T1
REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647