
|
|
|
CLINICAL CASE/CAS CLINIQUE
LE XANTHOASTROCYTOME PLÉOMORPHE DE L’ANGLE PONTO CEREBELLEUX : UN CAS RARE CHEZ L’ENFANT
PLEOMORPHIC XANTHOASTROCYTOMA OF CEREBELLOPONTINE ANGLE: a rare case in children.
KA Kanta
3
E-Mail Contact - MBAYE Maguette :
maguette.mbaye8@gmail.com
RESUME : Le xanthoastrocytome pléomorphe (PXA) est une tumeur gliale rare, retrouvée chez les enfants et les jeunes adultes. Ses caractéristiques radiologiques l’amènent à être souvent confondue avec le méningiome. C’est une tumeur du sujet jeune et se développe généralement au niveau supra tentoriel. Les cas de PXA infra tentoriels sont exceptionnels. Observation: Après exérèse, l’histopathologie était en faveur d’un PXA grade II, avec des caractéristiques typiques de prolifération astrocytaires polymorphes. Une hydrocéphalie et une méningocèle occipitale sont apparus dans les suites opératoires. Ils ont été pris en charge par une dérivation ventriculopéritoneale. Avec un recul de 11 mois, son état est resté stable sans complications. Conclusion: Mots clés : xanthoastrocytome pléomorphe, enfant, neurochirurgie.
SUMMARY Pleomorphic xanthoastrocytoma (PXA) is a rare glial tumor found in children and young adults. Its often confused with meningiomas. It is a tumor of the young. It is a tumor of the young, generally developing at the supra tentorial level. Cases of PXA are exceptional. Observation: A 7-year-old child with nasosinusal polyposis. revealed a mass in the right cerebellopontine angle, initially suggestive of a meningioma. Initially suggestive of a meningioma. After excision, the histopathology was PXA grade II, with typical features of polymorphous astrocytic polymorphic astrocytic proliferation. Hydrocephalus and an occipital meningocele occipital meningocele. They were managed ventriculoperitoneal shunt. After 11 months, the patient’s condition remained stable with no complications. Conclusion: This case highlights the importance of including PXA in the differential diagnosis of posterior cerebral fossa tumors, particularly in children. Early and accurate recognition of this entity is crucial for appropriate management and improved clinical outcomes for patients with PXA. Key words: pleomorphic xanthoastrocytoma, child, neurosurgery. Introduction Le xanthoastrocytome pléomorphe (PXA) est une forme rare de tumeur gliale. Il représente seulement 1% des astrocytomes [4]. Selon la 5ème édition de la classification de l’organisation mondiale de la santé, le PXA est soit bénin (grade II) soit anaplasique (grade III) [14]. Cette tumeur est l’apanage de l’enfants et de l’adulte jeune et se localise dans 98% des cas au niveau de l’étage supratentoriel [19]. Les formes superficielles se développent aux dépens des leptoméninges dans 67% des cas [4]. Par conséquent, il prend un aspect à l’imagerie mimant d’autres natures lésionnelles notamment le méningiome qui constitue l’un des principaux diagnostiques différentiels. Les PXA infra tentorielles sont rares avec 29 cas répertoriés dans la littérature de 1979 en 2023 dont un seul cas pédiatrique de PXA de l’angle ponto cérébelleux (APC) [1]. Nous partageons un cas de xanthoastrocytome pléomorphe de l’APC. Apres avoir effectué des recherches dans la base de donnée de PubMed, AJOL et Google Scholar, il s’agira là, du deuxième cas de la littérature survenant chez l’enfant. Le PXA est un diagnostic à évoquer devant une tumeur de l’APC du sujet jeune. Observation Clinique : Il s’agit d’un enfant de 7 ans, qui a bénéficié d’une exérèse endoscopique de polypes nasosinusiens il y a 2 ans suite à un syndrome rhino sinusal chronique qui évoluait depuis l’enfance. Une exploration tomodensitométrie cérébrale avait permis la découverte d’une lésion de l’angle ponto cérébelleux droit qui motiva la référence du patient au service de neurochirurgie du centre hospitalier de Fann pour la poursuite de sa prise en charge. À l’interrogatoire, il présentait des céphalées chroniques d’aggravation progressive et des troubles de l’équilibre à la marche. L’examen retrouvait un syndrome cérébelleux cinétique. Cependant il n’y avait pas d’atteinte des nerfs crâniens, ni de déficit sensitif et/ou moteur. Imagerie : La tomodensitométrie (TDM) cérébrale mettait en évidence une formation tissulaire bien limitée arrondie, à base d’implantation méningée tentorielle de l’angle ponto cérébelleux droit mesurant 12x15x13 mm, hyperdense et rehaussée de manière homogène après injection de produit de contraste ( figure 1).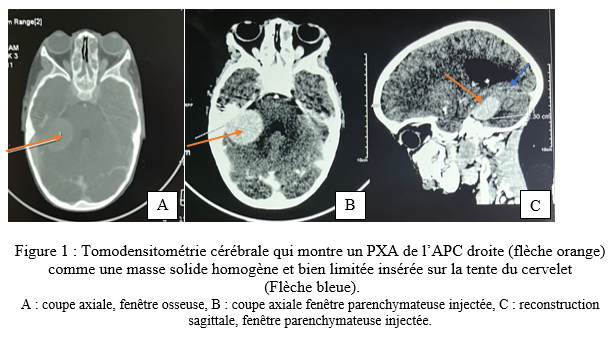 Une imagerie par résonnance magnétique (IRM) a été réalisée en complément pour mieux caractériser la lésion. L’IRM encéphalique montrait une lésion de 37,4 x 36,6 x 29,4 mm, extra axiale insérée sur la tente du cervelet à droite, iso intense en T1, hyper intense en T2 et rehaussée fortement après injection de Gadolinium (figure 2). 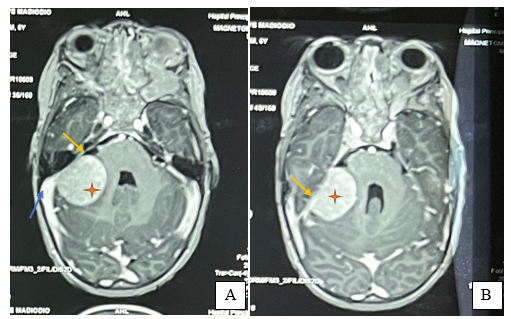 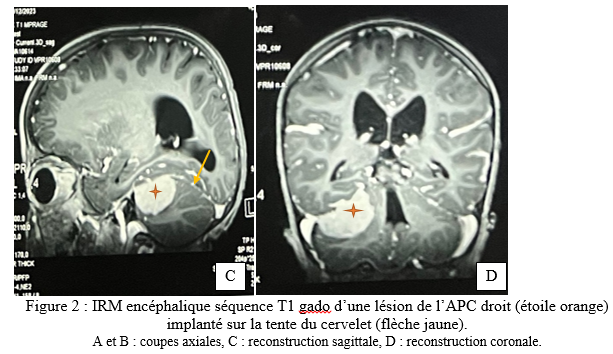 Traitement : Une craniectomie sous occipitale élargie à l’APC droit avait été réalisée. En per opératoire, nous avions identifié une lésion blanche nacrée, peu hémorragique bien limitée n’infiltrant pas le cervelet et séparée des nerfs crâniens par de l’arachnoïde. Son implantation sur la tente a été coagulée lors de l’exérèse. La tomodensitométrie post opératoire avait montré une exérèse complète et une hydrocéphalie active (figure 3). Le patient avait bénéficié d’une dérivation ventriculo-péritonéale. À Trois (3) mois de la chirurgie, l’évolution était favorable avec un amendement des céphalées et la régression des troubles de l’équilibre. À 6 mois puis à 11 mois de suivi, l’état du patient est stationnaire avec une valve fonctionnelle. 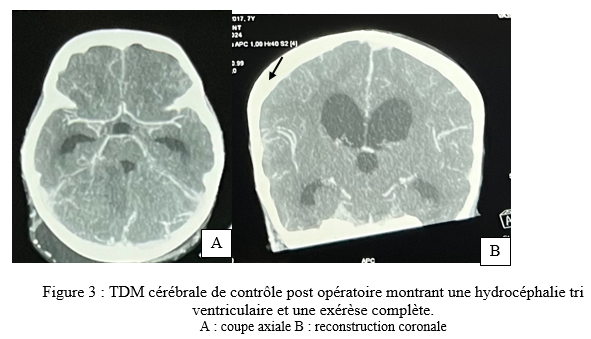 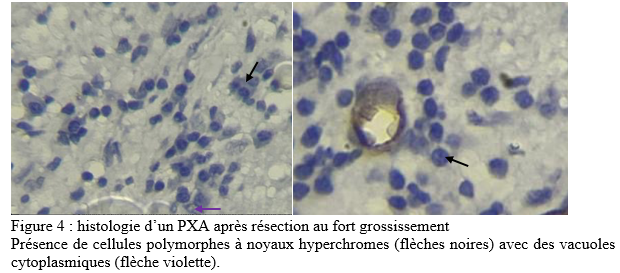 Discussion Le xanthoastrocytome pléomorphe (PXA) a été décrit pour la première fois en 1979 par Kepes et Rubinstein comme étant une tumeur astrocytaire de bas grade [7]. Il est classé parmi les gliomes astrocytaires circonscrits dans la 5ème édition de la classification de l’OMS des tumeurs du système nerveux central de 2021 [13]. Le PXA est très rare, représentant seulement 1% des tumeurs gliales et moins de 0,3% des tumeurs primitives du SNC dans le registre américain des tumeurs primitives cérébrales [17] . Il s’agit d’une tumeur de l’enfant et de l’adulte jeune avec un pic entre 10-19 ans et un âge moyen au diagnostic à 29+/-16 ans sans différence de sexe rapportée[10,19]. La présentation clinique dépend de la localisation de la tumeur et elle est commune à tout processus expansif intra crânien. Le PXA se développe majoritairement au niveau de l’étage sustentoriel particulièrement au niveau lobe temporal dans 49% des cas[4]. Chez les enfants, la fosse cérébrale postérieure notamment le cervelet est le site de prédilection du développement des tumeurs du système nerveux central. Les plus fréquentes étant d’abord le médulloblastome, l’astrocytome pylocytique, l’épendymome ainsi que l’hémangioblastome dans le cadre de la maladie de Von Hippel-Lindau. Les tumeurs de l’angle ponto cérébelleux chez l’enfant sont beaucoup plus rare. Il s’agit le plus souvent de schwanomes dans le cadre d’une neurofibromatose, de kystes dermoides ou épidermoides, de tumeurs rhabdoides tératoides et des gangliogliomes [8]. A cette liste, nous pouvons ajouter les PXA. Dans une revue de 1979 à 2023, 29 cas de PXA de la fosse cérébrale postérieure ont été répertoriés[1]. La tumeur de notre patient était localisée au niveau de l’APC alors que deux cas seulement étaient retrouvé dans la littérature dont un cas pédiatrique décrit par Kurschel en 2006 [11]. La majorité des PXA de l’angle ponto cérébelleux étant associée à un gangliogliome et sont appelés des formes composites [5]. L’aspect commun du PXA à l’imagerie est un kyste avec un nodule mural prenant le contraste[14]. Cependant, l’imagerie des PXA de la fosse cérébrale postérieure n’ont pas beaucoup été détaillés dans la littérature car cette localisation reste encore exceptionnelle. Les rares cas décrits ont des localisations surtout médianes ou hémisphériques dans le cervelet. Il se présente habituellement comme une masse charnue isodense à la TDM et en signal intermédiaire à l’IRM rehaussée après injection de contraste [6,10]. La lésion présente une double composante kystique et charnue chez le cas publié par kurschel [11] alors qu’elle était purement solide chez notre patient. Il n’y a pas de caractéristiques spécifiques décrites concernant le rehaussement leptoméningé des PXA. Par rapport aux méningiomes qui représentent leur principal diagnostic différentiel, le signe de la queue durale est présente dans 67% de PXA avec une atteinte des trois feuillets méningés dans 13% des cas [18], ce qui rend difficile leur diagnostic. Le PXA serait issu des astrocytes sous piales expliquant son développement superficiel et impliquant à des degrés variables les leptoméninges. La tumeur infiltre le parenchyme et s’étend dans les espaces péri vasculaires [4]. Son pléomorphisme est lié à la présence de cellules fusiformes et de cellules géantes multi nucléés, contenant des vacuoles lipidiques avec des dépôts de corps granuleux éosinophiles et réticuliniques. À l’immunohistochimie la positivité des marqueurs GFAP ( protéine de l’acide fibrillaire gliale) et PS100 indique l’origine astrocytaire de la tumeur [7]. De plus, il existe des altérations génétiques comme la mutation BRAF V600E et la délétion homozygote de CDKN2A et/ou CDKN2B impliquées dans l’activation de la voie de signalisation MAPK. Et, la forte prévalence de ces mutations explique leur association fréquente à la neurofibromatose de type 1[20]. Chez notre patient, la recherche d’une mutation BRAF et d’une neurofibromatose nous aurait permis de vérifier cette thèse. Près de 77% PXA sont bénins (grade II histologique) définis par un index mitotique <1% selon la classification OMS 2021. La forme anaplasique ou grade III implique la présence de nécrose et/ou de plus de 5 mitoses pour 10 champs [16]. A ce jour, il n’existe aucune technique codifiée de résection des PXA. L’idéal est une exérèse macroscopiquement totale. Il constitue un des facteurs pronostiques majeurs de survie sans récidive. Chez notre patient une résection complète par morcellement suivie de la coagulation de l’insertion méningée a été réalisée. En effet, même si le PXA est généralement de bon pronostic, plusieurs revues ont confirmé le grade histologique, l’âge et l’étendue de la résection comme étant les facteurs pronostiques significatifs sur la survie globale et la survie sans récidive des malades [3]. Dans une méta-analyse portant sur 325 patients, la survie sans progression et la survie globale à 5 ans est de 51,2% et 78% respectivement. Les patients de moins de 20 ans et ceux qui ont bénéficiés d’une résection macroscopiquement totale ont une meilleure survie[16]. Ainsi, le taux de récidive sur les PXA grade II partiellement réséqué est plus élevé comme démontré dans l’étude de Lee et al [12]. Les PXA grades III anaplasiques représentent 10 à 20% des PXA et peuvent survenir de novo ou par transformation des grades II dans 20% des cas [6]. Leur pronostic est moins favorable avec une survie médiane à 49 mois contre 209 mois pour les grade II [15]. Les formes évolutives et récidivantes sont pourvoyeuses de métastases léptoméningées, d’où l’intérêt d’une IRM encéphalo medullaire dans le bilan d’extension avant une radio chimiothérapie adjuvante. De nombreuses études rejettent le recours systématique de la radiothérapie et/ou chimiothérapie adjuvante dans les PXA grade II. Elles n’ont aucun impact significatif dans l’amélioration de la survie des malades[1,3–8]. Au contraire, elles peuvent être délétères chez les sujets âgés et réduire leur survie [9]. Cependant, la radiothérapie cranio-spinale en cas de dissémination leptoméningée et la chimiothérapie dans les formes évolutives restent indiquée chez le sujet jeune. Chez notre patient, un traitement adjuvant n’était indiqué après avis de la réunion de concertation multidisciplinaire en oncologie pédiatrique. Toutefois, une surveillance est de préconisée afin de détecter précocement une récidive sur le long terme. Cependant, l’utilisation des inhibiteurs BRAF comme le vemurafinib ou dabrafenib, est associée à un meilleur pronostic des PXA avec mutation BRAFV600E [2]. Toutefois d’autres études sont nécessaires afin de trouver une relation entre l’utilisation de cette thérapie ciblée et la survie globale des patients. Conclusion Le xanthoastrocytome pléomorphe de l’angle ponto cérébelleux chez l’enfant est exceptionnel. Ses caractéristiques radiologiques peuvent facilement prêter à confusion avec des types de tumeurs beaucoup plus fréquents notamment le méningiome ou le schwannome vestibulaire. Ce cas démontre l’intérêt d’évoquer le PXA devant toute tumeur de l’APC car son pronostic dépend essentiellement de l’approche chirurgicale en dehors du type histologique. Une exérèse macroscopiquement totale garantit une survie meilleure. Référence
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647