CLINICAL STUDIES / ETUDES CLINIQUES
L’HEMANGIOPERICYTOME (A PROPOS DE 8 CAS)
HEMANGIOPERICYTOMA (ABOUT 8 CASES)
- Department of neurosurgery, Ibn Rochd, University Hospital, Casablanca, Morocco
- Department of anatomopathology, Ibn Rochd, University Hospital, Casablanca, Morocco
RESUME
Description
L’hémangiopéricytome est une tumeur rare, mésenchymateuse, qui prend naissance au niveau des péricytes de Zimmerman. Il est souvent confondu avec le méningiome.
Objectif
Faire le point sur cette entité histologique souvent méconnue.
Méthodes
Une étude rétrospective de 8 cas d’hémangiopéricytome colligés au Service de Neurochirurgie de l’hôpital Ibn Rochd de Casablanca au Maroc, entre 2000 et 2008.
Résultats
Il s’agissait de 6 hommes et 2 femmes. L’âge moyen de nos patients était de 50 ans. Le délai moyen de diagnostic était de 4,75 mois. Le tableau clinique était dominé par les signes d’hypertension intracrânienne. Le bilan neuroradiologique a objectivé le caractère unique des lésions, une taille moyenne de 6,33 cm. Tous nos patient ont été traité par chirurgie avec résection subtotale dans 5 cas et totale dans le reste. Un patient a bénéficié de la radiothérapie post opératoire. L’évolution a été marquée par l’apparition d’une récidive, 3 cas de reprise évolutive et un décès. L’apparition de métastases n’a pas été notée dans notre série.
Conclusion
L’hémangiopéricytome se caractérise par son potentiel malin, son taux élevé de récidive et de métastase à distance. Son évolution est imprévisible nécessitant une surveillance prolongée.
Mots clés : Cellules de Zimmerman, Hémangiopéricytome, Méningiome
SUMMARY
Description
Hemangiopericytoma is a rare soft tissue tumor, which originates from the cells of Zimmerman. It is often confused with the meningioma.
Goals
An update of this rare histological entity.
Methods
In this retrospective study, we report 8 cases of primitive cerebral hemangiopericytomas observes in the department of neurosurgery at the hospital centre Ibn Rochd of Casablanca from Morocco between 2000 and 2008.
Results
There were 6 men and 2 women. The mean age of our patients is about 50 year old. Most often symptoms were intracranial high pressure. The complete neuroradiological examination visualized the distinctive nature of the lesions, a mean volume about 6.33cm. All our patients have been treated by surgery with subtotal resection in 5 cases and total in the remnant cases. Three patients received postoperative radiotherapy. There were several recurrences and one death. We did not observe metastases in our series.
Conclusion
Hemangiopericitoma is characterized by its malignant potential,a high rate of recurrences and metastasis. The evolution is unpredictable requiring a prolonged follow up.
Keys words : hemangiopericytoma, cells of Zimmerman, meningioma
INTRODUCTION
L’hémangiopéricytome cérébral (HPC) est une nouvelle entité anatomopathologique qui était confondue avec les méningiomes. Il représente moins de 1% des tumeurs intracrâniennes et moins de 2,5% des tumeurs méningées (9). Sa clinique est non spécifique et l’imagerie (TDM et IRM) peut être trompeuse et porter à tort le diagnostic de méningiome. Seul l’examen anatomopathologique peut trancher et donner le diagnostic exact grâce à l’histologie et à l’Immunohistochimie. Des nouvelles techniques d’imagerie sont en voie d’essaie notamment le PET scan et la spectrométrie par résonnance magnétique pouvant apporter de l’aide au diagnostic préopératoire des hémangiopéricytomes. L’objectif de ce présent travail était d’analyser les caractéristiques épidémiologiques, cliniques, radiologiques, anatomopathologiques, thérapeutiques et évolutives avec une revue de la littérature.
PATIENTS ET METHODES
Notre travail est une étude rétrospective à propos de 8 cas d’hémangiopéricytomes intracrâniens, colligés au service de Neurochirurgie du CHU Ibn Rochd de Casablanca au Maroc durant une période de 8 ans (2000-2008). Le diagnostic histologique est confirmé chez tous les patients.
RESULTATS
I – Données épidémiologiques
Entre 2000 et 2008, 8 cas d’hémangiopéricytomes ont été opérés au service de neurochirurgie de Casablanca contre 302 méningiomes dans la même période soient 2.64% des méningiomes. L’âge des patients variait entre 17 et 78 ans avec une moyenne d’âge de 50 ans et une prédominance masculine (sex ratio : 3/1).
II – Données cliniques
Le délai diagnostique variait de 1 mois à 1 an avec une moyenne de 4,75 mois. Le tableau clinique était dominé par les signes d’hypertension intracrânienne, des crises convulsives dans 3cas, une hémiparésie dans 3 cas, une paralysie faciale dans deux cas, un syndrome cérébelleux chez deux patients, une tuméfaction crânienne dans 1 cas (tableau1).
III – Données radiologiques
1. Tomodensitometrie (photo1)
La TDM cérébrale a été réalisée dans 6 cas et a objectivé le caractère unique des lésions, une taille moyenne de 6,33 cm. L’étage sustentoriel était intéressé dans 5 cas, avec une prédominance frontopariétale. Les lésions explorées avant injection de produit de contraste étaient spontanément iso denses dans 4 cas, hyperdenses dans 2 cas. Après l’injection du PDC, les lésions ont été rehaussées de façon hétérogène dans 5 cas.
2. Imagerie par résonance magnétique (photo2)
En IRM cérébrale, les lésions apparaissaient en iso signal T1 dans 87,5% des cas, en hyper signal T1 dans 12,5 %, 50% en hyper signal T2 ,25% en iso T2 et 25% en hypo T2. Toutes les lésions ont été rehaussées d’une façon hétérogène dans 5 cas et de manière homogène dans les autres cas. L’effet de masse était noté chez tous les patients. L’dème péri lésionnel et l’effet de masse étaient présents dans toutes les lésions. Une attache méningée était notée dans 3 cas.
3. Artériographie cérébrale
L’artériographie cérébrale a été réalisée chez un seul de nos patients (photo 3) et a objectivé une tumeur hyper vasculaire essentiellement alimentée par des branches des deux carotides externes. Sur cet aspect, un méningiome atypique hyper vasculaire ou un hémangiopéricytome ont été évoqué.
IV – Traitement
Le phénobarbital a été prescrit dans les 8 cas pour traiter ou prévenir des crises convulsives. Les corticoïdes ont été prescrits pour traiter l’dème périlésionel. La voie d’abord dépendait de la localisation de la tumeur. L’exérèse totale de la tumeur est recommandée, toutefois celle-ci n’était pas toujours facile ou possible. Dans cette série, 5 patients ont bénéficié d’une exérèse subtotale et 3 patients ont eu une exérèse totale. Les difficultés opératoires étaient représentées essentiellement par le saignement per opératoire vue que la tumeur est très hémorragique (5 cas), l’adhérence au sinus longitudinal supérieur (2 cas) et l’adhérence au sinus latéral et au confluent des sinus (1 cas). Une embolisation pré opératoire a été réalisé chez un seul cas afin de palier au saignement per opératoire. Le diagnostic anatomopathologique était obtenu après chirurgie chez tous nos patients (photos 4et5).
Trois patients ont été adressés en radiothérapie avec une dose totale de 56 Gray répartit en 20 séances de 2.5 Gray avec 4 séances par semaine.
V – Evolution
L’évolution a été marquée par l’apparition d’une récidive après un délai de trois ans, 3 cas de reprise évolutive avec 6 reprises dans un cas et 1 reprise dans 2 cas. Un décès dans 1 cas. L’apparition de métastases n’a pas été notée dans notre série.
DISCUSSION
L’HPC est une tumeur rare, bien que susceptible de se développer dans tous les tissus possédant un réseau capillaire, elle représente 2-3% des tumeurs malignes des tissus mous toutes localisations confondues (8). L’HPC méningée représente moins de 1% des tumeurs intracrâniennes et moins de 2 ,5% des tumeurs méningées (3, 13, 17, 19). La localisation intracrânienne est beaucoup plus fréquente que celle intrarachidienne (4, 7). Une nette prédominance masculine avec un pourcentage de 56,4% à la différence des méningiomes ou
on note une prédominance féminine. L’HPC intracrânien tend à survenir à des âges précoces par rapport aux méningiomes (8, 12, 21).
L’HPC intracrânien représente une distribution similaire à celle des méningiomes (17). Des localisations intra ventriculaires ont été décrites mais restent exceptionnelles (17). Un cas au niveau de la région pinéale (2) et 6 cas d’HPC sellaire ont été rapportés (19). La localisation intra parenchymateuse est exceptionnelle.
La symptomatologie clinique, non caractéristique dépend de la localisation et la taille de la tumeur. Dans la littérature ,7 cas d’HPCs ont été révélés par une hémorragie méningée (1, 5, 14).
Peu spécifiques, la TDM et l’IRM ne peuvent trancher catégoriquement entre HPCs et méningiomes vu la similitude de leurs caractères radiologiques ; cependant, elles apportent d’importants éléments pour les neurochirurgiens, concernant la taille de la tumeur, sa localisation, ses rapports avec les structures adjacentes et l’importance de sa vascularisation afin de guider leur geste thérapeutique. L’angiographie présente un intérêt tout à fait particulier du fait de l’origine vasculaire de l’hémangiopéricytome. Elle peut servir parfois, pour l’embolisation préopératoire, ou rarement postopératoire, après résection chirurgicale de la tumeur avec un saignement artériel persistant (11).
L’hémangiopéricytome est une tumeur vasculaire dans la définition est avant tout histologique. Elle présente trois caractéristiques essentielles :(18)
- Les cellules tumorales proviennent du péricyte.
- La présence de fibres de réticuline entre les cellules tumorales.
- La prolifération tumorale est extraluminale.
L’immunohistochimie permet de différencier l’hémangiopericytome des autres tumeurs méningées (4, 18) notamment les méningiomes (fibroblastique et malin plus rarement), et la tumeur fibreuse solitaire. Les principaux anticorps utilisés sont (4,18):
- Le marqueur du tissu conjonctif : LA VIMENTINE : HPC est constamment et diffusément positif à la vimentine.
- Les marqueurs épithéliaux : CYTOKERETINE et EMA (antigène épithélial membranaire) : Ils ne sont pas exprimés par les cellules tumorales, même si des positivités très focales ont été rapportées dans les HPCs. Toutefois, la négativité des marqueurs épithéliaux notamment pour l’EMA est considérée comme un élément essentiel du diagnostic différentiel avec les méningiomes.
- Les marqueurs vasculaires :
— CD34 ou « Human hematopoietic progenitor antigen » : Le CD34 est un marqueur assez peu spécifique qui est positif dans un certain nombre de tumeurs comme le dermatofibrosarcome de Darier et Ferrand , la tumeur fibreuse solitaire et les neurofibromes.
— CD31 : c’est une glycoprotéine transmembranaire d’adhésion, Les HPCs sont CD31 négatifs.
— Le facteur VIII (facteur VIII remated Antigen) : C’est un marqueur de la cellule endothéliale très spécifique mais peu sensible.
- Les autres marqueurs :
— La protéine S100 : HPC est habituellement négative.
— Les récepteurs hormonaux : Ils ont été très peu étudiés dans les hémangiopéricytomes.
Le traitement de l’hémangiopéricytome est avant tout chirurgical. Les autres méthodes (embolisation, irradiation ou chimiothérapie) ne pouvant être que complémentaires, visant à améliorer le pronostic local et général. Les difficultés opératoires sont en rapport essentiellement avec l’hyper vascularisation de la tumeur et les causes de la limite de l’exérèse totale notamment la localisation de la tumeur et l’extension aux organes de voisinages. Le taux d’exérèse totale annoncé dans la littérature varie entre 50% et 83% (9, 10). Cependant, la résection totale de la tumeur n’est pas synonyme de non récidive et non métastase. Nombreux auteurs ont démontré la radiosensibilité des HPCs (16). Ils notent de plus que la réponse au traitement dépend aussi de la taille de la tumeur, ainsi les résultats les plus encourageants étaient obtenus avec des lésions inférieures à 5 cm (6). La chimiothérapie a démontré un effet modeste avec toxicité acceptable après chirurgie et radiothérapie sur les HPCs cérébraux (6).
L’HPC est une tumeur dont la malignité est locale par les récidives locales, et générale par les métastases à distance (2, 15). C’est une tumeur imprévisible, d’évolution lente, dont l’étude nécessite plusieurs années d’observation. L’incidence des récidives locales quelque soit la localisation varie selon les séries de 27% à 80% (10, 12, 20). Trois facteurs influence la récurrence locale des HPCs :
- Qualité de l’exérèse.
- Pratique ou non de la radiothérapie post opératoire.
- La durée de suivie des malades opérés.
La dissémination métastatique se fait au sein du système nerveux central par voie du LCR, expliquant les localisations extra-axiales. Dans les métastases extra-nevraxiques, la dissémination se fait par voie hématogène. Les deux sites métastatiques les plus fréquents sont l’os et le poumon. La prise en charge des métastases repose sur la chirurgie si possible et sur la radiothérapie.
CONCLUSION
HPC est une tumeur dont le comportement est imprévisible et dont l’évolution est marquée par la survenue de récidive, le délai d’apparition de ces récurrences est très variable ce qui signifie une surveillance à long terme. La clinique de l’hémangiopéricytome est non spécifique. L’imagerie (TDM et IRM) peut être trompeuse et porter à tort le diagnostic de méningiome. Seul l’examen anatomopathologique peut trancher et donner le diagnostic exact grâce à l’histologie et à l’immunohistochimie.
Tableau1 : Tableau synoptique résumant les caractéristiques cliniques, thérapeutiques et évolutifs des malades.
| Observation |
Age/sexe |
Clinique |
Imagerie |
Traitement |
Evolution |
| 1 |
17/H |
3 mois : Céphalées, convulsions, paralysie faciale droite |
Lésion fronto-pariétale droite |
chirurgie |
bonne |
| 2 |
78/H |
1mois : masse occipitale |
Lésion occipito-pariétale droite |
Chirurgie+radiothérapie |
6 reprises évolutives |
| 3 |
44/F |
1an : hemiparésie droite |
Lésion fronto-pariétale gauch |
Chirurgie+radiothérapie |
1 reprise évolutive |
| 4 |
73/H |
2mois : Céphalées, vertiges, paralysie faciale gauche |
Lésion fronto-pariétale gauche |
Chirurgie+radiothérapie |
1reprise évolutive |
| 5 |
49/H |
3mois : céphalées |
Lésion occipitale gauche |
Chirurgie |
bonne |
| 6 |
56/F |
2 mois : Céphalées, convulsions, hémiparésie droite |
Lésion temporale droite |
Chirurgie |
décès |
| 7 |
33/H |
1an :convulsions, hémiparésie droite |
Lésion pariétale droite |
Chirurgie |
récidive |
| 8 |
50/H |
3mois : syndrome cérébelleux |
Lésion frontale gauche |
Chirurgie |
Perdu de vue |
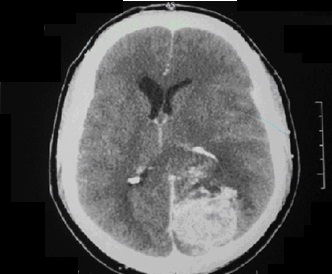
Figure 1
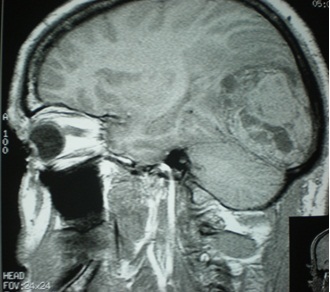
Photo 2
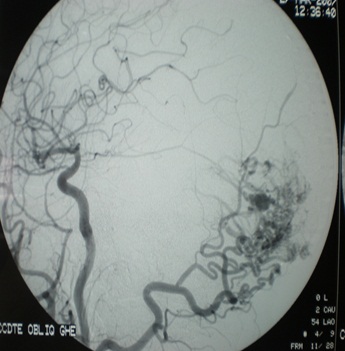
Photo 3
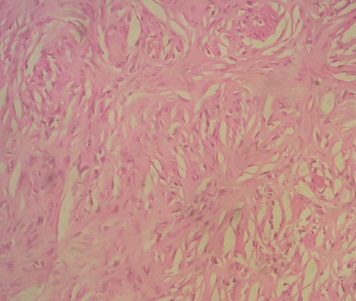
Photo 4
Photo 5
BIBLIOGRAPHIE
- AJANI OA, EJECTAN GC, RAZA A. Hemangiopéricytoma presenting as acute subdural haematoma. Br J Neurosurg. 2003;17:559-561.
- ALÉN JF, LOBATO RD, GÓMEZ PA, BOTO GR, LA GARES A, RAMOS A, RICOY JR. Intracranial hemangiopericytoma: Study of 12 cases. Acta Neurochir. (Wien). 2001;143:575-586.
- BORG MF, BENJAMIN CS. Hemangiopericytoma of the central nervous system. Austral Radiol. 1995;39:36-41.
- BOUVIER-LABIT C., LIPRANDI A., PIERCECCHI, HOSSEINI H., HENIN D., FIGARELLA-BRANGER D. Apport de l’immunohistochimie et de la microscopie électronique dans le diagnostic des Hémangiopéricytomes méningés (à propos de 15 cas). Ann. Pathol., 2000, 20 (5) : 492-498.
- BRUNORI A, DELITALA A, ODDI G, CHIAPETTA F. Recent experience in the management of meningeal hemangiopericytomas. Tumori. 1997;83:856-860.
- CHAMBERLAIN Z. et al. Sequential salvage chemotherapy four recurrent intracranial hemangiopericytoma. Neurosurgy. 2008;63(4):720-727.
- DUFOUR H, BOUILLOT P, FIGARELLA-BRANGER D, NODOYE N, REGIS J, NJEE BUGHA T, GRISOLI F. Hémangiopéricytome méningés : Revue rétrospective de 20 cas. Neurochirurgie. 1998;44:5-18.
- ENZINGER FM., WEISS SW. Soft tissue tumors. CV mosby compagny, St Louis, Third edition, 1995.
- ECKER RD, MARSH WR, POLLOCK BE et al. Hemangiopéricytoma in the central nervous system: Treatement, pathological features and long term follow up in 38 patients. J Neurosurg 2003;98:1182-1187.
- FOUNTAS KN, KAPSALAKI E, KASSAM M et al. Managment of intracranial méningial hemangiopéricytomas: outcome and experience. Neurosurg Rev 2006;29:145-153.
- GEORGE B, CASASCO A, DEFFRENNES D, HOUDART E. Intratumoral embolization of intracranial and extracranial tumors: technical note. Neurosurgery. 1994;35:771-773.
- HISASHI S,YASUSHI H, KEIJI O et al. Intracranial hemangiopericytoma with extracranial metastasis occurring after 22 years. Neurol Med Chir (Tokyo). 2002;42:207-300.
- MASANORI S, SAKATA K-I. Four cases of meningeal hemangiopericytoma treated with surgery and radiotherapy. Jap. J Clin Oncol. 2001;31:548-552.
- MARUYA J, SEKI Y, MORITA K, NISHIMAKI K, MINAKAWA T. Meningeal hemangiopericytoma manifesting as massive intracranial hemorrhage-two case reports. Neurol Med Chir. 2006.
- MC MASTER MJ, SOULE EH, IVINS JC. Hemangiopericytoma. A clinicopathologic study and long-term follow up of 60 patients. Cancer. 1975;36:2232-2244.
- MOLNAR P, NEMES Z. Hemangiopericytoma of the cerebello-pontine angle. Diagnosis pitfalls and the diagnosis value of the subunit A of factor XIII as a tumor marker. Clin Neuropathol. 1995;14:19-24.
- NABEEL AB, ROCCO D. Intraventricular Hemangiopéricytoma. Annals of Diagnostic Pathology. 2004;8(6):347-351.
- NEMES Z. Differentiation markers in hemangiopericytoma. Cancer, 1992, 69: 133-140.
- JALALI R, SRINIVAS C, NADKARNI TD, RAJASEKHARAN P. Suprasellar haemangiopericytoma-challenges in diagnosis and treatment. Acta Neurochir (wien). 2008;150:67-71.
- SOYUER S, CHANG EL, SELEK U et al. Intracranial méningial HPC: the role of radiotherapy. Cancer. 2004;100:1491-1497.
- WORLD HEALTH ORGANISATION CLASSIFICATION OF TUMORS (WHO). Pathology and Genetics. Tumors of the Nervous System (chapter 11). IARC Press, Lyon 2000.





