
|
|
|
CASE REPORT / CAS CLINIQUE
PERTINENCE DU NEUROMONITORING MULTIMODAL DANS LES LESIONS DOUBLES : A PROPOS DE LA PRISE EN CHARGE, A L’HOPITAL NEUROLOGIQUE DE LYON, D’UNE SCOLIOSE CONGENITALE AVEC DEFICIT NEUROLOGIQUE RAPIDE
RELEVANCE OF MULTIMODAL NEUROMONITORING IN DUAL LESIONS: ABOUT THE MANAGEMENT, IN LYON NEUROLOGICAL HOSPITAL, OF CONGENITAL SCOLIOSIS WITH RAPID NEUROLOGICAL DEFICIT
E-Mail Contact - BASSOLE Prisca-Rolande :
rolandebassole@gmail.com
RESUME Nous rapportons un cas illustrant qu’une évaluation clinique, radiologique et neurophysiologique exhaustive est obligatoire avant une chirurgie de scoliose sévère. Une patiente a été référée pour bénéficier d’une correction chirurgicale d’une scoliose congénitale malformative. L’examen clinique à l’admission a révélé une tétraparésie qui a imposé un changement urgent de stratégie chirurgicale. L’imagerie par résonance magnétique a objectivé un neurofibrome C2-C3. Les potentiels évoqués somesthésiques (PES) des membres supérieurs et inférieurs étaient normaux mais les potentiels évoqués moteurs (PEM) étaient abolis. Leur réapparition peropératoire lors de la résection du neurofibrome a précédé une amélioration clinique progressive. La récupération spectaculaire des PEM a permis une correction de la déformation de la colonne vertébrale sous surveillance peropératoire plusieurs mois plus tard. Mots clés :Monitoring peropératoire – Neurofibrome – Scoliose– Potentiels évoqués moteurs – Potentiels évoqués somesthésiques ABSTRACT We report a case illustrating that exhaustive clinical, radiological and neurophysiological assessment is mandatory before severe scoliosis surgery. A patient was referred for surgical correction of congenital malformative scoliosis. Clinical examination admission revealed a tetraparesis that enforced an urgent change in surgical strategy. Magnetic Resonance Imaging disclosed a C2-C3 neurofibroma. Upper and lower limbs somatosensory evoked potentials were normal but motor evoked potentials (MEPs) were abolished. Their intra-operative reappearance at the time of neurofibroma resection preceded a progressive clinical improvement. The spectacular MEPs recovery allowed correction of the spinal deformity under intraoperative monitoring several months later. Keywords: Intra-operative monitoring – Motor evoked potentials – Neurofibroma – scoliosis – Somatosensory evoked potentials INTRODUCTION La scoliose congénitale malformative (SCM) est définie comme une déformation de la colonne vertébrale secondaire à une anomalie de développement. Son incidence serait estimée à 0,5-1 pour 1000 naissances (10). Le développement embryonnaire des vertèbres est étroitement lié à celui de la moelle spinale et des organes du mésoderme. De ce fait, la scoliose congénitale est souvent associée à des anomalies intra spinales et à d’autres défauts d’organes (2). En raison de la fréquence élevée des anomalies associées à l’intérieur et à l’extérieur de la colonne vertébrale (3), un historique détaillé, un examen physique minutieux et des bilans paracliniques sont obligatoires lors de la prise en charge de la SCM. La chirurgie vise à corriger la déformation de la colonne vertébrale et à prévenir la courbure compensatoire ainsi que les complications neurologiques (16)]. Le déficit neurologique est l’un des risques les plus graves lors de la chirurgie corrective des déformations de la colonne vertébrale et la surveillance neurophysiologique peropératoire est fortement recommandée (18,9) pour prévenir les lésions neurales. Les patients sont donc orientés vers des équipes chirurgicales qualifiées, qui ont la possibilité de surveiller les voies motrices et sensorielles pendant la correction de la scoliose. Cependant, ces déficits neurologiques peuvent être présents en préopératoire, principalement dans les cas de scolioses non idiopathiques. Ainsi, des évaluations neurologiques et neurophysiologiques préopératoires, en l’occurrence les potentiels évoqués moteurs et somesthésiques, sont recommandées afin d’identifier les patients qui peuvent être suivis avec succès (1). Les Potentiels Evoqués Moteurs (PEM) correspondent à une réponse musculaire survenant à une latence fixe après une stimulation magnétique à divers étages, cortical ou rachidien. Ils reflètent l’activité électrique produite le long de la voie pyramidale depuis le cortex moteur jusqu’à la périphérie en passant par le tronc cérébral et la moelle spinale. Les potentiels Evoqués Somesthésiques (PES) quant à eux, correspondent à la réponse d’une population neuronale survenant à une latence fixe après stimulation électrique des membres inférieurs ou supérieurs et reflètent l’activité électrique produite le long de la voie lemniscale depuis le nerf périphérique en passant par la moelle spinale, le tronc cérébral, le thalamus et enfin le cortex sensitif primaire. Ces potentiels évoqués sont réalisés à la recherche d’une atteinte motrice et/ou sensitive infra clinique ou pour confirmer une suspicion clinique d’un syndrome pyramidal ou lemniscal (9). Nous rapportons ici le cas illustratif d’une jeune patiente ayant des antécédents de scoliose congénitale malformative, adressée à l’hôpital Neurologique de Lyon par une association caritative, la Chaîne de l’Espoir, afin de bénéficier d’une chirurgie de correction supervisée par un suivi neurophysiologique. CAS CLINIQUE Il s’agissait d’une jeune fille de 17 ans qui présentait une scoliose malformative thoraco-lombaire congénitale liée à une hémi-vertèbre L1. Elle a été maintenue dans un appareil orthopédique pendant 18 mois sans résultat satisfaisant. La scoliose a été considérée comme malformative et une correction chirurgicale de la déformation a été indiquée. Avec l’aide d’une organisation non gouvernementale (ONG), la « Chaîne de l’espoir », elle a voyagé en 2018 du Mali jusqu’à Lyon, 7 jours avant une opération prévue au service de Neurochirurgie de l’hôpital neurologique. Lors de son admission, elle présentait un déficit moteur important des membres supérieurs et inférieurs, apparu au cours des 2 mois précédant l’opération et qui ne pouvait pas être expliqué par la déformation de la colonne vertébrale. Depuis son arrivée en France, elle se plaignait de douleurs dorsales et la marche était devenue impossible. L’évaluation clinique a révélé un syndrome pyramidal avec une prédominance proximale du déficit moteur des membres supérieurs et inférieurs. L’examen somatosensoriel était quasi normal, à l’exception d’une hypoesthésie tactile au membre inférieur droit intéressant les dermatomes de L1 à L4. Les fonctions sphinctériennes étaient préservées. Les potentiels évoqués moteurs (PEM) ont confirmé un dysfonctionnement extrêmement grave des voies pyramidales, puisque les réponses motrices des membres supérieurs et inférieurs étaient bilatéralement abolies après stimulation magnétique transcrânienne du cortex moteur, alors que les réponses à la stimulation magnétique de la colonne vertébrale étaient normales. Les potentiels évoqués somesthésiques (PES) des membres supérieurs et inférieurs étaient normaux (Fig. 1). Une imagerie par résonance magnétique (IRM) de la colonne vertébrale a été réalisée d’urgence et a montré une lésion extramédullaire intradurale en C2-C3, rehaussée de façon homogène après injection de gadolinium, suggérant un neurofibrome (Fig. 1). L’IRM du cerveau était normale et aucun antécédent familial ne pouvait suggérer une éventuelle neurofibromatose. La résection chirurgicale de la lésion cervicale a été réalisée dans les jours suivants, par une approche postérieure standard, sous surveillance des PEM (stimulation électrique transcrânienne et enregistrement musculaire à plusieurs niveaux) et des PES : les réponses des PES étaient préservées et celles des PEM, qui étaient totalement supprimées avant l’ablation de la tumeur, sont réapparues progressivement lorsque la levée graduelle de la compression de la moelle spinale s’est faite (Fig. 1). La résection totale a été réalisée de manière macroscopique et l’examen pathologique a confirmé le diagnostic d’un neurofibrome sans signe de malignité. Un méningocèle postopératoire s’est spontanément constitué et, cliniquement, la motricité s’est progressivement rétablie. La chirurgie de la scoliose a été retardée et, un an plus tard en 2019, l’ONG Chaîne de l’espoir a organisé son deuxième séjour à Lyon pour la prise en charge chirurgicale de la scoliose congénitale thoraco-lombaire à convexité et gibbosité droites. L’examen clinique à ce moment objectivait une marche possible sans aucun support et sans limitation, ni douleur, ni déficit sensitivo-moteur, ni souffrance radiculaire ou trouble vésico-sphinctérien. L’IRM de la colonne vertébrale n’a montré aucune récidive de la tumeur et une réduction de la taille du méningocèle. Les PES préopératoires sont restées normaux et les PEM ont montré une récupération électrophysiologique spectaculaire de la fonction motrice mettant en évidence des réponses normales après stimulation magnétique transcrânienne pour les membres supérieurs et inférieurs (Fig. 2). L’intervention chirurgicale de la scoliose a alors été réalisée sous neuromonitorage peropératoire et a consisté en une résection de la colonne vertébrale postérieure à L1 avec résection de l’hémi-vertèbre, reconstruction antérieure (cage à mailles) et stabilisation de T10 à L4. Les PEM sont restés présents tout au long de la procédure, avec une diminution significative mais très transitoire de l’amplitude de la réponse musculaire du muscle tibial antérieur droit lors de la mise en place d’une tige. L’examen clinique postopératoire était normal à 2 mois de suivi. La patiente était autonome dans les activités de la vie quotidienne avec des scores sur l’échelle visuelle analogique à 0/10 – score EIFFEL (échelle Roland-Morris) à 2/24 – indice d’invalidité d’OSWESTRY à 0/100. DISCUSSION Ce cas clinique met en exergue les différentes difficultés qui peuvent survenir lors de la prise en charge d’une scoliose sévère, encore plus difficile dans les cas de scoliose congénitale malformative. Un examen clinique minutieux, confirmé par les résultats des PEM, a révélé une tétraparésie subaiguë sévère que la scoliose seule ne pouvait expliquer. L’IRM doit être systématiquement planifiée en cas de scoliose malformative justifiant une importante chirurgie de correction (20,22) et doit être effectuée en urgence si des symptômes neurologiques apparaissent. Une exploration complète de la colonne vertébrale, du foramen magnum au sacrum, est obligatoire. Lorsqu’une lésion responsable d’une compression médullaire est révélée, son traitement devient prioritaire par rapport à celui de la scoliose (6). Les PEM et les PES préopératoires permettent dans ce cas d’évaluer la gravité du dysfonctionnement spinal lié à ce processus expansif et la faisabilité d’une surveillance peropératoire. Ceci est corroboré par notre cas clinique qui met en évidence l’étroite corrélation entre les résultats cliniques, les anomalies électrophysiologiques (11), et l’utilité d’une surveillance peropératoire multimodale pour réduire le risque de complications neurologiques (8,17,19). La chirurgie d’exérèse de lésions intra rachidiennes représente un challenge pour les chirurgiens du rachis du fait notamment qu’elle peut s’accompagner de dommage important des voies de la motricité. Les potentiels évoqués somesthésiques ont d’abord été utilisés pour prédire le risque de survenue de déficit sur les grandes voies nerveuses (4,15) au cours des gestes chirurgicaux. Cependant, la spécificité des voies sensitivo-motrices a orienté des travaux de recherche avec le développement de techniques de stimulation électrique transcrânienne, d’abord par Merton et Morton dans les années 1980 (12), qui ont été affinées et ont fait leur apparition dans le domaine du neuromonitoring et utilisées en complément des PES afin d’évaluer l’intégrité fonctionnelle spécifique des voies motrices durant les interventions chirurgicales des lésions intra rachidiennes (7,13). Partant, l’existence de ces deux techniques, PES et PEM, a fait du monitoring peropératoire une procédure de routine dans les centres spécialisés. Néanmoins, la surveillance peropératoire conserve de nombreuses contraintes, la première en rapport avec l’environnement d’enregistrement du fait d’éventuels artéfacts qui peuvent être provoqués tant par le matériel au bloc opératoire que par le geste chirurgical lui-même, la seconde étant liée au management adéquat de l’anesthésie (5) en vue de pouvoir permettre l’enregistrement d’une activité musculaire au niveau des sites de recueil. Tout ceci pouvant être une source technique de réponses difficilement enregistrables voire absentes, faisant conclure à la présence ou non d’anomalies sur les voies sensitivo-motrices ou alerter à tort le chirurgien en cours d’intervention. Ces potentiels évoqués sont cependant plus facilement réalisables en laboratoire d’électrophysiologie où il existe moins de dispositifs parasites et où l’embarras de l’anesthésie ne se pose pas. En général, lorsque les réponses évoquées préopératoires sont d’emblée très altérées, le neuromonitoring peropératoire par la ou les techniques pour lesquelles les réponses n’ont pas pu être obtenues, n’auront pas leur sens (14). Notre patiente en est l’exemple typique vu que les PES représentaient la seule modalité de surveillance utile dans les premières étapes de la chirurgie du neurofibrome, du fait de la suppression initiale des PEM. La rare constatation d’une récupération des réponses motrices lors de la décompression spinale représentait un élément d’excellent pronostic fonctionnel (21). Un délai de plusieurs mois est approprié entre la levée de la compression médullaire et la chirurgie de la scoliose, afin d’obtenir une amélioration clinique et neurophysiologique satisfaisante permettant un suivi peropératoire des PEM pendant la correction de la déformation de la colonne vertébrale. CONCLUSION En résumé, ce cas illustre le fait qu’une évaluation clinique, radiologique et neurophysiologique exhaustive est obligatoire avant le traitement chirurgical d’une scoliose grave. La corrélation claire entre l’état clinique neurologique et les résultats électrophysiologiques a contribué à optimiser la prise en charge neurochirurgicale. En outre, elle attire l’attention des chirurgiens du rachis sur la possibilité de maladies concomitantes de la colonne vertébrale et de la moelle épinière dans le contexte de scoliose. Il souligne également l’importance de prendre en charge les patients souffrant de maladies graves dans une unité spécialisée de « chirurgie de la colonne vertébrale et de la moelle épinière », afin de planifier une période d’observation préopératoire et réaliser une évaluation clinique et paraclinique notamment neurophysiologique avant l’opération.
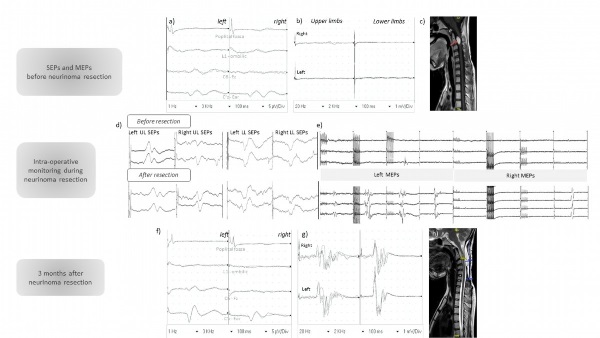 Figure 1 : Première étape : la gestion du neurofibrome
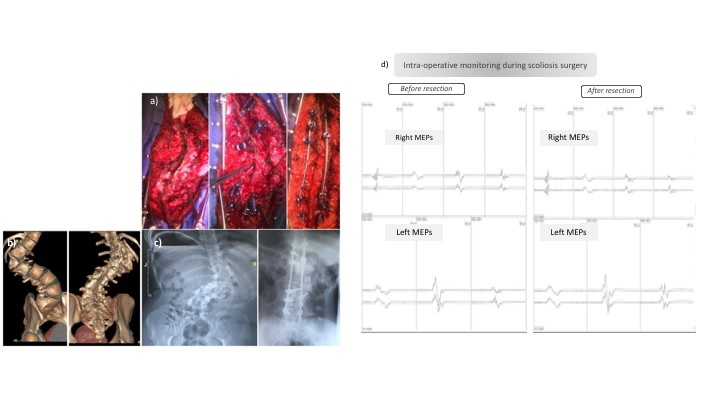 Figure 2 : Deuxième étape : gestion des déformations de la colonne vertébrale REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647