
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CLINICAL STUDIES / ETUDES CLINIQUES
PRISE EN CHARGE NEUROCHIRURGICALE DES MÉNINGIOMES INTRACRÂNIENS À BRAZZAVILLE (RÉPUBLIQUE DU CONGO)
NEUROSURGICAL MANAGEMENT OF INTRACRANIAL MENINGIOMAS IN BRAZZAVILLE (REPUBLIC OF CONGO)
E-Mail Contact - EKOUELE Mbaki Hugues Brieux :
hugues.ekouele-mbaki@umng.cg
RESUME Introduction Les méningiomes constituent des tumeurs intracrâniennes fréquentes chez l’adulte. Le but de la chirurgie est d’obtenir une exérèse complète et l’identification histologique. Le but de cette étude était de décrire la prise en charge neurochirurgicale des méningiomes dans notre contexte. Patients et méthode Nous avons réalisé une étude descriptive, à recueil de données rétrospectif au sein de l’unité neurochirurgicale du CHU de Brazzaville, durant la période du 1e janvier 2014 au 31 décembre 2017 (48 mois). Les paramètres évalués étaient diagnostiques, thérapeutiques et évolutifs. Résultats Nous avons enregistré 47 cas, soit une fréquence de 39,5% et sélectionné 44 cas pour l’étude. Nous avons identifié 12 hommes contre 32 hommes. L’âge moyen était de 57,11 ± 15 ans, avec des extrêmes de 26 et 84 ans. L’hypertension intracrânienne était la principale présentation clinique (81,8%). Vingt-cinq patients ont été opérés (56,8%). L’exérèse tumorale a été classée Simpson I et II dans 47,8% des cas. La mortalité post opératoire était de 16%. Conclusion Les méningiomes de la convexité ont le meilleur pronostic dans notre expérience chirurgicale. La disponibilité des données histologiques et des possibilités de radiothérapie pourrait améliorer la prise en charge des méningiomes de la base du crâne sans possibilités d’exérèse complète. Mots clés : Méningiomes intracrâniens – Exérèse chirurgicale – Mortalité. ABSTRACT Introduction Meningiomas are the most common intracranial tumors in adults. The goal of surgery is total excision and the histopathological findings. The aim of this study was to describe the neurosurgical management of meningiomas in our context of practice. Patients and Method We performed a descriptive and retrospective study into the neurosurgical unit of the University Hospital of Brazzaville, within a period from the 1st January 2014 to the 31st December 2017 (48 months). The parameters evaluated were diagnosis, therapeutics and evolution. Results We recorded 47 cases with a frequency of 39.5% and selected 44 cases. There were 12 men against 32 women. The average age was 57.11 ± 15 years; range, 26-84 years. Intracranial hypertension was the first clinical presentation (81.8%). Twenty-five (25) patients underwent surgery (56.8%), with a removal of the tumor Simpson I and II in 47.8% of cases. Post-operative mortality was 16%. Conclusion Convexity meningiomas have the best prognosis regarding our experience. Histological findings and postoperative radiotherapy can improve the treatment of skull base tumors without possibilities of complete resection. Keywords: Intracranial meningiomas – Surgical resection – Mortality. INTRODUCTION Les méningiomes intracrâniens sont des tumeurs qui se développent aux dépens des cellules arachnoïdiennes des méninges qui recouvrent l’encéphale ; ils ne correspondent donc pas, stricto sensu, à des tumeurs cérébrales. Cependant, leur croissance endocrânienne et les conséquences neurologiques rendent compte du fait qu’ils soient classés parmi les tumeurs cérébrales [5]. Les méningiomes sont les tumeurs primitives intracrâniennes les plus fréquentes chez l’adulte. Ils sont de degré histologique variable [11,12]. Le choix de la modalité de prise en charge chirurgicale dépend des facteurs liés au patient (âge, état général, comorbidités) et au plateau technique. Le but de la chirurgie est d’aboutir à une exérèse la plus complète possible, et de permettre une analyse histologique. En effet, les patients ayant bénéficié d’une exérèse complète présentent un taux de récidive sur 10 ans de l’ordre de 9%, comparés aux patients chez lesquels l’exérèse a été incomplète [16]. En Afrique subsaharienne, l’amélioration de l’accès aux moyens de neuro-imagerie a contribué à faciliter le diagnostic des tumeurs intracrâniennes. En Côte d’Ivoire, les méningiomes constituent 33,43% des tumeurs intracrâniennes, suivis des adénomes hypophysaires (20%) et des astrocytomes (10,30%) [14]. À Brazzaville (République du Congo), les méningiomes représentent 39,62% des tumeurs intracrâniennes, suivis des gliomes de haut grade (35,84%). Mais, leur prise en charge est marquée par une mortalité globale estimée à 38,33%, avec une mortalité post-opératoire à 10% [9,10]. Dans notre contexte, aucune étude n’a été menée concernant la prise en charge des méningiomes qui constituent les tumeurs intracrâniennes les plus fréquentes. Le but de notre étude était de décrire la prise en charge neurochirurgicale des méningiomes intracrâniens, afin de contribuer à réduire le taux de mortalité lié aux tumeurs crânio-encéphaliques. PATIENTS ET MÉTHODE Nous avons réalisé une étude descriptive, à recueil de données rétrospective, du 1e janvier 2014 au 31 décembre 2017 (48 mois). Cette étude a été menée au sein de l’unité neurochirurgicale du service de Chirurgie Polyvalente du Centre Hospitalier Universitaire (CHU) de Brazzaville, qui compte quatre neurochirurgiens et constitue au plan national, la structure de référence pour la prise en charge des affections neurochirurgicales. Nous avons sélectionné tous les patients chez lesquels le diagnostic de méningiome était évoqué et exclu les cas avec données incomplètes. Ces patients étaient admis en provenance du service des urgences ou de la consultation programmée de neurochirurgie. Le diagnostic de méningiome était retenu à partir des données de la tomodensitométrie (TDM) seule et ou de l’imagerie par résonance magnétique (IRM), avec une lésion d’allure extra-axiale, adjacente à l’os du crâne, avec une prise de contraste diffuse de la tumeur et de la méninge adjacente, pouvant donner l’aspect « en queue de comète ». Les lésions étaient classées en méningiomes supra et sous-tentoriels. Ceux supra-tentoriels étaient également classés en méningiomes de la convexité (proches du sinus sagittal supérieur ou non), et en méningiomes de la base du crâne (étages antérieur et moyen). L’indication de chirurgie était retenue lorsque le score de l’American Society of Anesthesiologists (ASA) [7] était compris entre 1 et 3, avec des conditions d’accès et d’exérèse sans dommage fonctionnel et risque de décès majeurs en per opératoire. Le traitement médical péri-opératoire incluait les corticostéroïdes (1 à 2 mg/kg par jour), la prophylaxie antiépileptique avec le phénobarbital (3mg/kg par jour) ou le valproate de sodium (20 à 30 mg/kg par jour), en cas de méningiome supra-tentoriel ou en cas d’hydrocéphalie (liée à un méningiome sous-tentoriel). Le mannitol à la dose de 0,5 à 1g/kg était utilisé pour ses propriétés osmotiques. L’énoxaparine à la dose de 0,4 ml/jour en injection sous-cutanée était systématique chez les patients alités et 24 heures après la chirurgie. La prescription des inhibiteurs de la pompe à protons était systématique. Les moyens chirurgicaux étaient constitués par la dérivation ventriculo-péritonéale (DVP) et l’abord direct de la lésion pour exérèse. L’indication d’une DVP était discutée en cas d’hydrocéphalie, selon le statut clinique du patient, la topographie du méningiome et la possibilité ou non d’obtenir une résolution de l’hydrocéphalie avec l’exérèse de la lésion seule. Les moyens utilisés pour la chirurgie d’exérèse étaient : la têtière à pointes de Mayfield, le microscope opératoire et la coagulation bipolaire. La qualité de l’exérèse était appréciée en utilisant la classification de Simpson [18]. En cas d’exérèse complète emportant la dure-mère, une plastie de fermeture était réalisée avec la galéa et de la colle biologique. Dans les situations d’exérèse avec craniectomie perdue (os infiltré), une cranioplastie de remplacement était organisée dans un second temps chirurgical, à distance de la première intervention. En cas de suites opératoires simples, le patient était hospitalisé pendant quatre à sept jours, la TDM de contrôle était proposée deux à trois mois après la chirurgie. Les patients perdus de vue au contrôle clinique post-opératoire étaient contactés par téléphone. Les paramètres évalués étaient cliniques, radiologiques, histologiques, thérapeutiques et évolutifs. La collecte des données a été réalisée à partir d’un registre des hospitalisations au sein de l’unité, des dossiers médicaux, et par appel téléphonique. Ces données ont été traitées avec le logiciel Numbers de Macintosh 5.3 2008-2018 Apple Inc. RÉSULTATS Population d’étude Durant la période d’étude, 119 cas de tumeurs crânio-encéphaliques ont été enregistrés, dont 47 méningiomes, soit une fréquence de 39,5%. Trois cas ont été exclus de l’étude pour insuffisance de données. Ainsi, 44 cas de méningiomes (36,9%) ont constitué notre série. Caractéristiques anthropométriques L’âge moyen était de 57,11 ± 15 ans, avec des extrêmes de 26 et 84 ans. Nous avons identifié 12 hommes contre 32 femmes, soit un sex ratio de 0,37. Aspects cliniques La médiane pour le délai d’admission était de 39 mois, avec des extrêmes de 2 et 96 mois. Les antécédents médicaux des patients étaient caractérisés par l’hypertension artérielle seule dans sept cas (16%), le diabète seul dans deux cas (4,5%) et l’association des deux dans cinq cas (11,4%). Le tableau I représente la répartition des patients selon les signes cliniques à l’admission. La médiane pour le score de Glasgow était de 15, avec des extrêmes de 6 et 15. Trois patients avaient un score de Glasgow inférieur ou égal à 8. Le score ASA médian était de 1, avec des extrêmes de 1 et 6. Treize patients (29,5%) avaient un score ASA supérieur ou égal à 4. Données neuroradiologiques La TDM et ou l’IRM ont été réalisées chez tous les patients de la série. La TDM a été réalisée seule dans 26 cas (59,1%), l’IRM seule dans quatre cas (9,1%), ces deux examens dans 14 cas (31,8%). Les figures 1 et 2 montrent deux cas de méningiomes : le premier est un méningiome de la convexité occipitale droite, falco-sinusien, le second est un méningiome à cheval sur les étages moyen et postérieur de la base du crâne à gauche, exerçant un effet de masse sur le tronc encéphalique. Le tableau II représente la répartition des patients selon la topographie des méningiomes. La taille moyenne des méningiomes était de cinq centimètres, avec des extrêmes de 1,2 et 8. Le tableau III représente la répartition des patients selon la taille du méningiome. L’œdème péri-lésionnel était identifié dans 31% des cas (70,4%) : il était de taille inférieure à celle de la tumeur dans sept cas (15,9%), égale à celle de la tumeur dans sept cas (15,9%) et supérieure à la tumeur dans 17 cas (38,6%). Traitement chirurgical Dans notre série, 25 patients (56,8%) ont été opérés. Deux patients (8%) ont été traités par DVP pour hydrocéphalie obstructive, avec un méningiome du foramen ovale. Les 23 autres patients ont subi une chirurgie d’exérèse Simpson I dans sept cas (30,4%), II dans quatre cas (17,4%), III dans cinq cas (21,7%), IV dans quatre cas (17,4%) et V dans un cas (4,3%). Deux patients sont décédés en début d’intervention, par hémorragie, durant la confection du volet osseux. Les cas d’exérèse tumorale complète de type Simpson I concernaient un abord frontal dans trois cas, pariétal dans deux cas, orbitaire et ptérional dans un cas respectivement. Parmi ces patients, un cas a bénéficié d’une cranioplastie à distance. L’hémorragie per opératoire était jugée importante, avec recours à une transfusion sanguine dans six cas, parmi lesquels les deux décès par hémorragie durant la confection du volet osseux. Le diagnostic histologique n’a été identifié que dans sept cas. Il s’agissait tous de méningiomes endothéliomateux. Aspects évolutifs L’évolution post-opératoire a été favorable dans 15 cas (60%), marquée par une amélioration clinique et une qualité d’exérèse satisfaisante. Seul un patient a été vu à deux ans de la chirurgie, sans récidive tumorale à la TDM et à l’IRM avec injection de produit de contraste. Aucun autre patient n’a pu réaliser une TDM au-delà du premier contrôle réalisé au cours du premier semestre post-opératoire. Trois patients (12%) ont eu une évolution post-opératoire initialement stationnaire. Ils avaient été opérés avec une exérèse tumorale de type Simpson IV (deux cas) et V (un cas). À deux ans d’évolution, un patient a été perdu de vue, un autre a développé une infection pulmonaire à distance et son état clinique a été compliqué par une perte progressive de l’autonomie. Deux patients porteurs d’hydrocéphalie obstructive avec un méningiome jugé inaccessible par la chirurgie (foramen ovale) ont eu une évolution marquée par une dégradation progressive de l’état neurologique à deux ans de la chirurgie. L’imagerie avait dans ces cas montré une extension sous-tentorielle et compressive sur le tronc cérébral. Cinq patients (11,3%) ont exprimé un refus de la chirurgie. Ils étaient ensuite perdus de vue. Dix sept patients (38,6%) sont décédés. Parmi ces cas, 13 patients n’ont pas été opérés, et les quatre cas opérés (16%) étaient décédés suite à une hémorragie per opératoire dans deux cas, et à une poussée d’œdème post opératoire malgré la prise en charge en réanimation dans deux cas. DISCUSSION Notre étude a été rétrospective, ce qui constitue une limite dans la qualité du recueil des données. La durée d’étude au prorata du nombre de cas enregistré n’est pas suffisante pour procéder à une étude analytique sur les facteurs de morbi-mortalité et la pertinence des moyens à proposer afin d’obtenir un réel impact sur la mortalité post opératoire. L’insuffisance du diagnostic anatomo-pathologique constitue également une limite considérable, eu égard à la nécessité de classer les patients selon la sévérité histologique et de proposer des modalités thérapeutiques complémentaires à la chirurgie. Néanmoins, la description globale de la série a permis d’identifier les symptômes révélateurs de tumeurs cérébrales en général dans notre contexte, de décrire les conditions de sélection des cas pour la chirurgie, avec un retard diagnostique qui contribue probablement à dégrader l’état général des patients et à expliquer le nombre de cas non opérés qui est de l’ordre de 40%. Épidémiologie La fréquence des méningiomes dans notre série a été estimée à 39,5%. En effet, les méningiomes intracrâniens constituent les tumeurs cérébrales les plus fréquentes à Brazzaville, suivis des gliomes de haut grade, des épendymomes et des métastases [10]. En Côte d’Ivoire, leur fréquence est estimée à 33,43% [14]. À Enugu (Nigeria), cette fréquence est de 23,8% [12] et à Lomé (Togo), elle est de 45,6% [8]. Une augmentation de l’incidence des méningiomes est rapportée ces dix dernières années dans de nombreuses études. Il a été suggéré qu’il pourrait entre autres s’agir de la conséquence du vieillissement de la population combinée à l’amélioration de l’accès aux ressources de santé et aux procédures diagnostiques [2]. En outre, les données de la littérature suggèrent la participation d’un facteur racial, marqué par une fréquence plus importante des méningiomes chez les individus de race noire [20]. L’âge moyen dans notre série était de 57.11 ± 15 ans. Il varie entre 40 et 50 ans dans les séries subsahariennes [12,14,19]. La prédominance féminine des méningiomes a été identifiée par Harvey Cushing il y a un siècle environ. Elle suggère l’implication des facteurs hormonaux et génétiques [2]. Dans notre série, le sex ratio était de 0,37. Diagnostic Le délai médian entre le début des symptômes et l’admission dans notre étude était de 39 mois, avec des extrêmes de 2 et 96 mois. En Côte d’Ivoire [14], le délai moyen pour le diagnostic était de 22 mois ; ce délai était raccourci à 6 mois dans l’étude de Thiam et al. [19] à Dakar au Sénégal. Les méningiomes constituent des tumeurs à croissance majoritairement lente, avec une symptomatologie initiale le plus souvent insidieuse [16]. Au plan clinique, l’hypertension intracrânienne (HTIC) était retrouvée dans 81,8% des cas. Nous avons inclus les cas de céphalées persistantes et inhabituelles, avec ou sans œdème papillaire, comme liés à l’HTIC, lorsqu’ aucune autre raison évidente ne pouvait les expliquer. N’dri Oka et al. [14] en Côte d’Ivoire avaient retrouvé des céphalées isolées dans 68,42% des cas. Les céphalées d’apparition et d’évolution progressive sont communément associées à l’HTIC, reflétant le rythme de croissance lentement progressif des méningiomes [6]. Les méningiomes de la convexité étaient les plus fréquents dans notre série (79,5%), avec la localisation frontale en premier (43,2%). Cette tendance est rapportée dans la littérature, sans tenir compte de la proximité ou non du sinus sagittal supérieur [6,16]. Nos résultats sont similaires à ceux de N’dri Oka et al. [14] en Côte d’Ivoire qui avaient trouvé une fréquence de 47,36%. À Enugu (Nigéria), Mezue et al. [12] avaient identifié les méningiomes de la gouttière olfactive dans 26,5% des cas, suivis par les méningiomes de la convexité dans 23,5% des cas, et ceux para-sagittaux dans 17,7% des cas. Thiam et al. [19] à Dakar (Sénégal), avaient identifié les méningiomes de la convexité en premier, dans 48% des cas. La localisation intraventriculaire n’a pas été trouvée dans notre série. Dans une étude rétrospective sur 80 cas de méningiomes de taille supérieure ou égale à 5 centimètres, Narayan et al. [13] en Louisiane (États-Unis d’Amérique) avaient trouvé une taille moyenne de 56.4 ± 4 mm avec des extrêmes de 50 mm et 84 mm. La résection des volumineux méningiomes est considérée comme un challenge, du fait de leur fréquente hypervascularisation, de l’œdème péritumoral associé à une HTIC, et des rapports étroits avec des structures neurovasculaires dont l’identification n’est pas toujours aisée [4]. En Côte d’Ivoire, N’dri Oka et al. [14] avaient trouvé 66% des patients avec une taille de méningiome comprise entre 3 et 6 cm, et 23,96% avec une taille supérieure à 6 cm. Dans notre série, la taille moyenne était de 5 cm (extrêmes de 1,2 et 8 cm). Dans notre étude, l’œdème péri-lésionnel était observé dans 31 cas (70,4%), avec un rapport à la taille du méningiome dont la distribution était la suivante : inférieur (15,9%), égal (15,9%) et supérieur (38,6%). N’dri Oka et al. [14] avaient trouvé un œdème péri-lésionnel dans 41,05% des cas. L’œdème associé aux méningiomes a une origine vasogénique ; elle est en rapport avec la production d’un facteur de croissance vasculaire endothélial par la tumeur, le tout étant responsable d’un effet de masse et d’une infiltration veineuse facilitée par la congestion vasculaire. Ces éléments seraient suggestifs d’un potentiel de récurrence de certains méningiomes [17]. Traitement chirurgical et évolution Le choix du type de traitement des méningiomes tient compte de facteurs liés aux patients (état général, comorbidités), et aux types de traitement disponibles. Le but de la chirurgie est d’obtenir une exérèse complète [16]. Dans notre série, la médiane pour le score de Glasgow était de 15, mais 29,5% des patients avaient un score ASA défavorable, ce qui justifie qu’ils aient été récusés pour la chirurgie. Les méningiomes de la convexité sont généralement considérés comme plus accessibles à la chirurgie. Cependant, la proximité avec le sinus sagittal supérieur et ou le torcular pose le problème de la chirurgie des méningiomes proches de la ligne médiane. Les principes de la chirurgie des méningiomes de la base reposent sur une craniectomie suffisante pour minimiser les risques de lésions parenchymateuses au cours de l’exérèse, un suivi des plans arachnoïdiens, l’identification et le respect des rapports vasculaires, et la résection la plus complète possible lors de la première intervention [3]. Dans notre série, parmi les sept cas de chirurgie avec exérèse complète Simpson I, cinq correspondaient à une chirurgie de la convexité (frontale et pariétale). Dans la littérature, malgré une exérèse macroscopiquement complète, jusqu’à 20% des méningiomes récidivent dans les 10 ans après la chirurgie ; la récidive à 10 ans pour les méningiomes opérés avec exérèse incomplète est de plus de 80%. Les tumeurs de la base du crâne sont d’exérèse difficile, le plus souvent incomplète, du fait de la proximité avec des structures vasculaires ou nerveuses hautement fonctionnelles [5]. Le recul de deux ans dans notre étude est insuffisant pour apprécier le taux de récidive de ces méningiomes. Par ailleurs, le suivi des patients après chirurgie est difficile dans notre contexte, à cause des conditions socio-financières, qui constituent une limite quant à la réalisation des contrôles radiologiques. Le but de la chirurgie dans les méningiomes para-sagittaux est d’obtenir une exérèse la plus complète possible, sans complications, en préservant au mieux la circulation veineuse cérébrale. En cas de reliquat tumoral de petite taille et d’exérèse difficile, la radiochirurgie stéréotaxique constitue un traitement complémentaire valable, sans pour autant constituer une alternative à la chirurgie d’exérèse réalisée dans des conditions optimales [15]. Dans notre contexte, le but de la chirurgie était de réduire au maximum la taille de la tumeur, et de proposer une prise en charge complémentaire en fonction des données histologiques et du contrôle radiologique. La radiothérapie pour le névraxe n’était pas disponible au Congo durant la période d’étude. L’insuffisance de recul dans notre étude est les difficultés à obtenir un contrôle radiologique n’ont pas permis d’évaluer les indications de radiothérapie après chirurgie. Dans notre série, 17 patients (38,6%) sont décédés, parmi lesquels, quatre dans le groupe des patients opérés (16%). En Côte d’Ivoire [14], cette mortalité était de 12,63%, et au Sénégal [19], elle était de 10,25%. Le pronostic des méningiomes dépend des facteurs comme le grade histologique de la tumeur, la qualité de l’exérèse et les possibilités de traitement complémentaires [1]. CONCLUSION Les méningiomes intracrâniens constituent les tumeurs les plus fréquentes en pratique neurochirurgicale dans notre contexte. L’HTIC est le principal mode de révélation de ces tumeurs. Le diagnostic est facilité par l’accessibilité à la TDM et à l’IRM. La chirurgie demeure la principale procédure thérapeutique, notamment lorsque l’exérèse tumorale est complète. L’évolution dépend du grade histologique et des possibilités de traitement complémentaires à la chirurgie d’exérèse. Dans notre étude, les méningiomes de la convexité avaient le meilleur pronostic à court et moyen termes. La prise en charge optimale des méningiomes de la base du crâne nécessite un perfectionnement de notre pratique chirurgicale pour les lésions de cette zone. La disponibilité des données histologiques et la mise en place des moyens complémentaires comme la radiothérapie peuvent contribuer à améliorer la prise en charge des méningiomes de la base du crâne, en fonction de la qualité de l’exérèse chirurgicale initiale.
Tableau I. caractéristiques cliniques des patients de la série.
*HTIC (Hypertension intracrânienne) : avec œdème papillaire dans 2 cas, avec cécité dans 3 cas. **Déficit neurologique focal : syndrome frontal (6 cas), syndrome opto-chiasmatique (2 cas), paralysie faciale périphérique (2 cas).
Tableau II. Topographie des méningiomes dans notre série.
Tableau III. Répartition des patients selon la taille du méningiome en centimètres (cm).
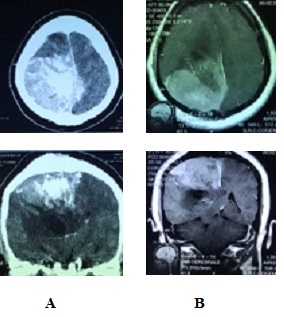 Figure 1: Meningiome falco-sinusien occipital droit.
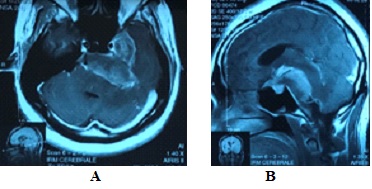 Figure 2: Méningiome de la base, étendu de l’étage moyen à la fosse crânienne postérieure. RÉFÉRENCES
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647