|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ORIGINAL PAPERS / ARTICLES ORIGINAUX
TROUBLES COGNITIFS ET DIABETE DE TYPE 2 AU CONGO
COGNITIVE DISORDERS AND DIABETES MELLITUS TYPE 2 IN CONGO
E-Mail Contact - OSSOU-NGUIET Paul Macaire :
ossoupm@gmail.com
RESUME Introduction: Le diabète de type 2 et les troubles cognitifs, sont deux affections survenant le plus souvent chez le sujet âgé. L’impact du diabète sur la survenue des troubles cognitifs est de plus en plus documenté. Le but de notre étude était d’évaluer les fonctions cognitives chez le diabétique congolais de type 2. Patients et méthodes: Il s’est agi d’une étude cas témoins réalisée de janvier à juin 2015 portant sur 100 patients diabétiques et 100 sujets non diabétiques. Cette étude s’est déroulée à Brazzaville et à Pointe-Noire. Nous avons utilisé préférentiellement le test de Grober et Buschke pour évaluer les fonctions cognitives. Résultats: La fréquence des troubles cognitifs chez les diabétiques était de 57%. L’âge moyen des patients diabétiques présentant les troubles cognitifs était de 58 ans. Le sex ratio des patients diabétiques ayant des troubles cogitifs était de 0,78 (H/F). Les facteurs de risque influençant l’apparition des troubles cognitifs chez les diabétiques dans notre étude étaient: L’âge ≥ 60ans, l’HTA, la durée du diabète supérieure à 5ans, le bas niveau d’instruction, l’Hyper LDL. Seul l’âge ≥ 60 ans et l’HTA étaient des facteurs indépendants de survenue des troubles cognitifs. Nous avons noté une fréquence de 12,3% de maladie d’Alzheimer; 15,7% de MCI; 35,1% d’Amnésie d’évocation dysexécutive; 12,3% d’atteinte de l’encodage dysexécutive, 24,1% de trouble attentionnel et 3,5% de démence sous cortico frontale. Seule l’atteinte de l’encodage était fortement liée au diabète. Les troubles cognitifs n’ont influencé la qualité de vie des patients diabétiques qu’en analyse univariée. Conclusion: Les troubles cognitifs sont retrouvés chez les patients diabétiques. Ils sont fréquents à partir de l’âge de 60 ans. Chez les patients diabétiques traités l’équilibre glycémique n’a pas démontré un effet protecteur. Mots clés : Diabète de type 2, Troubles cognitifs, Test de Grober et Buschke, Congo ABSTRACT Introduction: Diabetes mellitus type 2, and cognitive impairment, is two diseases occurring most often in the elderly. The impact of diabetes, on the onset of cognitive impairment, is increasingly documented. The aim of our study was to assess cognitive functions in Congolese with type 2 diabetes mellitus. Patients and methods: This is a case control study conducted from January to June 2015 involving 100 diabetic patients and 100 non-diabetic subjects. This study took place in Brazzaville and Pointe-Noire. We used preferentially the Grober and Bruschke test to assess cognitive function. Results: The frequency of cognitive disorders in diabetic patients was 57%. The mean age of diabetic patients with cognitive impairment was 56.3 years. The sex ratio of patients with cognitive impairment was 0.6 (M/F). Risk factors influencing the onset of cognitive impairment in diabetes in our study were age ≥ 60 years, hypertension, duration of diabetes more than 5 years, low socio-cultural level, HyperLDL. Age ≥ 60 years and hypertension were independent factors for developing cognitive impairment. We noted a 12.3% frequency of Alzheimer’s disease; 15.7% of MCI; 35.1 dysexecutive evocation amnesia; 12.3% impairment of the dysexécutive encoding, 24.1% of attentional disorder and 3.5% in frontal cortical dementia. Encoding impairment was strongly associated to diabetes. Cognitive disorders have influenced the quality of life of diabetic patients only in univariate analysis. Conclusion: The cognitive disorders were found in diabetic patients. They are common from the age of 60. In diabetic patients blood sugar control has not demonstrated a protective effect. Keywords: Type 2 diabetes, cognitive disorders, Grober and Bruschke Test, Congo INTRODUCTION Le diabète de type 2 (DS 2) est une maladie métabolique caractérisée par une hyperglycémie chronique secondaire à une résistance à l’insuline et/ou à une anomalie de l’insulinosécrétion [3]. C’est une maladie chronique dont l’expansion mondiale lui confère les caractéristiques d’une pandémie [38]. Le DS 2 représente la forme de diabète sucré la plus fréquente avec plus de 85% des cas [38]. En Afrique subsaharienne (ASS), le DS 2 représente un problème majeur de santé publique. On estime une augmentation de sa prévalence de 12,1 millions en 2010 à 23,9 millions d’ici 2030 [46]. Les fonctions cognitives sont des aptitudes et capacités qui permettent les opérations intellectuelles de la pensée et du raisonnement. Elles comprennent : l’orientation, l’attention et la concentration, la mémoire, et l’abstraction [12,19]. Leur altération représente un problème de santé publique. L’influence du diabète sur les fonctions cérébrales est de plus en plus étudiée. La plupart de ces études ont été réalisées dans des populations des sujets âgés, chez lesquels la présence des co-morbidités peut surestimer la prévalence de ces troubles [31,47,55]. Les conséquences du diabète sur les fonctions cérébrales sont représentées par : le déclin cognitif, les démences, les états dépressifs et les accidents vasculaires cérébraux (AVC) [31]. Cependant, la relation entre le diabète et les AVC reste la plus documentée [27,45]. Les troubles cognitifs représentent les complications cérébrales du diabète les moins documentées en Afrique. Au Congo, avec une prévalence entre 4 et 6% [38], le DS 2 a bénéficié de plusieurs études [32-34], nous n’avons pas trouvé une étude ayant abordé la problématique des troubles cognitifs du diabétique de type 2. L’identification de ces troubles cognitifs a cependant, toute son importance en raison non seulement de leur conséquence en termes d’observance thérapeutique, mais aussi de leur impact sur la prise en charge globale et le rendement socioprofessionnel du patient diabétique. Le but de cette étude est d’évaluer les fonctions cognitives chez le diabétique congolais de type 2.
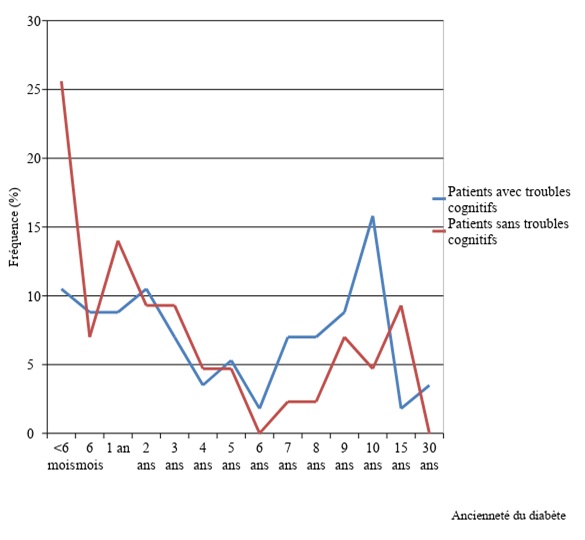
METHODOLOGIE Il s’est agi d’une étude cas-témoins menée du 05 janvier au 30 juin 2015, en consultation externe de diabétologie de l’hôpital Adolphe Sicé de Pointe Noire et du CHU de Brazzaville. Concernant les participants à notre étude, les cas et témoins ont été consentants à participer à l’étude. Ainsi, ces participants ont été classés en deux groupes : les cas, patients diabétiques, âgés d’au moins 40 ans, et les témoins constitués des patients non diabétiques, âgés d’au moins 40 ans. Les témoins ont été choisis parmi les accompagnateurs des patients et le personnel soignant. Tous les patients ayant un antécédent d’accident vasculaire cérébral, ayant présenté un coma au courant des trois derniers mois, présentant un handicap sensoriel sévère ou une dépression, n’ont pas été inclus. Les variables ont été d’ordre épidémiologique, clinique et paraclinique. La dépression a été évaluée par l’échelle gériatrique de dépression ayant 15 items, l’évaluation des fonctions cognitives a été réalisée à partir du test de Grober et Buschke ou RL/RI-16, dans sa version validée par l’étude EPIDEMCA au Congo [21,22]. Les données ont été saisies sur les logiciels Excel 2010 et analysées sur CDC Epi info 7.1.5. Le seuil de significativité choisi pour l’ensemble des analyses statistiques a été de 0,05. Le modèle de régression logistique a permis d’identifier les facteurs associés à la survenue des troubles cognitifs. Seuls les facteurs avec une valeur de p<0,20 ont été retenus pour analyse multivariée. RESULTATS Nous avons inclus 100 cas et 100 témoins. La fréquence globale des troubles cognitifs était de 57% (n=57) chez les patients diabétiques et 34% (n=34) chez les témoins. Les diabétiques étaient âgés entre 40 et 80 ans avec une moyenne 56,30 ± 8,60 ans, les témoins étaient âgés de 40 à 82 ans avec une moyenne 57,70 ± 11,50. L’âge moyen des patients ayant des troubles cognitifs était de 58,50±8,92 chez les diabétiques et 65,32±10,64. Concernant le genre, 55 (55%) femmes et 45 (45%) hommes ont été diabétiques, soit un sex ratio de 0,82 (H/F). Trente-deux (56,1%) diabétiques de sexe féminin et 25 (43,9%) de sexe masculin avaient des troubles cognitifs soit un sex ratio de 0,78 (H/F). Chez les témoins 50 (50%) ont été de sexe féminin et 50 (50%) ont été de sexe masculin ; 22 (64,7%) patients de sexe féminin et 12 (37,3%) avaient des troubles cognitifs. Dans le groupe des patients diabétiques, la durée moyenne d’évolution du diabète était de 5,24±5,83 ans [extrêmes 9 mois et 30 ans]. Les troubles cognitifs étaient en proportion élevés chez les patients diabétiques qui avaient un diabète évoluant entre 6 et 10 ans (Figure 1). Soixante-seize pourcent des patients diabétiques (n=77) étaient déséquilibrés avec un pourcentage moyen d’hémoglobine glyquée (HbA1C) de 8,7±2,2 [Extrêmes 5 – 14%]. Sur l’ensemble des patients diabétiques, 49% avaient un antécédent d’hospitalisation pour le diabète. Le délai moyen entre l’inclusion et la dernière hospitalisation était de 2,55±4,64 [extrêmes : 6mois – 7 ans]. Quarante-cinq patients avaient un antécédent d’au moins un épisode d’acidocétose, dont la durée moyenne entre le dernier épisode et l’inclusion dans l’étude était de 3,09±5,49 [Extrêmes : 4 mois -30 ans]. Dix-huit patients (18%) avaient rapporté au moins un épisode d’hypoglycémie, 2 (2%) patients ne pouvaient préciser si oui ou non, ils avaient déjà présenté une hypoglycémie et 80 patients n’avaient aucun antécédent d’hypoglycémie. Le délai moyen entre le dernier épisode d’hypoglycémie et l’inclusion dans l’étude était de 1,12±1,17 [Extrêmes 4mois – 5 ans]. La répartition selon les différents types de troubles cognitifs est représentée dans le tableau I. On analyse univariée, le diabète est un facteur indépendant de risque de troubles cognitifs avec un OR = 2,57 et un intervalle de confiance à 95% [1,45-4,56], p=0,0012. Le tableau II et III présentent l’analyse univariée de risque des troubles cognitifs, respectivement dans les deux groupes et chez les diabétiques. Concernant les différents types de troubles cognitifs, seuls les troubles des fonctions exécutives étaient associées au diabète, OR : 3,67, IC 95% [1,28-6,98], p=0,002 Après ajustement sur différents facteurs, le diabète demeure un facteur de risque des troubles cognitifs avec un OR ajusté = 3,72, IC 95% [1,77-7,80] et un p=0,0005. Le modèle final, multivarié est représenté dans le tableau IV. DISCUSSION Les études sur l’évaluation des fonctions cognitives en Afrique sub-sahariennes sont rares du fait de la rareté des outils transculturels validés. L’utilisation préférentielle du test de Grober et Buschke au cours de l’évaluation des fonctions cognitives dans notre étude se justifie par le fait que ce test est essentiel dans l’évaluation des différentes composantes de la mémoire, l’attention et les reconnaissances [51], de même, il a bénéficié d’une adaptation validée pour la population congolaise [21,22]. La fréquence des troubles cognitifs chez les patients diabétiques était de 57% avec un OR à 2,57 et un IC95% [1,45-4,56], p=0,0012 par rapport aux patients non diabétiques. Nos résultats sont supérieurs à ceux de Roy et al aux USA qui rapportent une fréquence de 19,5% [44]. Cette différence est essentiellement d’ordre méthodologique, car leur étude a utilisé une population beaucoup plus jeune entre 18 et 60 ans, et l’identification des troubles cognitifs n’a été réalisée qu’avec le MMS, qui est moins sensible que le Grober et Buschke. Cependant nos résultats sont proches de ceux de plusieurs études. Luchsinger et al [28] ont rapporté une fréquence de 42.5% de MCI dans le groupe des diabétiques contre 34,5% chez les non diabétiques. Fontbonne et al [18], en France ont rapporté un OR à 2,3 et un IC95% [1,20-4,30] et Feinkohl et al [17], en Ecosse estiment que la fréquence des troubles cognitifs chez les patients diabétiques varie entre 20 et 50%. L’âge moyen de 56 ans chez les diabétiques et 57 ans chez les témoins dans notre étude est superposable à celui obtenu par plusieurs auteurs. En Chine Zhang et al [61] et Wang et al [53] ont retrouvé un âge moyen respectif 57ans et 60 ans dans les deux groupes ; Xia et al [59] qui ont rapporté un âge moyen de 58 ans chez les diabétiques et 55 ans chez les témoins. Certains travaux réalisés uniquement chez les patients âgés rapportent un âge moyen supérieur au nôtre. C’est le cas d’Umegaki et al [50], Van Harten et al [52] et Manshot et al [30] qui ont rapporté un âge moyen respectifs de 74 ans, 73 ans et 66 ans. La tranche d’âge la plus représentée dans notre étude, est superposable à celle rapportée dans la littérature [3,40,44]. L’âge supérieur à 60 ans a été un facteur de risque indépendant de survenue des troubles cognitifs chez les patients diabétiques, comme l’ont aussi rapporté certains auteurs [39,41]. Cela se justifie par le fait que le vieillissement entraine une altération du système endocrinien à l’origine d’une vulnérabilité au déséquilibre métabolique. Cependant, de façon intéressante notre étude a montré que l’âge inférieur à 60 ans, est un facteur protecteur avec un OR à 0,27; un IC95% [0,15-0,50], p<0,00001, en analyse univariée, et OR à 0,042 ; un IC95% [0,20-0,88], p=0,021, après ajustement sur les autres facteurs en analyse multivariée. Aucune donnée de la littérature disponible ne nous a permis de comparer nos résultats. Cependant, l’existence des troubles cognitifs dans cette tranche d’âge a été rapportée par certains auteurs [37,44]. Les données sur le sexe sont discordantes dans la littérature. Nos résultats sont proches de ceux de Roy et al [44] aux USA, qui ont rapporté des effectifs homme/femme de 44/38, Wang et al [53] en Chine qui ont rapporté des effectifs de 95/93 chez les diabétiques et 128/138 chez les témoins ainsi que Zhou et al [62] toujours en Chine, qui ont rapporté des effectifs 44/44 chez les diabétiques et 56/49 chez les non diabétiques; Certains travaux notent une prédominance féminine [11,15,61] alors que d’autres rapportent une prédominance masculine [17,29]. Dans toutes ces études, le sexe n’est pas significativement associé à la survenue de troubles cognitifs. La prédominance féminine chez les patients avec troubles cognitifs peut être justifiée le fait que notre population d’étude était plus féminine. Le niveau socioculturel secondaire a été le plus représentatif dans notre étude. Ceci s’explique par l’âge de notre population, et du fait qu’il y a quelques décennies, la majorité des congolais accédaient au marché de l’emploie avec un niveau secondaire. Le niveau socioculturel bas, a été identifié comme facteur de risque de survenue des troubles cognitifs. Bruce et al [5] rapportent un OR à 4,2 ; un IC95% [1,90-9,10], ce qui est légèrement supérieur à nos résultats OR à 3,29 et un IC95% [1,79-6,03], p=0,001. Cette observation corrobore certaines données de la littérature [20,51]. Cependant Roy et al [44] et Crosby-Nwaobi et al [9] en Iran notent qu’il n’y a pas de lien entre le niveau socio-culturel et la survenue des troubles cognitifs. En effet le bas niveau socio culturel peut insinuer une mauvaise observance thérapeutique, une méconnaissance des facteurs de risque vasculaires, pouvant être responsable de la survenue d’une altération des fonctions cognitives. Concernant les facteurs de risque vasculaires, l’hypertension artérielle est le plus fréquent dans la population congolaise [25]. Sa fréquence élevée dans les deux groupes, est le reflet de sa prévalence en population général. L’hypertension artérielle est un facteur de risque indépendant de survenue des troubles cognitifs, avec un OR à 6, un IC95% [2,86-12,61], p<0,00001 en comparant les patients diabétiques aux témoins, et un OR à 3,67; IC95%[1,43-9,43], p=0,007, en comparant des patients sans troubles cognitifs à ceux ayant des troubles cognitifs au sein des patients diabétiques. Nos résultats corroborent les données de la littérature [9,41,50,53]. Johnson et al [24] ont rapporté l’association entre l’hypertension artérielle et la survenue des troubles cognitifs, ainsi que la régression du risque sous l’effet des traitements antihypertenseurs. L’influence de l’hypertension chez les patients diabétiques, dans la survenue des troubles cognitifs passe par la majoration de complications micro et macrovasculaire. Certaines études par contre n’ont montré aucune association entre l’hypertension artérielle et la survenue des troubles cognitifs chez les patients diabétiques [5,30]. Peu d’études ont abordé la relation entre les dyslipidémies et les troubles cognitifs chez les patients diabétiques, avec des résultats discordants [17,59]. L’absence d’association retrouvée dans notre étude a été rapportée par certains auteurs [6,44,60]. Plusieurs auteurs ont soulevé l’existence d’une association entre l’hypertriglycéridémie et l’hypercholestérolémie avec les troubles cognitifs [6,16,50]. Xia et al [59] en Chine ont rapporté une association entre le faible taux de cholestérol total, de LDL-CT et les troubles cognitifs. Cette différence est non seulement d’ordre méthodologique en rapport avec l’étude de type cohorte menée par la plupart de ces auteurs mais aussi en rapport avec la grande fréquence de dyslipidémie dans certaines études tel que dans celle de Feinkohl et al [17], où il y avait 92,7% de cas. Nos résultats sur l’obésité vont dans le même sens que ceux de Roberts et al [43] en Ecosse, qui n’ont noté aucun lien entre l’obésité et la survenue des troubles cognitifs. Par contre Whitmer et al [56] ont rapporté l’influence de l’obésité sur les troubles cognitifs. L’action de l’obésité sur la survenue des troubles cognitifs passerait par l’augmentation des cytokines pro-inflammatoires, non seulement au niveau des tissus adipeux, mais aussi au niveau du système nerveux [23,54]. Très peu d’études réalisées sur les troubles cognitifs chez les diabétiques ont abordés le lien avec le tabagisme. Ceux qui l’ont abordé ont rapportés une association entre les habitudes tabagiques et la survenue des troubles cognitifs chez les patients diabétiques [16,28]. Cette différence s’explique par la rareté du tabagique en Afrique mais également parce que l’aveu du tabagisme est difficile. Ni l’hyperglycémie, ni le taux de l’HbA1c >7% n’ont été associés au risque de survenue des troubles cognitifs dans notre étude, comme l’ont aussi rapporté Bruce et al [5], Chen et al [6] et Umegaki et al [50] et Yanagawa et al [60]. Plusieurs études cependant, ont rapporté le lien entre le déséquilibre de l’HbA1c et les troubles cognitifs [30,42], ainsi que le déséquilibre glycémique et la survenue des troubles cognitifs [1]. L’effet de l’hyperglycémie passerait par une augmentation du stress oxydatif, à l’accumulation des produits de glycation avancée dans le cerveau conduisant à une anomalie structurelle et fonctionnelle au niveau du cerveau, ainsi qu’à une insulino-résistance au niveau cérébral [14,23]. L’absence d’association retrouvée dans notre étude se justifie par la durée de l’étude limitée. Nous avons trouvé que la moitié de nos patients atteints de déficience cognitive avaient un diabète évoluant entre 6 et 10 ans. Dans la présente étude l’ancienneté du diabète supérieure à 5ans était un facteur de risque de survenue des troubles cognitifs OR : 2,39 (IC 95% : 1,04-5,49) p=0,04. Pernot et al [41], dans leur revue de la littérature rapportent un lien entre l’ancienneté du diabète et la survenue des troubles cognitifs. Le lien entre la durée du diabète et les troubles cognitifs peut se justifier par le fait que le diabète de type 2 est souvent silencieux et découvert déjà au stade de complications. De même certains auteurs affirment que la durée du diabète est importante dans la pathogenèse de troubles cognitifs chez les sujets diabétiques [15,44]. D’autres auteurs par contre, rapportent l’influence sur les troubles cognitifs pour une durée supérieure à 10 ans [47,49]. Dans notre étude aucune complication classique du diabète n’a influencé la survenue de troubles cognitifs. Nous résultats sont superposables à ceux de Roy et al [44] aux USA qui ont rapporté une absence d’association entre le degré de microalbuminurie et les troubles cognitifs. Concernant la neuropathie, Moreira et al au Brésil [36] ont retrouvé les mêmes résultats, dans leur travail ayant étudié spécifiquement l’association entre l’existence d’une neuropathie diabétique, sa sévérité et la survenue des troubles cognitifs. Gorska-Ciebiada et al [20] ont également rapporté l’absence d’association entre la neuropathie et les troubles cognitifs, alors que la rétinopathie et la néphropathie diabétique étaient associées à la survenue de MCI. Pernot et al [41] dans leur revue ont rapporté une influence de la microalbuminurie sur les fonctions cognitives avec un OR à 1,38; un IC95% [1,2-1,6] ce qui différe de nos résultats. L’influence de la rétinopathie et de la néphropathie a été également rapporté par Ding et al [13] et De Bresser et al [10]. Cela s’explique par le fait que les troubles cognitifs et les autres complications du DS II ont en partie les mêmes mécanismes physiopathologiques par le biais de la microangiopathie. En 2014, une méta-analyse réalisée par Monette et al [35], sur les différentes perturbations pouvant être mises en évidence au cours du bilan neuropsychologique réalisé chez les patients diabétiques, a montré que les troubles cognitifs étaient dominés par des troubles exécutifs, avec au premier plan, des troubles attentionnels, puis des troubles mnésiques et à une moindre mesure une faiblesse de l’efficience globale. D’autres études affirment une augmentation significative du risque de développer tous les types de démence y compris la maladie d’Alzheimer, chez les sujets diabétiques [2], ce qui a été également rapporté par Biessels et al [4], dans leur revue de 14 études longitudinales, où l’incidence des différents troubles cognitifs était plus élevée chez les sujets diabétiques, par rapport aux non diabétiques. Notre étude rapporte des troubles mnésiques, à type d’amnésie d’évocation, d’atteinte de l’encodage, ainsi que des troubles attentionnels, comme l’ont aussi rapporté Pernot et al [41]. Convit et al [8] ainsi que Kodl et al [26], ont rapporté que les troubles des fonctions exécutives, sont les plus fréquemment rapportés, principalement des troubles attentionnels, la flexibilité mentale (expliquant les troubles de l’encodage dans notre étude), l’apprentissage et la mémoire (expliquant l’amnésie d’évocation) et l’habilité motrice qui n’a pas été étudiée dans notre travail. Seule l’atteinte de l’encodage présente une association avec le diabète dans notre étude. Tran et al [48] ont montré que les troubles des fonctions exécutives sont fréquents chez le diabétique, et influencent leur capacité et habilité à recourir aux services de soins. CONCLUSION Nos données préliminaires prouvent que les diabétiques de type 2 sont plus susceptibles de développer des troubles cognitifs par rapport aux non diabétiques. L’équilibre glycémique et la prise en charge précoce du diabète peuvent améliorer la fonction cognitive. Des facteurs de risque tels que l’âge, l’HTA, le bas niveau socio culturel, les épisodes d’hypoglycémie peuvent influencer la survenue des troubles cognitifs chez les diabétiques. La recherche de la plainte mnésique mérite d’être systématique dans le suivi des patients diabétiques. D’autres travaux sont indispensables en particulier des études de cohorte alliant à la fois les outils neuropsychologiques, des marqueurs biologiques et l’imagerie cérébrale afin de mieux comprendre la relation entre le diabète type 2 et les troubles cognitifs.
Le tableau I : Répartition des différents troubles cognitifs dans les deux groupes.
Tableau II. Analyse univariée sur le risque de survenue des troubles cognitifs.
NSC : Niveau socioculturel *NSC bas : analphabète et primaire.
Tableau III : Analyse univariée des différentes variables chez les patients diabétiques.
Le tableau IV : Analyse multivariée des différents facteurs
RÉFÉRENCES
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647