
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ORIGINAL PAPERS / ARTICLES ORIGINAUX
LES POINTES-ONDES CONTINUES DU SOMMEIL: ASPECTS ELECTRO-ENCEPHALOGRAPHIQUES AU SERVICE DE NEUROLOGIE DU CENTRE HOSPITALIER NATIONAL UNIVERSITAIRE DE FANN DE DAKAR
CONTINUOUS SPIKE-WAVES DURING SLOW SLEEP: ELECTROENCEPHALOGRAPHIC ASPECTS IN THE NEUROLOGICAL DEPARTMENT OF FANN NATIONAL UNIVERSITY HOSPITAL OF DAKAR
E-Mail Contact - SECK Lala Bouna :
ndeylala@yahoo.fr
RESUME Introduction Les pointes-ondes continues du sommeil, constituent une entité électroencéphalographique peu fréquente, mais au pronostic neuropsychologique potentiellement péjoratif. Objectif L’objectif de ce travail était de déterminer les aspects électroencéphalographiques chez des patients présentant des pointes-ondes continues du sommeil. Patients Et Methode Nous avons réalisé une étude rétrospective descriptive sur 2 ans à la Clinique Neurologique du Centre Hospitalier National Universitaire de Fann à Dakar, portant sur des dossiers électroencéphalographiques d’enfants présentant des pointes-ondes continues du sommeil. Les données personnelles, les caractéristiques de l’activité électroencéphalographique de veille et de sommeil ont été recueillies. Resultats Soixante-trois dossiers ont été colligés, soit une fréquence de 1,02% de la population globale et de 2,60% de la population d’enfants. Le sex-ratio était de 1,42, l’âge moyen de 6,65 +/- 2,63 ans. Les indications prédominantes étaient les crises généralisées tonico-cloniques et les crises focales motrices. Presque tous (96,97%) les enregistrements de veille comportaient des anomalies paroxystiques, à prédominance hémisphérique gauche le plus souvent et dans les régions péri-sylviennes. Environ 2 enfants sur 3 (63,49%) avaient des altérations des figures physiologiques du sommeil. Les pointes-ondes prédominaient au stade II du sommeil, légèrement dans l’hémisphère gauche, plus fréquemment dans les régions péri-sylviennes. Le schéma de pointes-ondes continues du sommeil antérieures prédominait. L’index de pointes-ondes variait entre 50 et 100%. Conclusion Le diagnostic des pointes-ondes continues du sommeil doit être précoce. La précision des caractéristiques topographiques permet le diagnostic de déficits cognitifs latents, d’où l’intérêt des études de corrélation clinico-électrique. Mots-clés : Afrique – EEG – Pointes-ondes continues – Sommeil
INTRODUCTION Les pointes-ondes continues du sommeil (POCS), sont caractérisées par une forte activation de l’activité épileptique sur l’électroencéphalogramme (EEG) pendant le sommeil lent (27), avec une apparition ou une majoration de pointes-ondes (PO) préexistantes, qui deviennent bilatérales et continues ou subcontinues pendant tout le sommeil lent (35).Ces anomalies surviennent de façon fractionnée à la veille, sous forme de pointes-ondes isolées ou en bouffées (13,27,35). Dans certains syndromes épileptiques, cet aspect EEG est un critère cardinal mais ne constitue qu’une caractéristique de l’entité pathologique (8,25). Dans d’autres pathologies épileptiques, elles peuvent être observées de façon inconstante et transitoire, c’est le cas de l’épilepsie à paroxysme rolandique atypique ou encore d’une épilepsie focale structurelle (7,29). Ainsi, le syndrome de POCS doit être différentié du pattern EEG qui peut se voir dans des tableaux cliniques différents (10). L’objectif de ce travail était de déterminer les différents aspects EEG chez des patients présentant des pointes-ondes continues du sommeil sur leurs enregistrements EEG. PATIENTS ET METHODE L’étude s’est déroulée à la Clinique Neurologique Ibrahima Pierre Ndiaye du Centre Hospitalier National Universitaire de Fann (CHNUF) à Dakar. Il s’agit d’une étude descriptive rétrospective portant sur la période du 1er juin 2017 au 31 mai 2019. Elle a porté sur des dossiers électroencéphalographiques de patients orientés au département d’explorations fonctionnelles neurophysiologiques de la clinique, pour la réalisation d’un examen EEG. Ce travail a été réalisé dans la continuité d’un travail de thèse de doctorat d’état en médecine, dont le recueil de données a été poursuivi. Nous avons revisité tous les enregistrements électroencéphalographiques des enfants (sujets âgés de 3 à 16 ans) durant cette période, et inclus dans notre étude ceux qui ont mis en évidence des pointes-ondes continues du sommeil, en retenant comme critère quantitatif, les pointes-ondes dont l’index montrait une occupation d’au-moins 50% de la période sur le tracé. Nous avons recueilli : les données personnelles des patients, les indications de l’EEG, les données concernant les enregistrements EEG de veille, lorsqu’il était fait (aspects de l’activité de fond pendant la veille et des anomalies surajoutées), ainsi que les enregistrements EEG de sommeil (architecture du sommeil, anomalies surajoutées). Concernant les anomalies surajoutées, nous avons précisé leur type, certains paramètres quantitatifs (index PO pendant le sommeil, stade de prédominance des POCS) ainsi que leurs caractéristiques topographiques (topographie de la diffusion prédominante, schéma de POCS antérieur lorsque quand la diffusion prédominait dans les régions fronto-centrales, fronto-temporales, centro-temporales ou fronto-centro-temporales, schéma de POCS postérieur quand celle-ci concernait les régions temporales postérieures, pariéto-temporales, temporo-occipitales ou temporo-pariéto-occipitales. Les données ont été analysées à l’aide de Microsoft Excel. Les résultats sont présentés en effectif et pourcentage pour les variables qualitatives et quantitatives. Nous avons procédé à une description des résultats. Les données ont été exploitées sous anonymat pour assurer la confidentialité dans la gestion des informations concernant les patients. RESULTATS Sur le plan épidémiologique Six mille cent soixante-huit patients ont effectué un examen EEG entre le 1er juin 2017 et le 31 mai 2019, dont 2424 âgés de 3 à 16 ans. Quatre-vingt-dix-sept tracés électroencéphalographiques comportant des pointes-ondes continues du sommeil ont été colligés durant cette période, correspondant à 63 patients, dont 18 avaient bénéficié d’enregistrements EEG de contrôle durant la même période. Le nombre de sujets souffrant de POCS constituait 1,02% de la population globale ayant bénéficié d’un enregistrement EEG durant notre période d’étude et une fréquence de 2,60% de la population d’enfants. Il s’agissait de 37 garçons et 26 filles, soit un sex-ratio de 1,42. L’âge des patients au moment de leur premier enregistrement variait entre 3 et 14 ans (tableau I), avec une moyenne de 6,65 +/- 2,63 ans. Sur la totalité des enregistrements (incluant les EEG de contrôle), la moyenne d’âge était de 7,39 +/- 1,41 ans. Les classes d’âge prédominantes étaient celles comprises entre 3 et 8 ans avec 81% de la population, le pic se situant à 4-6 ans (34,92%). La médiane était à 6 ans. Sur le plan clinique Les indications de l’EEG étaient réparties comme suit : 33,33% des patients étaient adressés pour crises généralisées tonico-cloniques (CGTC), dont un présentait un retard psychomoteur et un autre des troubles du comportement; 25,39% étaient adressés pour des crises partielles motrices, dont un avait en plus un déficit cognitif global et un autre un retard psychomoteur associé à un caractère alternant des crises; 14,28% étaient adressés pour une épilepsie à pointes centro-temporales (EPCT) confirmée, dont un présentait des troubles de l’apprentissage; 12,70% étaient adressés pour un contrôle de POCS déjà connues, 7,93% pour crise épileptique sans précision sur la nature des crises, dont un avait un déficit cognitif. Pour les 6,36% restants (4 patients) les indications respectives étaient : épilepsie myoclonique, encéphalopathie, retard psychomoteur, il n’y avait pas de diagnostic précis pour le quatrième. Ainsi, chez 8 patients (12,70%), l’indication comportait une atteinte cognitive. Sur le plan electroencéphalographique Trente-trois patients (52,40%) ont bénéficié d’un EEG de veille et tous les 63 d’un EEG de sommeil.
Chez les patients ayant bénéficié d’un EEG de veille, l’activité de fond était normale chez 96,97%. Un patient (3,03%) avait un rythme de fond mal modulé. Des anomalies surajoutées au rythme de fond étaient retrouvées sur 96,97% des tracés (figure 1). Elles étaient à type de pointes diphasiques ou de pointes-ondes, peu actives, survenant de manière paroxystique. Elles prédominaient dans l’hémisphère gauche chez 50% des patients, dans l’hémisphérique droit chez 34,37%, étaient symétriques chez 12,50% et prédominaient sur la ligne médiane chez 3,13%. Leur zone de diffusion prédominait dans la région fronto-centro-temporale chez 37,50% des enfants, dans la région centro-temporale chez 15,15%, dans les régions fronto-centrale et fronto-centro-pariéto-temporale dans 9,37% des cas chacune, puis les régions centro-pariéto-temporale et fronto-temporale dans 6,25% des cas chacune, puis les régions fronto-centro-pariétale, frontale, temporale, centro-pariétale et temporo-pariétale dans 3,16% des cas chacune. Ainsi, la diffusion des anomalies paroxystiques prédominait sur les régions péri-sylviennes (respectivement : centrale, temporale, frontale) (tableau II).
Analyse de l’architecture du sommeil Chez 36,51% des patients, les figures physiologiques du sommeil avaient une présentation normale, tandis que 63,49% avaient des altérations des figures physiologiques du sommeil. En considérant l’ensemble des enregistrements (incluant les 97 enregistrements de contrôles) : les figures physiologiques du sommeil se présentaient normalement dans 45,36% des cas et étaient altérées dans 54,64% des cas. Ces altérations consistaient soit en une absence de figures physiologiques du sommeil (32,99% des cas), soit en une pauvreté de ces figures (20,62% des cas), soit en une asymétrie de celles-ci (1,03% des cas). Chez les 18 patients qui avaient bénéficié d’enregistrements EEG de contrôle, les figures physiologiques du sommeil étaient initialement normales chez 6, dont 2 chez qui elles étaient restées normales sur les EEG de contrôle, 2 chez qui elles avaient disparu, et 2 chez qui elles étaient fluctuantes selon les enregistrements. Ces figures étaient initialement pauvres chez 12 patients, dont 6 chez qui elles s’étaient normalisées par la suite, 5 chez qui elles étaient restées pauvres et 1 chez qui elles avaient tendance à fluctuer. Les pointes-ondes continues du sommeil Sur le plan topographique : les POCS étaient à prédominance hémisphérique gauche chez 49,20% des patients, droite chez 41,27%, tantôt droite tantôt gauche sur un même tracé chez 7,94%, sur la ligne médiane chez 1,59% . La zone de diffusion prédominante des POCS pendant le sommeil était la région fronto-centro-temporale (23,81%) suivie par la région centro-pariéto-temporale (14,30%) puis la région fronto-temporale (12,70%), puis la région fronto-centrale (11,11%), puis la région centro-temporale (9,52%), puis la région frontale (7,94%) puis la région pariéto-temporale (4,76%), puis les régions fronto-centro-pariétale, pariéto-temporo-occipitale et centro-pariétale (3,17% chacune), puis les régions temporale, fronto-pariéto-temporale, fronto-centro-pariéto-temporale, fronto-pariéto-temporo-occipitale (1,59% chacune). Ainsi, la fréquence de l’implication des différents lobes dans la zone de diffusion prédominante était de 74,60% pour les régions temporales, 66,67% pour les régions centrales, 63,50% pour les régions frontales, 33,33% pour les régions pariétales, 4,76% pour la région occipitale (tableau III). La majorité des patients, soit 90,47% des cas présentait un schéma de POCS antérieur, 7,94% un schéma de POCS postérieur, 1,59% une diffusion bipolaire antérieure et postérieure. Sur le plan quantitatif : les POCS prédominaient au stade II du sommeil (figure 2) chez tous les patients. Le sommeil paradoxal a été identifié chez un seul patient, qui présentait des pointes-ondes subcontinues à ce stade, moins actives que pendant le sommeil lent. Sur l’ensemble des tracés EEG de sommeil (incluant les enregistrements de contrôle), l’index PO variait entre 50 et 100%. Il variait entre 90 et 100% chez 57,73% des patients et entre 50 et 80% chez 42,27% des patients. Aspects épidémiologiques Nous avons colligé sur une période de 2 ans, 63 dossiers EEG de patients ayant des POCS, qui constituaient 1,02% du nombre total de patients et 2,60% du nombre d’enfants enregistrés durant la même période. Le sex-ratio, en faveur du genre masculin (1,4) est décrit par la plupart des auteurs (5,6,9,10,15). La moyenne d’âge est de 7,39 ans +/- 1,41, avec une prédominance des classes d’âge comprises entre 3 et 8 ans (81% de la population), le pic se situant à > 4-6 ans (34,92%). Certains auteurs ont trouvé des valeurs similaires, tel que Nieuwenhuis (17), Saltik et al. (10,26). Par contre, Aeby et al. (1) rapportaient un pic de fréquence dans la tranche d’âge de 6 à 10 ans, Gencpinar et al (9), une moyenne d’âge de 10,22 +/- 4,31 ans. Aspects cliniques Les CGTC (33,33%) et les crises partielles motrices (25,39%) étaient les indications les plus fréquentes. La fréquence des patients adressés pour une EPCT confirmée est relativement basse : 14,28%. Il n’est cependant pas exclu que cette valeur soit sous-estimée. En effet, les crises d’épilepsies focales peuvent être diagnostiquées à tort comme des CGTC si le début focal est ignoré. D’autre part, devant une crise partielle motrice, il n’est pas aisé pour un non neurologue de poser le diagnostic d’EPCT. Ainsi, il est possible que parmi les enfants adressés pour CGTC et ceux adressés pour crises partielles motrices, un certain nombre réponde au diagnostic d’EPCT. En effet, la fréquence élevée des EPCT qui se compliquent de POCS est souvent rapportée dans la littérature (5,13,15,26,27,35). A ce sujet, certains facteurs de risque sont incriminés, tels que la survenue de l’EPCT à un âge précoce, inférieur ou égal à 4 ans (9,19) ou les médicaments utilisés dans la prise en charge de l’épilepsie (5,15,26) Aspects électroencéphalographiques Aspects électroencéphalographiques sur l’EEG de veille Nous n’avons pas pu expliquer la fréquence élevée des EEG de veille dont l’activité de fond était normale (96,97%) dans notre série, comparée aux données de différents auteurs : 37% des cas parmi 16 patients pour Giorgis et al. (7), 28,57% des cas parmi 14 patients pour Saltik et al. (26). D’autre part, ces mêmes auteurs ont trouvé sur ces EEG de veille une fréquence des anomalies surajoutées proche de 60% alors qu’elle est proche de 100% dans notre série. Il faut cependant noter que les tailles des échantillons diffèrent. Nous avons retrouvé une topographie classiquement décrite dans la littérature, notamment par Giorgis et al. (7) et Tassinari et al. (30,32), concernant la zone de diffusion prédominante des POCS. Il en est de même de la distribution asymétrique de ces anomalies (7,26,28). La zone de diffusion la plus fréquente impliquant par ordre de fréquence décroissante les régions centrales, temporales et frontales.
Aspects électroencéphalographiques sur l’EEG de sommeil Aspects de l’architecture du sommeil L’architecture du sommeil est généralement difficile à apprécier (21), mais nous avons noté que 63,49% des patients (54,64% des tracés) présentaient des altérations des figures physiologiques du sommeil. Caractéristiques des POCS Sur le plan quantitatif, les POCS prédominaient au stade II du sommeil chez tous les patients et de nombreux auteurs ont trouvé une prédominance des POCS à ce stade (11,21,27). Ceci s’explique par le rôle rapporté des composantes du sommeil lent (ondes delta et fuseaux du sommeil) sur l’activation des POCS (12,14,20,22,37). Par contre, l’inhibition de la synchronisation thalamocorticale durant le sommeil paradoxal aboutit à une réduction de la transmission interhémisphérique empêchant ainsi la généralisation de la décharge épileptique (2, 4,31). D’ailleurs, un patient de notre série avait atteint le sommeil paradoxal lors de l’enregistrement EEG et présentait des pointes-ondes à ce stade, moins actives que pendant le sommeil lent. Sur l’ensemble des tracés EEG de sommeil, incluant les enregistrements de contrôle, l’index PO variait entre 50 et 100%. Il était supérieur à 85% chez 57,73% des patients et compris entre 50 et 85% chez 42,27% des patients. L’évaluation quantitative des POCS a suscité au fil des années de nombreux débats. En effet, la définition initiale des POCS nécessitait un index PO d’au moins 85% (3,16,24,30,32,33). Mais par la suite, de nombreux auteurs ont affirmé à travers leurs études que l’intérêt diagnostique de l’index PO ne baissait pas lorsqu’il était inférieur à 85%, et ont défini des seuils plus bas estimés à 60% pour la plupart (3,12,33,34,36). De plus, la définition initiale a été jugée trop restrictive, car d’une part cet index peut varier d’une nuit à l’autre ; d’autre part, des manifestations cliniques en rapport avec des POCS ont été rapportées même avec un index proche de 50% (13,27,35). Nous avons effectivement noté chez certains patients ayant bénéficié d’enregistrements de contrôle, un aspect fluctuant des POCS selon les tracés. Nous pensons qu’un autre argument à prendre en compte, dans cette évolution fluctuante, est l’effet du traitement médicamenteux. Sur le plan topographique, les POCS étaient à prédominance hémisphérique gauche chez 49,20% des patients, droite chez 41,27%. Cette prédominance gauche a été retrouvée dans les travaux de Saltik et al (26) et Aeby et al. (1), avec des taux de fréquence respectifs de 62,5% et 66,6% des cas. La zone de diffusion des anomalies incluait plus fréquemment les régions temporales (74,60%), centrales (66,67%) et frontales (63,50%), ce qui explique probablement que la majorité des patients, soit 90,47% des cas ait présenté un schéma de POCS antérieur selon les critères définissant les “POCS typiques” (24,30). Ainsi, les régions rolandiques et péri-rolandiques sont les plus concernées. Ceci conforte l’idée que ces patients, en particulier ceux adressés pour CGTC, aient pu avoir une composante focale dans leurs manifestations cliniques, notamment compatible avec une EPCT initiale. Des signes de focalisation à l’EEG ont été décrits avec des corrélations électro-cliniques. En effet, une prédominance frontale des POCS est corrélée à des déficits cognitifs globaux ou spécifiques non linguistiques (3,28,36) et une prédominance temporale à des déficits linguistiques (18,23). Certains patients ont présenté un déficit cognitif associé, mais n’ont pas bénéficié d’un bilan neuropsychologique pouvant permettre de discriminer le profil des troubles. CONCLUSION Les POCS constituent une entité EEG peu fréquente, retrouvée dans différentes affections épileptiques. Leur gravité est liée à leur pronostic fonctionnel neuropsychologique. Le caractère sournois et surtout non spécifique des manifestations cliniques du syndrome de POCS en particulier, peut retarder le diagnostic en l’absence d’enregistrement EEG. Ceci justifie la réalisation systématique d’un EEG de sommeil chez tout enfant présentant une épilepsie focale notamment idiopathique, voire de toute nature, et un suivi EEG rapproché en cas de contexte clinique à risque, pour déceler le plus tôt possible la transformation du foyer en POCS. Leur activation semble prédominer dans l’hémisphère majeur, plus fréquemment dans les régions périsylviennes, impliquant la possibilité de déficits cognitifs linguistiques ou non, délétères pour le développement neurocomportemental de l’enfant. Ainsi, l’identification de certaines caractéristiques, notamment topographiques, peut permettre de diagnostiquer des déficits cognitifs latents non encore décelables. Il serait intéressant d’inclure dans une étude ultérieure, une démarche de corrélation clinico-électrique, incluant une confrontation entre les données cliniques et électroencéphalographiques, mais également la recherche de déficits cognitifs non déclarés, à partir de la distribution topographique des POCS. Tableau I : Répartition des enfants selon l’âge
Tableau II : Prédominance de la diffusion des anomalies paroxystiques à la veille
Tableau III: Prédominance de la diffusion des pointes-ondes continues dans le sommeil
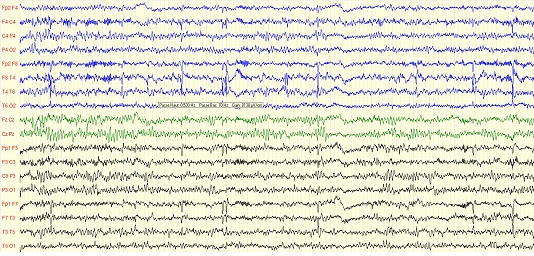 Figure 1: Tracé EEG de veille d’un patient, en montage longitudinal, montrant des pointes-ondes isolées ou en doublets, diffusant essentiellement dans les régions centro-temporales
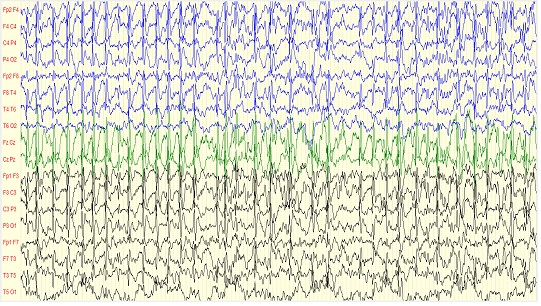 Figure 2: Tracé EEG d’un patient au stade II de sommeil, en montage longitudinal, montrant des pointes-ondes continues généralisées REFERENCES
|
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647