
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The East African Association of Neurological Surgeons invites you to join us in the World Federation of Neurosurgical Societies Skull Base Surgery Committee Cadaveric Dissection Workshop at the Department of Human Anatomy, Chiromo Campus, University of Nairobi, from 17th to 18th February 2012, Nairobi, Kenya. This two day course will consist of lectures and hands-on microdisection of human cadavers. At the end of the course participants will familiarize themselves with the spectrum of skull base approaches. Participants will be mentored by internationally renowned faculty through lectures, hands-on demonstration and participant dissection. This course is aimed at middle level practicing neurosurgeons from Subsaharan Africa who wish to improve their skills. Hands-on dissection will be used with no more than two participants per cadaver (maximum 10 participants): ): Fee USD 1,100 Entire course will be simultaneously televised to the class room for registered observers (maximum 30 participants): Fee USD 160. Lectures on skull base anatomy and clinical utilization of various skull base approaches will be given. Details on hotel reservations and registration can be obtained on www.sarovahotels.com where special rates have been reserved fro the participants. Register on line: Payment
Entitlements Cancellation and refund policy Letter of Invitation Certificate of Attendance Airport Transfers Appointed Tour Agent Liability Disclaimer Program
International Faculty
February 17th 2012 7.00 AM- 7.15 AM: Registration February 18th , 2012 Applications are invited for a one-year Paediatric Neurosurgery Fellowship at BethanyKids of Kijabe Hospital (BKKH). BKKH is a specialized unit dedicated to the medical care of children with surgical disabilities. As a distinct unit within AIC Kijabe Hospital it includes a 65-bed inpatient unit, an outpatient facility, and a network of 14 mobile clinics spanning across Kenya. The hospital treats large numbers of children with tethered spinal cords, encephaloceles, brain tumours and the broad spectrum of paediatric neurosurgical disorders. BKKH is an accredited training site for the Department of Surgery, School of Medicine, University of Nairobi, Kenya. BKKH is offering one-year fellowship at the Kijabe Hospital under the direction of Prof. Leland Albright, an internationally known paediatric neurosurgeon and the senior editor of the textbook, Principles and Practice of Paediatric Neurosurgery. Applicants must have completed an accredited neurosurgery residency and desire subspecialty training in paediatric neurosurgery. BBKH is a Christian organization and holders of the fellowship should be practicing Christians. Key responsibilities: Required qualifications:
The tentative start date is September 3rd 2012. Applications including cover letter and a CV with names and contacts of 3 referees should be submitted to the following address before 30th April 2012: The Administrator RESUME Description Objectif Méthodologie Résultat Conclusion Mots clés : polyradiculoneuropathies inflammatoires démyélinisantes chroniques, diabète SUMMARY Background Objective Methodology Results Conclusion Key words: Chronic Inflammatory Demyelinating Polyradiculoneuropathy, diabetes INTRODUCTION De description récente, datant d’une trentaine d’année (4), les polyradiculoneuropathies inflammatoires démyélinisantes chroniques (PIDC) constituent un ensemble clinique hétérogène, d’origine auto-immune (2,5,17). Plusieurs maladies leurs sont associées notamment les collagénoses, les hémopathies malignes, les cancers, la gammapathie monoclonale, le diabète et certaines infections comme les hépatites et le VIH (1). A l’exception des gammapathies monoclonales, les relations de causes à effet entre les PIDC et les maladies associées ne sont pas clairement déterminées (5,13,14). Si plusieurs études ont été menées sur les PIDC chez le diabétique (7,11,12), peu d’études en revanche se sont penchées sur la comparaison des PIDC entre patients diabétiques et non diabétiques. Parfois, les neuropathies démyélinisantes sont significativement plus fréquentes chez les diabétiques que chez les non diabétiques et peuvent survenir chez un diabétique bien équilibré (12). L’objectif de cette étude est de comparer les aspects cliniques et électromyographiques des PIDC entre les diabétiques et les non diabétiques. METHODE L’étude s’est déroulée au Centre Hospitalier et Universitaire (CHU) de Limoges en France dans l’unité d’exploration fonctionnelle neurologique du service de neurologie (Service du Pr JM VALLAT). Il s’agissait d’une étude rétrospective à visée descriptive. Elle a concerné tous les patients admis du 1er Janvier 2006 au 30 Juin 2008 chez qui le diagnostic de PIDC avait été porté sur les critères électromyographiques INCAT et/ou de latence distale supérieure à 9ms. Les sujets présentant une cause évidente de polyneuropathie, même s’ils étaient diabétiques étaient exclus. Les dossiers des patients admis dans le laboratoire étaient exploités. A partir du registre informatisé du laboratoire, nous avons sélectionné les patients présentant une polyneuropathie qu’ils soient diabétique ou non. Ensuite, nous avons sélectionné les EMG de ces patients et en appliquant les critères électromyographiques INCAT et de latence distale supérieure à 9ms, nous avons retenu ceux qui présentaient une PIDC. Enfin à partir du dossier médical informatisé mis en place par le service informatique du CHU, nous avons eu accès au dossier médical des patients sélectionnés. Chaque fois que des précisions étaient nécessaires, les dossiers médicaux papiers étaient exploités pour compléter ces informations. Les informations recueillies et exploitées concernaient : Les variables étaient sociodémographiques, cliniques, biologique, et électromyographiques. Nous avons classé les patients en deux groupes : Pour l’analyse descriptive, les données étaient présentées en pourcentage avec un intervalle de confiance (IC) à 95% pour les variables qualitatives, en moyennes et écart-type pour les variables quantitatives. Les tests statistiques usuels étaient utilisés avec pour l’analyse univariée : test de chi-2 pour les variables qualitatives et celui de Student pour les variables quantitatives. Pour ces tests, un p<0,05 était considéré comme statistiquement significatif. RESULTAT Pendant la période d’étude, 403 patients ont été explorés dans le laboratoire d’EFN. 47 répondaient aux critères d’inclusion. La fréquence des PIDC idiopathiques était de 11,7%. Parmi eux, 21 (44,7%) patients étaient diabétique et 26 (55,3%) étaient non diabétiques (p=0,06). Les non diabétiques étaient âgés de 62,4 ans ±13,1 ans. Il y avait une prédominance masculine (80,8%). Le déficit moteur était présent chez 51,1% et 30,8% ont alléguées l’existence d’une symptomatologie douloureuse. Les diabétiques étaient âgés de 57,1ans ± 14,4ans. Il y avait également une prédominance masculine (81%). 48,9% d’entre eux présentaient un déficit moteur et 71,4% avaient des troubles sensitifs objectifs et alléguaient l’existence des symptômes douloureux. La comparaison sur le plan clinique permet de constater qu’il n’y avait pas de différence entre les deux populations pour ce qui concerne l’âge, le sexe, l’existence de déficit moteur, de troubles sensitifs objectifs (p>0,05). En revanche, les diabétiques présentaient plus de douleurs que les non diabétiques (p=0,006). Ces caractéristiques cliniques sont résumées dans le tableau I. Sur le plan électrophysiologique, il existe plus de blocs de conduction chez les non diabétiques (88,5%) que chez les diabétiques (47,6 %) avec une différence statistiquement significative (p=0,002). Par contre, les diabétiques semblent avoir plus de dispersion temporelle (60%) que les non diabétiques (46,2%) sans que la différence ne soit statistiquement significative (p=0,3). Au niveau du nerf médian, les diabétiques présentaient moins d’allongement de latence distale (27,8%) que les non diabétiques (47,4%) p=0,01. Il en de même pour la latence de l’onde F p=0,002. Par contre, la réduction de vitesse de conduction est plus fréquente chez les diabétiques (57,9%) que les non diabétiques (47,4%) p=0,02. Sur le nerf cubital, on rencontre plus fréquemment une vitesse de conduction réduite chez les non diabétiques (56,5%) p=0,001, il en est de même pour la latence de l’onde F, p=0,001. Sur le péronier profond (SPE) et le tibial postérieur (SPI), les seules différences observées entre les deux groupes concernent respectivement l’onde F (plus fréquemment allongée chez le sujet non diabétique 50%) et la réduction de vitesse motrice (plus fréquente chez le diabétique 41,2%). Sur le plan sensitif, aucune différence n’existe entre les deux groupes. Le tableau II résume ces caractéristiques. En faisant une étude comparative des moyennes, on observe que les sujets non diabétiques ont une onde F plus allongée sur le médian (41,2ms), le cubital (40.6ms) et le SPE (65,8ms) que chez les diabétiques. De plus, la réduction de la vitesse de conduction motrice est plus importante chez le non diabétique sur le nerf cubital (34,3m/sec). Par ailleurs aucune différence n’est observée au niveau de la latence distale motrice. Sur le plan sensitif, les diabétiques ont une vitesse de conduction sensitive plus réduite au niveau du nerf médian (34,9m/sec) et sural (35,7m/sec) que les non diabétiques. DISCUSSION Parmi les 403 dossiers exploités pendant la période de l’étude, seulement 47 ont été retenus. Ce faible taux s’explique par les critères d’inclusion. En effet, nous avons considéré dans cette étude que les patients ayant un PIDC idiopathique. Ainsi, partant des critères électrophysiologiques INCAT et latence distale supérieure à 9ms, les patients sont sélectionnés. Mais tout sujet présentant d’autres facteurs (insuffisance rénale, activité anti MAG, infection à VIH, lymphome, cancer…) pouvant être associés à la polyneuropathie démyélinisante est écarté. En comparant la population des PIDC chez les diabétiques aux non diabétiques, on observe une certaine homogénéité des deux populations. L’âge des non diabétiques (62,4 ans) apparaît plus élevé que chez les diabétiques (57,1 ans). Mais il n’y a pas de différence statistiquement significative. De même, au sein des deux populations, on observe une prédominance masculine (6,9,10). Cette homogénéité des deux populations nous permet de postuler qu’elles peuvent être regroupées en une seule et même classe et les comparaisons entre les deux groupes peuvent se faire aisément. Toutefois la petite taille de l’échantillon introduisant un manque de puissance ne nous autorise guère à des conclusions fiables. En effet Jann S. et al (6) retrouvèrent un âge moyen de 58,8 ans avec une prédominance masculine dans une étude portant sur 16 patients diabétiques diagnostiqués PIDC. Kherma R et al (9) dans une étude rétrospective portant sur 120 sujets diabétiques remplissant les critères de l’Américan Academy of Neurology (AAN) notaient un âge moyen de 57 ans avec aussi une nette prédominance masculine. Nos résultats s’écartent de ceux de Gorson K. et al (5) qui dans une étude portant sur les cas de PDIC diagnostiqués dans un laboratoire d’exploitations neurophysiologiques retrouvaient un âge moyen de 67 ans chez les diabétiques et 49 ans chez les non diabétiques avec une différence significative (p=0,0002). Sur le plan clinique, la plupart des patients avait des troubles sensitifs qui semblent être plus faible chez les diabétiques (71,4%) que les non diabétiques (80,8%) sans qu’il n’y ait de différence entre les deux groupes. De plus, il existe autant de déficit moteur chez les diabétiques (48,9%) que chez les non diabétiques (51,1%). Ces données sont superposables aux données de la littérature (6). Néanmoins ces taux sont faibles comparés à ceux retrouvés par la plupart des auteurs. Dans notre étude qui est rétrospective l’existence ou non d’un déficit moteur est basée sur les données présentes dans le dossier du patient. Or ces dossiers n’étaient pas tenus dans cette perspective et même lorsqu’un déficit moteur ou sensitif était noté, aucune information sur le degré d’atteinte n’était mentionnée. La plupart des études rétrospectives se heurtent à ces écueils. De plus, dans la plupart des séries, la présence d’un déficit moteur fait partir des critères diagnostiques des PIDC. La seule différence observée cliniquement entre les deux groupes concerne la symptomatologie douloureuse alléguée par les patients. En effet, les PIDC sont plus douloureux chez les diabétiques (71,4%) que chez les sujets sans diabète (30,8%). Une explication plausible est la superposition d’une PIDC sur une neuropathie diabétique préexistante (5), sachant que les neuropathies diabétiques, plus souvent axonales, sont douloureuses. Ces résultats restent discutables dans la littérature. Ainsi, David A (3) et al retrouvent les mêmes résultats que nous dans une étude rétrospective où 12 de leurs patients diabétiques sur 15 se plaignent de douleurs. A contrario, dans la série de Sharma R (12), seulement 12 sur 26 avaient allégué une symptomatologie douloureuse. Sur le plan électrophysiologique, une dispersion temporelle du potentiel était présente chez 46,2% des patients non diabétiques et 60% des diabétiques sans qu’il y ait de différence statistiquement significative entre les deux groupes. En revanche, les patients non diabétiques présentent plus de bloc de conduction motrice (88,5%) que les patients diabétiques (47,6%). Ces anomalies qui sont assez spécifiques des neuropathies démyélinisantes sont plus fréquentes chez nos patients comparés aux 120 sujets de l’étude de Sharma K. et al (12). En effet ces auteurs retrouvèrent respectivement chez 48,3% et 40% de leurs patients une dispersion temporelle et un bloc de conduction. Stewart JD et al (15) avaient observé un bloc de conduction chez 4 patients diabétiques sur les 7 patients diabétiques non insulinodépendant remplissant les critères de l’Ad Hoc Subcommitee of the American Academy of Neurology AIDS Task force. Toutefois la dispersion temporelle du potentiel moteur chez les diabétiques avec PDIC serait moins importante que chez les PDIC non-diabétiques (16). Outre ces paramètres de démyélinisation, les sujets PIDC ont significativement un ralentissement de la vitesse de conduction motrice et un allongement de la latence distale motrice et de la latence de l’onde F. Au niveau du nerf médian, les diabétiques présentent moins d’allongement de latence distale (27,8%) que les non diabétiques (47,4%). Il en de même pour la latence de l’onde F. Par contre, la réduction de vitesse de conduction est plus fréquente chez les diabétiques (57,9%) que les non diabétiques (47,4%). Ce résultat parait surprenant car il existe classiquement chez le diabétique une fréquence importante de canal carpien (5,8,11). Sur le nerf cubital, on rencontre plus fréquemment une vitesse de conduction réduite chez les non diabétiques (56,5%), pareil pour la latente de l’onde F. sur le SPE et le SPI, les seules différences observées entre les deux groupes concernent respectivement l’onde F (plus fréquemment allongée chez le sujet non diabétique 50%) et la réduction de vitesse motrice (plus fréquente chez le diabétique 41,2%). En sensitif, aucune différence n’existe entre les deux groupes. Nos sujets non diabétiques ont une onde F plus allongée sur le médian (41,2ms), le cubital (40,6ms) et le SPE (65,8ms) que chez nos diabétiques. De plus, la réduction de la vitesse de conduction motrice est plus importante chez le non diabétiques sur le nerf cubital (34,3m/sec). Par ailleurs aucune différence n’est observée au niveau de la latence distale motrice. Il est important de signaler l’amplitude de la plupart des potentiels était altérée mais non de façon importante. Rizwan U et al (11) dans une étude portant sur 19 patients remplissant les critères électrophysiologiques de PDIC dont 9 patients diabétiques observèrent une réduction significative de l’amplitude motrice sur les nerfs médians et tibial postérieur dans le groupe des patients diabétiques. Dans une étude similaire Kenneth C et al (8) retrouvèrent quant à eux chez les patients diabétiques une baisse significative de l’amplitude motrice sur les nerfs ulnaire et le péroné profond ; ils notèrent aussi une latence distale motrice significative moins allongée sur le nerf tibial postérieur. CONCLUSION Les neuropathies chez les diabétiquesne sont pas dépendantes de la longueur de leur évolution, douloureuses et axonales. Il faut évoquer cediagnostic devant l’installation des signes neurogènes périphériques chez undiabétique et réaliser un électromyogramme afin de confirmer le diagnostic. Tableau I : comparaison des aspects cliniques des PIDC entre diabétiques et non diabétiques
Tableau II : Comparaison en termes de fréquence des paramètres de démyélinisation observés sur chaque nerf au sein des deux groupes.
ND : non diabétique, D : diabétique Tableau III: Comparaison des caractéristiques électrophysiologiques en termes de moyennes.
RESUME Objectif Patients et Méthode Résultats Conclusion Mots clés : Hématome sous-dural chronique, traitement chirurgical, Gabon. ABSTRACT Objective Patients and Method Results Conclusion Key words: Chronic subdural hematoma, surgical treatment, Gabon. INTRODUCTION L’hématome sous-dural chronique (HSDC) de la convexité est une collection sanguine enkystée, occupant l’espace virtuel sous-dural entre l’arachnoïde cérébrale en dedans et la face interne de la dure-mère en dehors (2). Cet hématome se constitue sur plusieurs semaines, voire des mois, à la suite d’un traumatisme crânien généralement bénin, passé parfois inaperçu (2,3,8). Complication tardive post-traumatique fréquente, l’HSDC a déjà fait l’objet de nombreux travaux en Afrique subsaharienne, notamment à Dakar (12,16) et à Yaoundé (5). La tomodensitométrie (TDM) ou scanner cérébrale est l’examen indispensable au diagnostic (2,7). Le traitement de cette affection est avant tout neurochirurgical (1, 2, 3,4, 5,8,12,16,17). Le but de ce travail est de : METHODOLOGIE Cette étude rétrospective a été réalisée dans le service de Neurochirurgie de la Fondation Jeanne EBORI (FJE), à Libreville (Gabon), sur une période de 10 ans (Juin 1998 à avril 2008). La majorité des patients provenait de différents hôpitaux de Libreville, les autres de l’intérieur du pays et de la sous-région (Congo, Cameroun, Sao- Tome et Principe). Lorsque la présentation clinique évoquait un HSDC ou posait des problèmes de diagnostic différentiel, un examen morphologique était, bien entendu, effectué. Tous les patients ont bénéficié d’un bilan préopératoire comportant notamment : numération de la formule sanguine (NFS), glycémie, bilan de coagulation et bilan phosphocalcique, ionogramme sanguin, fonctions hépatique et rénale, sérologie rétrovirale au VIH, R-X poumons, ECG. L’intervention chirurgicale fut pratiquée en urgence ou programmée, selon le mode de présentation clinique et/ou les résultats du bilan paraclinique. Seuls les patients possédant un dossier médical complet et ayant bénéficié d’un suivi (clinique et tomodensitométrique) pendant au moins 3 mois après la chirurgie ont été retenus dans cette étude. RESULTATS Aspects généraux 102 des 160 cas d’hématomes sous-duraux chroniques (HSDC) observés remplissaient les critères d’inclusion précités. L’âge moyen de ces patients était de 58 ans, avec des extrêmes allant de 3 à 84 ans. La tranche la plus représentée allait de 60 à 65 ans (80%). 80,3% (82/102) provenaient des hôpitaux de Libreville, 14,7% (15/102) de l’intérieur du pays et 5% (05/102) de la sous-région. La prédominance masculine était nette : 82 hommes pour 20 femmes, soit un sexe ratio de 4/1. 46% des patients étaient des sujets retraités. La notion de traumatisme crânien mineur a été observée chez 65 patients (63,7%). 20 autres malades présentaient des antécédents de chutes-10 cas, traumatismes crâniens sévères par accidents de la voie publique (AVP)-4, agressions-4 et rixes-2. Une consommation d’alcool a été notée dans 66 cas (64,7%). Aucune notion de traumatisme crânien n’a été signalée chez 17 malades (16,6%). Présentation clinique La durée d’évolution de la symptomatologie avant l’hospitalisation a varié de 4 à 24 semaines (moyenne : 13 semaines). Les tableaux I et II résument respectivement la Examens complémentaires Deux (2) patients étaient diabétiques ; trois (3) séropositifs au VIH (2%). Il n’a pas été retrouvé de trouble de la coagulation. 98 malades avaient bénéficié d’un examen morphologique avant l’intervention chirurgicale, chronologiquement : angiographie cérébrale-19 (19,3%), TDM-76 (77,5%) et IRM-3 (3%). L’hématome sous-dural chronique était unilatéral 80 fois, bilatéral 22 fois. Il apparaissait hypodense-43 (56,6%), hétérogène (mixte)-17 (22,3%) ou isodense-16 (21%) (Fig. 1). Il existait souvent un effet de masse- 80 et parfois un cloisonnement de l’hématome- 8. Traitement Les indications opératoires sont résumées dans le tableau IV. Trente huit patients (37%) ont bénéficié d’une intervention neurochirurgicale en urgence ; les 64 (63%) restants ont été opérés surtout dans les 24 heures et exceptionnellement dans les 48 heures, selon leur état général. Les techniques opératoires ont varié dans le temps selon la forme anatomo-clinique et notre expérience. Elles ont consisté en la pratique essentiellement de deux trous de trépan-88 (86%) ou parfois d’une craniotomie standard (volet ostéoplastique)-14 (13,7%) pour ablation des fausses membranes épaisses et/ou de cloisonnements de l’HSDC objectivés par TDM, ou pour certaines récidives, suivis, dans tous les cas, d’un rinçage de l’espace sous-dural et d’un drainage non aspiratif. Ce dernier fut réalisé au moyen de deux segments de sonde urinaire souples sortis par une contre-incision, leurs extrémités distales enfouies dans un pansement non compressif, la tête du patient étant placée en position légèrement déclive pendant 48 heures. L’antibiothérapie prophylactique a été instituée, associée à une réhydratation utilisant le sérum physiologique salé ou le lactate Ringer pendant trois à cinq jours, selon l’évolution clinique, afin de favoriser l’expansion cérébrale postopératoire. Un traitement anti-comitial a été prescrit suivant le terrain. Les patients, diabétiques, hypertendus et séropositifs au VIH, ont été pris en charge par les services compétents. Evolution Il n’a pas été observé de complications durant l’opération. Les patients présentant des troubles de la conscience avant l’intervention chirurgicale, furent gardés en réanimation pour surveillance jusqu’à l’amélioration de l’état neurologique. Ils furent ensuite transférés dans le service de Neurochirurgie où ils bénéficièrent également de la rééducation fonctionnelle. Le suivi postopératoire moyen a été de 24 semaines, avec des extrêmes allant de 12 et 96 semaines. Des complications postopératoires immédiates dans les 14 premiers jours suivant l’intervention ont été observées : méningites-4, pneumopathies-10 et empyèmes sous- duraux-2. Une récidive d’hématome sous-dural-4 (aggravation de l’état neurologique et TDM avec / sans injection positive) a nécessité une ré-intervention. L’HSDC était sous pression dans tous les 4 cas. Nous avons déploré 6 décès (6%), consécutifs à l’aggravation postopératoire d’un syndrome de l’uncus- 4 cas et la survenue, chez deux patients séropositifs, d’une pneumopathie pour l’un et d’un choc septique pour l’autre, tous résistants à l’antibiothérapie. 11 des 96 patients guéris (11,4%) ont gardé des séquelles intellectuelles- 5 ou motrices-6 à court et moyen terme. Aucun patient n’a présenté de crise convulsive. DISCUSSION L’ HSDC revêt souvent le caractère d’une urgence chirurgicale. Notre discussion portera sur cinq points qui nous paraissent essentiels : Epidémiologie La fréquence de l’HSDC est certainement sous-estimée en Afrique subsaharienne (5,12,16). Les causes sont multifactorielles : pauvreté, recours à la médecine traditionnelle en première intention, sous-médicalisation, absence d’assurance maladie, éloignement des patients des grands centres urbains. Cette affection s’observe à tout âge, mais concerne surtout les patients âgés de plus de 65 ans (2,8,12,17). Selon Guénot (8), on compte dans la population générale 13,1 HSDC pour 100.000 habitants et par an. Cette proportion augmente après 65 ans, passant de 3,4/ 100.000 chez les patients âgés de moins de 65 ans à 58,1/ 100.000 après 65 ans (2,8). De 1998 à 2008, nous avons opéré 160 patients porteurs d’un HSDC, soit une moyenne de 16 patients/ an, ce qui corrobore les résultats de Maïga, Sakho, Bâ et al. (12). L’âge moyen dans notre étude est de 58 ans avec des extrêmes de 3-84 ans, la tranche la plus représentée allant de 60 à 65 ans (80%); le sexe ratio est de 4/1 ; ce qui est proche de la majorité d’études africaines (5,12,16) et occidentales (2,3,8,17). La prédominance masculine est classique. . Etiopathogénie Dans cette étude, l’alcoolisme a constitué le principal facteur précipitant les traumatismes crâniens mineurs (64,7%) et même la survenue des HSDC ; il est impliqué dans 20 à 30% des cas dans l’étude de Guenot (8). En effet, la consommation d’alcool à long terme est à l’origine des tableaux cliniques neuropsychiatriques assez bien connus, ainsi que des lésions neuro-anatomiques et de nombreuses perturbations neurochimiques et moléculaires. L’hépatopathie alcoolique est un facteur majeur de risque d’hémorragie intracrânienne et elle aggrave le pronostic (3). Dans 16,16 % des cas, les causes de la maladie n’ont pas été clairement identifiées. En l’absence de notion traumatique, l’initiation du cercle vicieux menant à la constitution de l’hématome reste obscure, la rupture d’une amarre veineuse cortico-durale semble l’hypothèse la plus probable (2,3). Trois phénomènes concomitants seraient à l’origine de l’accroissement en volume de l’hématome au fil du temps : extravasation plasmatique, hémorragies répétées, hyperactivité fibrinolytique du sang dégradé (2). L’activation simultanée excessive des facteurs intrinsèques de la coagulation et de la fibrinolyse contribue à entretenir les microhémorragies, car elle aboutit à une consommation excessive des protéines de la coagulation, à la dégradation rapide de la fibrine et du caillot (2,6,10). Par ailleurs, il a été mis en évidence au niveau de la membrane externe la présence d’activateurs extrinsèques de la fibrinolyse. L’activation locale du système kallicréine-kinine en serait l’origine (6,10). La prise continue d’antiagrégants plaquettaires ou d’anticoagulants favorisent aussi l’apparition et le développement d’un hématome sous-dural chronique après un traumatisme crânien bénin (2). Aucun de nos patients n’avait été mis auparavant sous traitement antiagrégants plaquettaires de façon continue, ni sous anticoagulants. La présence d’une déshydratation, (24,5% de cas dans notre étude), facilite le collapsus cérébral et entretient la cavité liquidienne dans l’espace sous-dural (2,8). Cette déshydratation peut être le résultat d’un défaut d’apport liquidien quotidien et marque la dysrégulation de la fixation de l’eau du cerveau, surtout chez les patients dont l’âge dépasse 65 ans (2). Plus rarement, le traumatisme initial est beaucoup plus important avec un authentique hématome sous-dural aigu qui se transformera en un HSDC au-delà du 20ème jour post traumatique (3) ; tel est certainement le cas chez 20 de nos patients victimes d’un traumatisme crânien sévère (19,6 %). Présentation clinique Le début des signes cliniques est souvent insidieux et progressif, à l’instar de tout processus pseudo-tumoral intracrânien évolutif (2,18). Dans notre étude, la durée moyenne d’évolution de la symptomatologie avant l’hospitalisation est de 13 semaines. En cas d’antécédent de traumatisme crânien, la présence des signes suivants évoque un HSDC : Ces trois ordres de signes cliniques peuvent être intriqués ou restés isolés. On doit aussi évoquer le diagnostic chez un patient âgé de plus de 60 ans présentant des troubles de la vigilance, un état confusionnel aigu, une crise convulsive, des chutes à répétition (2,5,8,12,17). La séméiologie est d’autant plus bruyante et prompte à apparaître que le patient est jeune, ce qui s’explique par l’atrophie cérébrale liée à l’âge, qui aboutit chez le sujet âgé à la constitution d’hématomes sous-duraux chroniques volumineux ou bilatéraux longtemps bien tolérés (2,8). Cependant, le diagnostic de l’HSDC est difficile en l’absence de TDM, du fait de son polymorphisme clinique, surtout chez le sujet âgé, éthylique ou sous anticoagulants (1,2,3). D’autres formes cliniques peuvent être rencontrées (2,7,8) : Le nourrisson peut subir des traumatismes crâniens mineurs dont les conséquences ne sont pas immédiates. Le traumatisme crânien de l’enfant secoué en est un exemple. Avant le 6ème mois, le tableau clinique est celui d’une hypertension intracrânienne évolutive avec retard psychomoteur (3). Après le 6ème mois, les signes de l’hypertension intracrânienne (HIC) sont moins évidents ; l’apparition d’un déficit moteur est alors souvent révélateur (2,17). Ce tableau clinique de l’enfant maltraité, rare en Occident, est encore observé dans certains milieux africains. Dans notre étude, le syndrome d’HIC est constant et souvent décompensé avec troubles de la vigilance (66,6%), voire un syndrome de l’uncus (8%). 58 patients (57%) présentent un déficit hémicorporel, 30 (29,%) des crises convulsives. La majorité des patients fut transférée tardivement dans notre service. Imagerie La TDM, disponible au Gabon depuis janvier 1998, est l’examen idéal pour le diagnostic de l’HSDC ; réalisée sans injection de produit de contraste en première intention, sa sensibilité est de plus 90% (7). Classiquement, l’HSDC est décrit comme revêtant la forme d’une collection péricérébrale convexe en dehors et concave en dedans (en croissant de lune), écrasant plus ou moins les gyri en regard et exerçant un effet de masse (syndrome de masse) plus ou moins important. Ce décollement intéresse une large étendue de la convexité cérébrale supratentorielle, sinon sa totalité (2,7). Il n’est pas toujours uniforme, comme s’il existait des zones d’accolement entre cortex et dure-mère. Au plan morphologique, plusieurs formes peuvent être distinguées, notamment en termes de densité de la collection : Le diagnostic différentiel se pose particulièrement avec l’HSDC isodense bilatéral qui demeure un piège, à moins de pratiquer une IRM (7). Cependant, certains indices scano-graphiques peuvent être utiles : injection d’iode, afin de visualiser la membrane, réalisation des coupes coronales, aspect fin et pointu des cornes ventriculaires frontales (2,7). Aussi, distinguer entre HSDC hypodense et hydrome compressif est une situation parfois délicate. L’hydrome a normalement une densité moindre que celle de l’HSDC et prédomine habituellement dans les régions frontales (7). L’empyème sous-dural sera suspecté sur les données cliniques (11), alors que l’injection de produit de contraste permet parfois de conforter le diagnostic en cas de rehaussement intense des membranes et de réaction arachnoïdienne (7). Ainsi, la TDM est devenue l’outil-diagnostic essentiel, permettant très souvent, à elle seule, de poser le diagnostic d’HSDC, d’évaluer son ancienneté, d’élaborer la stratégie thérapeutique et d’en assurer le suivi (2,7,16): Le diagnostic de l’HSDC a été posé à l’aide de l’angiographie cérébrale chez nos 19 premiers patients (19,3%), ensuite par TDM (77,5%) et IRM (3%). Ce dernier examen, disponible à Libreville depuis près de 12 ans, a permis de mettre en évidence un HSDC isodense bilatéral dans 3 cas. L’IRM, d’une sensibilité proche de 100% pour ce qui concerne l’HSDC, ne devrait pas être prescrite en première intention (7), a fortiori dans notre contexte socio-économique, excepté dans quelques cas bien particuliers tels qu’une localisation très inhabituelle de l’hématome, ou encore la suspicion d’une pathologie vasculaire ou tumorale sous-jacente. Traitement Le traitement de l’HSDC est avant tout chirurgical (1,2,3,4,5,12,16,17). Classiquement, le principe est d’évacuer la collection hématique sous-dural et de rincer abondamment la cavité pour en chasser le contenu anticoagulant et fibrinolytique, afin d’assurer la décompression cérébrale et de permettre le retour à une hémostase locale normale (2). L’indication chirurgicale sera posée dès lors que l’hématome est symptomatique. Toutefois, le degré d’urgence doit être nuancé (8) selon l’état général (états neurologique, somatique et biologique) du patient. Il sera parfois nécessaire de le conditionner et de rétablir des paramètres de coagulation avant d’intervenir (2,8). 37% de nos patients ont bénéficié d’une intervention neurochirurgicale en urgence dans l’heure qui a suivi le diagnostic ; dans 63 % de cas, l’intervention a été pratiquée dans les 24 heures. Plusieurs modalités techniques peuvent être préconisées : trous de trépan (2,4,5,17,18), tréphine (4,12), twist drill (9), ponction percutanée (19), endoscopie (13), craniotomie (3,17). Mais les questions essentielles sont celles du principe et de la durée du drainage sous-dural (8,18). La technique la plus courante et la plus simple consiste à effectuer un ou deux trous de trépan sur la convexité crânienne en regard du décollement indiqué par la TDM, ouvrir la dure-mère, puis les fausses membranes et rincer abondamment la cavité en laissant pour quelques heures un drainage externe en circuit fermé (2,3,19). Cette intervention peut se pratiquer sous anesthésie locale ; ce qui allège le geste chirurgical, principalement chez les patients âgés ou fragilisés (2). Certains auteurs recommandent une craniotomie plus élargie (volet) avec ablation des fausses membranes et/ou de cloisonnements de l’hématome sous-dural, même si son efficacité demeure discutée (2,3,17). Cette dernière technique a été abandonnée dans notre service depuis près de douze ans, car jugée lourde, surtout chez les patients âgés. A l’opposé, l’évacuation de l’HSDC, par voie endoscopique, semble s’avèrer une technique simple, et prometteuse (3,13). L’acquisition de ce matériel moderne dans un avenir proche nous permet de présager des résultats thérapeutiques meilleurs. Aussi, le drainage après évacuation d’un HSDC fait l’objet de controverses (2,3,17, 19). Récemment, une étude randomisée (18) a confirmé son efficacité dans les HSDC évacués par trous de trépan, de sorte que la recommandation est désormais systématique dans ce cas de figure (18). Tous nos malades ont bénéficié d’un drainage non aspiratif de l’espace sous- dural au moyen d’un système simple, sûr et peu onéreux. Parallèlement au geste chirurgical, certaines mesures médicales nous paraissent cruciales : Une corticothérapie – dont l’apport thérapeutique est discuté – peut être d’une certaine utilité, lorsque la clinique tarde à s’améliorer après évacuation et qu’un début de récidive est à craindre (2,3,8). Résultats et réinsertion sociale Dans l’ensemble, le résultat global du traitement de nos 102 cas d’HSDC se rapproche de ceux de la majorité évoquée dans la littérature, notamment africaine (5,8,16,17). 96 patients (94%) ont été guéris, dont 11 avec des séquelles intellectuelles-5 ou motrices-6. Six (6) patients sont décédés (6%). Il ne nous a pas été rapporté de crises convulsives durant la période de suivi de nos patients. Dans les grandes séries rapportées dans la littérature, le résultat est étroitement lié à l’état neurologique du patient au moment de l’intervention chirurgicale (3). Par contre, le volume de l’hématome, l’effet de masse et la présence d’un hématome résiduel en postopératoire ne semblent pas affecter significativement l’évolution (3) ; de même, l’influence de l’âge sur le devenir du patient opéré pour HSDC reste controversée (3). Les consultations tardives et les problèmes d’accessibilité aux soins sont, en partie, responsables des décès. Le problème de la réinsertion des patients est loin d’être résolu en Afrique, en général, et au Gabon en particulier (14). La prise en charge des malades doit être pluridisciplinaire, à la fois cohérente dans son projet et son déroulement. CONCLUSION Le diagnostic de l’HSDC est difficile en l’absence de TDM, du fait de son polymorphisme clinique, surtout chez le sujet âgé, éthylique ou sous anticoagulants. Il importe d’y penser devant des signes cliniques parfois trompeurs, pouvant orienter vers un accident vasculaire cérébral, une démence ou une encéphalite d’origine virale. Le traitement est avant tout chirurgical et urgent, afin de réduire la mortalité et la morbidité. Toutefois, le degré d’urgence doit être nuancé (2, 8), selon l’état général du patient. Dans un proche avenir, les résultats thérapeutiques seront certainement meilleurs dans notre service, grâce à la mise en place par l’Etat d’une Caisse nationale d’Assurance-Maladie et de Garantie sociale depuis trois ans. Tableau I : Symptomatologie clinique à l’admission (n=102)
Tableau II : Examen neurologique à l’admission (n=102)
Tableau III : Score de Glasgow des patients à l’admission (n=102)
Tableau IV : Indications opératoires (n=102)
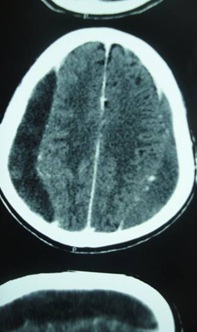 Figure n° 1a 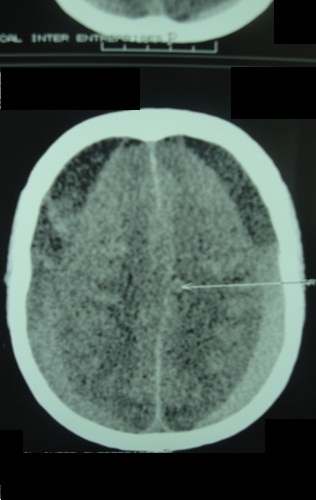 Figure n° 1b 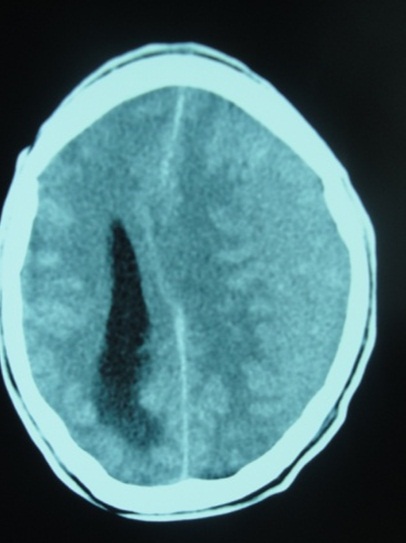 Figure n° 1c
ABSTRACT Background Objective Methodology Results Conclusion Keywords : Burr hole, Cameroon , Outcome, Chronic subdural hematoma, Treatment. RESUME Description Objectif Méthodologie Résultats Conclusion Mots clés : trou de trépan, Cameroun, Hématome sous-dural chronique, Traitement. INTRODUCTION Chronic subdural hematoma (CSDH) is a frequent pathology in Neurosurgery. Burr hole craniostomy, twist drill craniostomy or craniotomy are the different options for surgical treatment. Burr hole craniostomy is the common technique. The recurrence rate after the treatment ranges from 3.4 to 30% according to the literature (1, 2, 3, 4, 5, 6, 7, 9, 11, 15, 16, 17, 20, 23, 24). Many reports attempted to identify risk factors associated with the recurrence of CSDH. The number of burr holes appeared in some studies as a major factor of recurrence (24). PATIENTS AND METHODS All adult patients operated for Non Acute Subdural Hematoma (NASH) at the Yaoundé Central Hospital from January 2000 to September 2008 were retrospectively included in this study. The Yaoundé Central Hospital is the most important university hospital in Yaoundé. All patients were operated by the first (5%) or the second senior surgeon (92%) of the team and rarely by residents. Local anaesthesia was common (96.3%). The site of the burr hole was located at the thickest point of the haematoma which in most cases was near the intersection of the superior temporal (insertion of the temporal muscle) line and the coronal suture on the CT scan (fig2). The burr hole was done near the insertion of the temporal muscles which is a constant landmark, just before or after the coronal suture. The diameter of the hole was 1.6 cm. The subdural cavity was irrigated continuously with isotonic saline (250 to 500 cc) through a small subdural soft catheter which allowed constant evacuation all around until the fluid became clear. A drainage system without suction was connected to an extracranial subgaleal redon catheter (CH n° 16 with its holes in front of the burr hole) for 48 hours. The patients were kept (not strict) in supine position for 48 hours. The lower limbs were mobilized early and constantly to minimize the risk of deep venous thrombosis. Patients were rehydrated with intravenous isotonic saline. Patients were followed up at 3 months, 6 and 9 months. The patients lost to control were contacted by phone. Post operative CT scan (fig4) was performed (14 cases) only when the symptoms (headaches, altered consciousness, focal signs or seizures) persisted or recurred (7 cases). RESULTS One hundred and ninety five adult patients operated for NASH were included: 155 males (79.5%) and 40 females (20.5%) were involved. The mean age was 55 years (range from 21 to 89 years). Head injuries (81.5%), chronic alcoholism (12.9%), epilepsy (4.1%) or anticoagulation therapy (1.5%) were found to be the aetiological factors associated. One case was iatrogenic (complication of surgery performed for another purpose). Various types of accident were described: road traffic accidents (124 cases), assaults (30 cases), falls from the patient height (20 cases), and falls from high floors (10 cases). In 11 cases, the type of accident was not specified. The diagnosis was confirmed by CT scan in all cases. The collection was unilateral (79.9%), bilateral (26.7%) or interhemispheric (1 case). It appeared hypodense (79.9%), isodense (17.4%) or mixed (2.7%) including hypo- and hyperdense components. The delay between the accident and the surgical intervention was less than 15 days (10.5%) or ranged from 15 to 30 days (21%), 30 to 45 days (10.5%), 45 to 60 days (21.1%), 60 to 75 days (7%), 75 to 90 days (10,5%) or more than 90 days (19.4%). The treatment consisted of one burr hole drainage (92.4%), 2 burr holes per hematoma (3.6%), trephine (2%) or craniotomy (2%). The anaesthesia was local (96.3%) or general (3.7%). General anaesthesia was indicated in patients with respiratory disorders (2.05%) or in the rare cases of craniotomy. A post operative drainage was kept for 48 hours. The patients stayed in supine position for 48 hours (not strict). The drain produced 100 to 500 cc of liquid. Five patients died in the immediate post operative period (2.5%) due to pulmonary embolism (one patient), inhalation pneumonia in comatose patients with delayed management (3 cases) and brain herniation (one case). During the follow-up, 2 patients died of unrelated causes (cerebrovascular accident at 2 and 3 months). Wounds infections were observed in 2 cases. The sequellae were motor deficits (4 patients), cognitive disorders (3 patients) and epilepsy (2 cases). DISCUSSION Many procedures have been used in the treatment of chronic subdural haematomas (CSDH) with more or less success; but each technique failed to clearly demonstrate its superiority on the others: craniotomy or burr hole (5, 7, 10, 20, 22) , one or 2 burr holes (3, 17, 24), twist drill craniostomy or larger holes (4, 11, 16, 17, 23), irrigation, per or postoperative drainage (15, 16, 19, 25), post-operative 48-72 hours supine position. In many centres, there is no standard nor a consensual protocol of treatment adopted. The decision to perform one or the other technique is taken according to the personal experience or preference of the surgeon. These procedures are based on 2 fundamental principles. The first principle is the evacuation of the hematoma and to empty the cavity during the intervention (twist drill craniostomy, burr hole, craniotomy, trephine or shunting of the subdural space) (3, 4, 5, 6, 7, 15, 16, 17, 25), and eventually in the post operative period (drains). The second principle is the replacement of the pathologic fluid (containing fibrin degradation products and plasminogen activator) by an absorbable fluid (ringer lactate, saline 9%, oxygen) through continuous irrigation-drainage of the subdural space (1, 2, 19). Other debated issues concern supine position and rehydration which are supposed to facilitate the first mechanism. The purpose in our institution was to combine the different mechanisms (burr hole evacuation, intra operative irrigation and postoperative drainage) to lower the recurrence rate and complications. We thought that patients might be protected from recurrence by one mechanism if the other ones failed. If the emptying of the cavity was not complete, the patient might be protected if the residual collection was absorbable (saline or extremely diluted haematoma) or subsequently evacuated during the post-operative period. The number of burr holes has been considered as an independent predictive factor of recurrence and complications of CSDHs (24). In a previous study, the recurrence rate was reduced from 29% to 5% using 2 burr holes instead of one (24). The recurrence rate of CSDH ranges from 3.4 to 30% according to the literature (1, 2, 3, 4, 5, 6, 7, 9, 11, 15, 16, 17, 20, 23, 26). Many studies attempted to identify risk factors associated with the recurrence, but many aspects of the treatment are still debated. The recurrence rate in this series was only 3.7% using only one burr hole. Although our patients were younger with less co-morbidity than those reported in many occidental series, the recurrence was mostly associated to the inappropriate placement of the burr hole at the periphery of the hematoma. These cases were performed mostly by trainees. CONCLUSION One burr hole is an effective and safe method to evacuate Non Acute Subdural Hematoma (NASH). The number of holes does not appear as a factor of recurrence in this study. The appropriate location of the burr hole at the centre of the hematoma is important. This highlights the necessity of standard landmarks for making burr holes. The coronal suture and the temporal line are helpful landmarks. Other factors as intra-operative irrigation, the post-operative close system drainage, the postoperative supine position may have probably played an important role in the surgical outcome of our patients. The combination of these different issues during the same surgical procedure may reduce the recurrence rate and the incidence of post operative complications. Surgery of subdural haematomas should not be considered as the surgery of trainees without supervision.
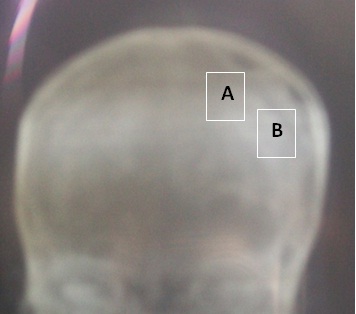 Figure1 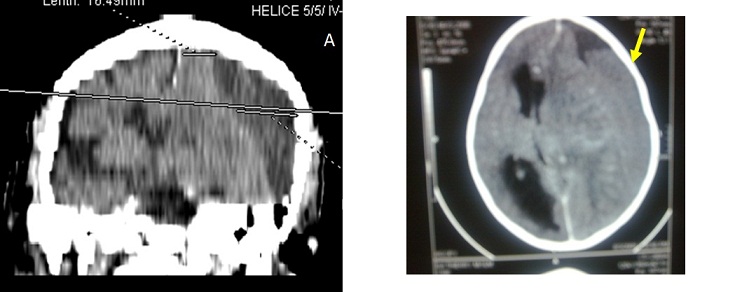 Figure 2 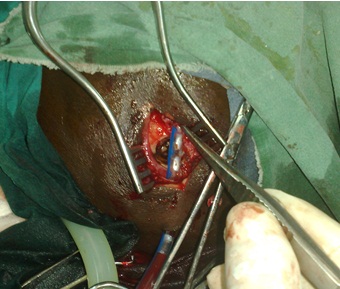 Figure 3 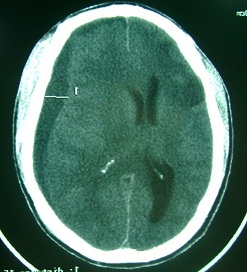 Figure 4
Articles récents
Commentaires récents
Archives
CatégoriesMéta |
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647






