|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCTION La prise en charge des infarctus cérébraux en urgence, à la phase aigue, est essentiellement basée sur les techniques de revascularisation (thrombolyse intraveineuse, thrombectomie mécanique) pour tenter de limiter les conséquences de l’occlusion artérielle. Si la thrombectomie mécanique est une technique plus récente (2015) en plein essor dans les pays développés, la thrombolyse intraveineuse est pratiquée depuis 1996 aux USA et au début des années 2000 en Europe de l’Ouest à la suite des essais du NINDS (10). Les délais d’utilisation ont été repoussés de 3 à 4h30 en 2009 après la parution de l’étude ECASS 3 (7). Cette technique, validée et efficace, qui a véritablement révolutionné la prise en charge des infarctus cérébraux, remettant au premier plan la notion d’urgence neurovasculaire, n’est que rarement pratiquée en Afrique. Les seules séries publiées concernent les pays du Maghreb et l’Afrique du Sud (2-4). En Afrique subsaharienne, hors Afrique du Sud, seules quelques observations isolées ont été publiées au Congo, au Kenya, et au Tchad (5, 8, 11). En Côte d’Ivoire, nous avons mis en place depuis octobre 2017 une filière « thrombolyse » dans un établissement hospitalier privé. Nous rapportons dans cet article tous les cas d’AVC ischémique qui ont fait l’objet de ce traitement en Côte d’Ivoire. METHODOLOGIE Il s’est agi d’une étude rétrospective descriptive, rapportant les données cliniques, thérapeutiques et pronostiques de l’ensemble des patients victimes d’AVC ischémique, qui ont fait l’objet d’un traitement par thrombolyse intraveineuse entre octobre 2017 et avril 2019. Les caractéristiques sociodémographiques des patients (âge, sexe, facteurs de risque vasculaire) ont été collectées de même que les données concernant l’AVC (topographie, délai d’admission, de réalisation de l’imagerie, de l’administration du traitement). La sévérité initiale de l’AVC a été évaluée par le score du NIH à l’admission. Tous les patients ont bénéficié d’un angioscanner cérébral avant traitement, l’IRM n’étant pas disponible en urgence. Le rt-PA a été administré conformément aux recommandations internationales à la dose de 0,9 mg/kg dont 10% de la dose en bolus. L’efficacité a été évaluée par le score du NIH à H24 et le score de Rankin modifié (mRS) à 3 mois. Une diminution du score du NIH de plus de 4 points par rapport au score initial ou une récupération complète du déficit neurologique à H24 ont été considérées comme un critère d’efficacité selon les critères du NINDS (10). Une IRM a été réalisée à H24 pour confirmer le diagnostic et rechercher une éventuelle transformation hémorragique, considérée comme symptomatique lorsqu’elle s’accompagnait d’une détérioration neurologique selon la définition adoptée dans l’étude princeps du NINDS (10). RESULTATS Pendant la période de l’étude, dix patients ont été traités par thrombolyse intraveineuse. L’âge moyen était de 49+/-17 ans avec des extrêmes de 28 et 73 ans et une médiane de 47 ans. Le sex-ratio était de 1,5. Les facteurs de risque vasculaire de ces patients sont présentés dans le tableau I. Le score NIH médian à l’admission était de 8 avec une moyenne à 10+/-5,7 et des extrêmes de 2 et 20. Les paramètres liés à la thrombolyse sont résumés dans le tableau II et ceux relatifs au pronostic dans le tableau III. DISCUSSION Après un premier cas personnel anecdotique en 2013 (non publié), nous avons entrepris de mettre en place les techniques de revascularisation à la phase aigue des AVC ischémiques à Abidjan, en commençant par la thrombolyse intraveineuse. En 18 mois, nous avons ainsi pratiqué 10 thrombolyses. Ce nombre, bien que relativement faible, demeure cependant le plus important en Afrique subsaharienne, les séries rapportées dans la littérature ne concernant que les pays d’Afrique du Nord et l’Afrique du Sud. Ainsi, 52 patients ont été pris en charge à Fez, dans la seule unité neurovasculaire que comptait le Maroc en 4 ans entre 2010 et 2013 (4). Une série de 13 patients traités par du ténecteplase dans un hôpital militaire a également été publiée dans ce même pays à Rabat (2) en un peu plus de 4 ans. La thrombolyse est aussi d’usage courant en Egypte et en Tunisie (14, 9). Il faut noter que dans le registre international des thrombolyses, SITS-thrombolysis (12), la Tunisie a répertorié à fin 2018, 3189 thrombolyses, l’Egypte, 3517 cas, l’Algérie, 124 cas, la Lybie, 6 cas, et le Maroc, 1132 (Figure). La proportion de patients traités reste cependant très faible de l’ordre de 1 à 2% des AVC ischémiques en raison particulièrement de l’absence de prise en charge des coûts par les systèmes de santé (9, 1). Des situations similaires sont décrites en Afrique du Sud, (qui ne participe pas au registre SITS-thrombolyse) où la thrombolyse intraveineuse est également pratiquée (3, 13). En dehors de ces régions, on ne retrouve dans la littérature africaine que quelques cas cliniques isolés au Congo (11), au Kenya (5) ou encore au Tchad (8). Dans notre série, les paramètres d’efficacité et de tolérance étaient relativement comparables aux données de la littérature (Tableau II). Nous nous sommes référés particulièrement au registre des urgences de la vallée du Rhône en France (RESUVAL) et au registre international SITS-Thrombolyse (6,12). On peut constater que les délais AVC-admission sont assez proches, bien qu’il n’y ait pas véritablement d’organisation du transport jusqu’à l’hôpital et que nous perdons du temps essentiellement dans la réalisation de l’imagerie (61 vs 25 minutes dans le registre SITS-Thrombolyse), ce qui impacte significativement le délai admission-traitement. Cette situation est due au fait que l’imagerie aux heures non ouvrables (nuits, week-ends et jours fériés) fonctionne sur un système d’astreinte à domicile, avec donc un délai supplémentaire pour faire venir le technicien d’imagerie. L’instauration prochaine d’une garde sur place permettant un accès 24h/24 à l’imagerie devrait remédier à ce fait. Concernant le pronostic, nous obtenons de meilleurs résultats que nos références (Tableau III) en matière de décès et de récupération neurologique, mais il faut tenir compte du fait que notre échantillon est d’une part, nettement plus jeune (de 15 ans environ) et d’autre part, initialement moins sévère (NIHSS initial 3 à 4 points inférieur). Nous n’avons pas non plus enregistré de transformation hémorragique symptomatique, sans doute aussi en raison de la moindre sévérité initiale des AVC des patients inclus. Certains obstacles demeurent cependant. La nécessité de raccourcir le délai intrahospitalier, en particulier le délai de réalisation de l’imagerie est bien mise en évidence dans cette étude. L’information de cette possibilité thérapeutique devra également être portée au grand public, ce qui devrait accroître le nombre de patients bénéficiaires. Nous prévoyons aussi à court terme, après cette phase initiale de « rodage », d’implémenter la thrombolyse dans deux autres établissements de la ville, et même de débuter les thrombectomies dans l’un des centres qui dispose du plateau technique nécessaire. CONCLUSION Cette étude démontre la faisabilité de la thrombolyse intraveineuse à la phase aigue des infarctus cérébraux en Afrique noire, avec un profil d’efficacité et de sécurité satisfaisants. Certes, il demeure des obstacles importants pour l’accessibilité de ces traitements au plus grand nombre, notamment son coût et sa disponibilité dans les centres hospitaliers publics, mais il est temps que la sous région de l’Afrique subsaharienne adopte et développe ces méthodes de prise en charge, au moment ou les AVC y sont particulièrement fréquents et de pronostic péjoratif.
TABLEAUX Tableau I : Facteurs de risque vasculaires des 10 patients traités par thrombolyse IV à Abidjan entre octobre 2017 et avril 2019.
Tableau II : Résultats comparés des paramètres liés à la thrombolyse des 10 patients traités par thrombolyse IV à Abidjan entre octobre 2017 et avril 2019.
1 : Réseau des Urgences de la Vallée du Rhône, France. 2 : Safe Implementation of Treatments in Stroke. 3 : Door to needle time = délai admission-thrombolyse. 4 : AHA/ASA = American Heart Association/American Stroke Association. 5 : National Institute of Neurological Disorders and Stroke
Tableau III : Pronostic des 10 patients traités par thrombolyse IV à Abidjan entre octobre 2017 et avril 2019
1 : Réseau des Urgences de la Vallée du Rhône, France. 2: Safe Implementation of Treatments in Stroke. 3 : National Institute of Health Stroke Scale. 4: modified Rankin Scale. FIGURE
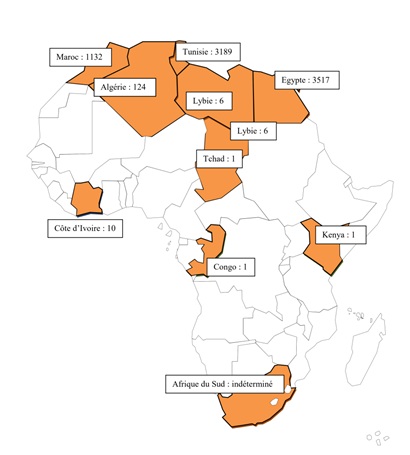 Nombre de thrombolyses réalisées dans notre étude et en Afrique par pays selon les données de la littérature (jusqu’à fin 2018). INTRODUCTION L’épilepsie est l’une des maladies neurologiques les plus fréquentes. 70 millions de personnes dans le monde en souffrent, 80% d’entre eux vivent dans les pays en développement (1,9,14, 38,46). En Afrique, elle touche plus de 5,4 millions de personnes avec 4,4 millions en Afrique sub-saharienne (37). Au Maroc, elle constitue le 2ème motif de consultation en neurologie mais malgré cela, très peu d’études épidémiologiques lui ont été consacrées. Sa prévalence est estimée à 1,1 %, ce qui doit constituer plus de 370 000 épileptiques (23). La prise en charge médicamenteuse de l’épilepsie est adaptée au type d’épilepsie, à son étiologie, à l’âge du patient. Quatre molécules classiques sont toujours considérées comme des médicaments antiépileptiques majeurs (AEM). Il s’agit du phénobarbital, de l’acide valproique, de la carbamazepine et de la phenytoïne. Depuis 1990, 16 autres médicaments antiépileptiques ont été mis à la disposition des patients. Leurs principaux avantages résideraient, pour certains, dans une meilleure tolérance, liée à de moindres effets secondaires (30,42). Si dans tous les pays développés et quelques pays en développement, les MAE peuvent être arrêtés, au bout de deux à cinq ans de traitement, chez environ 70% des enfants et 60% des adultes sans aucun risque de rechutes (39) ; en Afrique, le nombre des patients traités pour épilepsie, leur prise en charge médicale et les coûts associés sont très mal connus. En effet, dans ces régions, plusieurs facteurs peuvent constituer un obstacle au traitement de cette maladie et interférer avec les interventions médicales en temps opportun. Grâce à une recherche bibliographique faite sur la base de données PubMed ainsi que sur les revues marocaines, cet article vise d’une part à mettre le point sur les différents facteurs qui peuvent expliquer le déficit thérapeutique de l’épilepsie au Maroc et d’autre part à comparer la situation de notre pays à celle des autres pays africains. Dans cet article, nous ne discuterons que l’absence de traitement des patients épileptiques ainsi que les raisons de celle-ci. Les autres aspects du déficit thérapeutique tels que les traitements médicamenteux inappropriés et la mauvaise observance ne seront pas abordés. REALITES DE L’EPILEPSIE AU MAROC EN COMPARAISON AVEC LES AUTRES PAYS AFRICAINS Au Maroc, la prise en charge de l’épilepsie a connu de grandes avancées depuis les années quatre-vingt-dix mais cela reste insuffisant puisqu’une grande majorité de personnes atteintes de cette maladie ne reçoivent aucun traitement. Ce déficit thérapeutique peut dépasser parfois les 70% selon les estimations des compagnes médicales faites dans le monde rural et essentiellement dans les régions sud du pays (23). La situation est quasi identique dans la majorité des pays Africains ; en effet, selon les données de l’OMS, l’écart entre les patients traités et non traités est de l’ordre de 95% en Ethiopie, en Gambie, au Nigeria, au Togo, en Ouganda et en Zambie (25). En Tanzanie, 69% des enfants ne sont pas traités (27). Des facteurs économiques et sociaux peuvent être évoqués pour expliquer ce déficit thérapeutique. Faible effectif des professionnels de santé qualifiés Au Maroc, des progrès indiscutables ont été accomplis dans la formation médicale. Aujourd’hui, le nombre de neurologues exerçant est de 120, ce qui constitue un ratio significatif par rapport aux années quatre-vingt où ce nombre ne dépassait pas une dizaine de neurologues (19). Cependant la plupart de ces médecins restent au niveau des grands centres urbains. En général, en Afrique du Nord et en Afrique du Sud, il y a 1 neurologue pour 300 000 à 400 000 personnes (31) par contre dans les autres pays africains, leur nombre ne dépasse pas en moyenne 0,3 neurologues par millions d’habitants comparativement à près de 30 neurologues par millions d’habitants pour les pays à revenu élevé (17). Normalement, pour pallier au manque de médecins spécialisés, le médecin généraliste peut aider dans la prise en charge des patients épileptiques puisqu’il est situé en première ligne dans le système de santé et il est implanté souvent dans des endroits vides de neurologues. Malheureusement, la plupart de ces médecins manquent de formation dans le domaine de l’épileptologie. Problèmes liés aux établissements de santé Le faible nombre des établissements de santé auquel s’ajoute l’éloignement des structures déjà existantes contribuent au déficit thérapeutique de l’épilepsie dans la majorité des pays africains. Actuellement, le Maroc est doté de treize services de neurologie dont six uniquement sont spécialisés en épileptologie. Quant à leur équipement, ces six centres sont bien équipés en électroencéphalogramme (EEG) et en imagerie par raisonnante magnétique (IRM) et tout autre matériel nécessaire pour émettre le bon diagnostic et suivre les patients durant toute la période de leur traitement. Mais à cause de la mauvaise répartition du peu des neurologues marocains ; certaines régions, comme le sud du pays, sont dépourvues de la moindre structure neurologique pouvant accueillir les patients épileptiques (19,23). En comparaison avec d’autres pays africains, le Maroc ainsi que l’Afrique de Sud sont considérés parmi les pays d’Afrique les mieux équipés ce qui n’est pas le cas pour les autres pays d’Afrique tel que Cap-Vert, Chad, Gambie et autres (10). Disponibilité des médicaments antiépileptiques Les antiépileptiques classiques disponibles au Maroc sont la Carbamazépine, le Phénobarbital et le Valproate de sodium (disponibles en princeps et plusieurs génériques). Ceux non disponibles sont la Carbamazépine sirop et la Phénytoïne (comprimés et injectable). Parmi les nouvelles molécules antiépileptiques dont nous disposons au Maroc aussi bien en tant que princeps qu’en forme générique, nous trouvons la Gabapentine, la Lamotrigine, l’Oxcarbazépine, le Lévétiracétam, le Prégabalin et le Topiramate dont seul le générique est disponible (5,23). A l’exception de l’Afrique de Sud et des pays d’Afrique du Nord, les médicaments antiépileptiques ne sont pas facilement disponibles ce qui peut être à l’origine de la survenue de crises. L’Organisation mondiale de la Santé (OMS) a mené une étude sur les données relatives à la disponibilité des 30 médicaments prescrits dans les pathologies graves et les pathologies chroniques telle que l’épilepsie dans les centres de soins de 40 pays en voie de développement parmi lesquels se trouvent des pays africains. Les résultats ont montré qu’il y avait un manque de disponibilité de ces médicaments parmi lesquels se trouvent les antiépileptiques (8). Coût du traitement Les médicaments antiépileptiques ne sont pas tous financièrement accessibles. Ce sont essentiellement les AEM qui sont prescrit pour le traitement de l’épilepsie puisque le déterminant majeur qui gère généralement leur prescription est le coût du traitement. Les coûts annuels sont compris dans l’intervalle de 25 à 50 USD pour le phénobarbital, de 200 à 300 USD pour la phénytoine, 300 à 500 USD pour la carbamazépine et 300 à 500 USD pour le valproate (10). Au Maroc, les médicaments couramment utilisés sont le Valproate de sodium et la Carbamazépine avec des coûts annuels respectifs compris entre 200 et 300 USD et entre 300 et 350 USD. Pour son coût très accessible pour la majorité des patients marocains (25 à 40 USD) le Phénobarbital reste, le médicament antiépileptique le plus prescrit. Les nouveaux médicaments sont en grande progression au cours de ces six dernières années (19). Une étude prospective menée en 2011 dans le service de neurologie du Centre hospitalier universitaire Hassan II de Fès -Maroc- sur 60 patients épileptiques a montré que 54% étaient sous valproate de sodium, 17% sous carbamazépine, 9% sous phénobarbital et 7% sous lamotrigine (5). Donc, au Maroc, le Phénobarbital est en train de laisser du terrain aux autres médicaments en raison de ses effets secondaires très gênants, surtout chez les enfants et les sujets âgés. Par contre, en Afrique Subsaharienne, compte tenu de son avantage économique, le Phénobarbital reste l’antiépileptique le plus prescrit et le médicament de première ligne dans la stratégie du traitement de cette maladie (3,32,41,47). Les résultats de l’étude de Karuiki et ses collaborateurs l’ont confirmé puisqu’ils ont trouvé que, chez 2170 patients épileptiques résidants dans différents pays appartenant à cette région, le phénobarbital était prescrit chez 94% des patients suivi par la carbamazépine avec 40%, 28,8% pour la phénytoine, 28% pour le diazépam et 3,3% pour le valproate de sodium (16). Comparativement, dans les pays développés, ces dernières années, le coût des soins apportés aux patients épileptiques a augmenté, particulièrement avec la bonne observance, l’arrivée des nouveaux antiépileptiques et l’amélioration des moyens d’investigation. Ce coût varie de 2000 à 3000 USD alors qu’il était de 100 à 500 USD avec l’ancienne génération d’antiépileptiques. En Afrique, seuls le Maroc, la Tunisie, l’Egypte, le Zimbabwe et l’Afrique de Sud disposent de quelques antiépileptiques appartenant à la nouvelle génération tels que l’oxycarbazépine, la lamotrigine et le vigabatrin (10). Couverture sociale insuffisante Au Maroc, le remboursement des médicaments en général se fait à un taux de 70% du prix de vente des médicaments inscrits dans la liste arrêtée par le ministère de la santé marocain. Selon l’agence nationale de l’assurance maladie (ANAM), la majorité des antiépileptiques qui existent sur le marché marocain sont admis au remboursement par l’assurance maladie obligatoire (AMO), à l’exception de l’oxcarbazépine, le Prégabalin et l’acide valproique à libération prolongée. Malheureusement, moins de 30% des marocains ont une couverture sociale. Mais depuis 2011, avec le régime d’assistance médicale (RAMED), le taux a augmenté significativement, et pourra atteindre 60% dans les quelques années à venir (23).
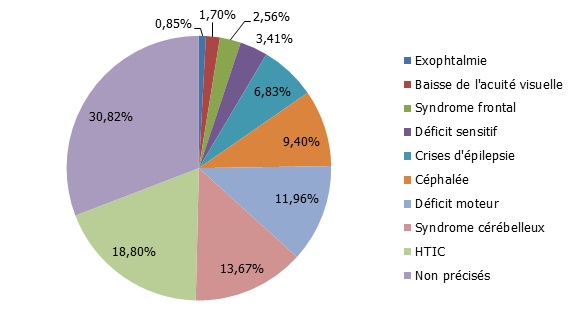
Utilisation des thérapies alternatives Le recours aux tradipraticiens se retrouve en bonne position dans le domaine de l’épilepsie au Maroc. Il s’agit d’une conduite corrélée aux croyances selon lesquelles l’épilepsie aurait des causes surnaturelles (13,20). Une étude réalisée en 2002 à Marrakech –Maroc- chez 230 patients épileptiques a montré que 74 % des patients ont affirmé avoir eu recours aux pratiques traditionnelles avant leur suivi hospitalier. Une étude faite au Nigéria a montré que plus de 60% des patients inclus dans l’étude y ont eu recours (22). Les pratiques traditionnelles sont réparties entre les Talismans, l’écriture d’amulette, les brûlures, le pèlerinage auprès des Saints, la lecture du Coran et l’utilisation de plantes (31, 35). Influence des facteurs sociaux Plusieurs facteurs sociaux sont à l’origine du taux faible de déclaration de l’épilepsie et de la prise en charge très tardive des patients. Au Maroc, l’analphabétisme, le manque de culture médicale, le poids des traditions constituent une barrière au traitement biomédical. En effet, la plupart des patients souffrant d’épilepsie préfèrent l’anonymat et sont réticents à divulguer leur état à cause des préjugés négatifs associés à l’épilepsie (15,23,31,35,44). Cette maladie est la plupart du temps associée à une stigmatisation importante (4,15,17), à la sorcellerie (43), aux malédictions et à la discrimination (2,4,9,12,13,15,16,20,21,22,28,35,43-45). Ces préjugés ont des répercutions sur le développement social, comportemental, physique et psychologique des malades. Ces préjugés négatifs sont plus profonds dans le milieu rural que dans le milieu urbain. Ils ne sont pas particuliers au Maroc, mais ils sont répandus dans la majorité des pays africains. En effet, des études ont été réalisées à Zimbabwe (45), à Zambia (6), à Ouganda (40), au Kenya (11), au Nigéria (33) et dans d’autres pays africains ont soulevé l’existence de cette différence de prise en charge des patients vivant dans ces deux milieux. Au total, les préjugés peuvent être à l’origine de conséquences dévastatrices sur la qualité de vie des patients en termes de scolarité et de discrimination pour les enfants et en termes d’offre d’emploi et de mariage pour les adultes. Plusieurs études ont évalué l’impact de ces facteurs sur la qualité de vie des patients épileptiques vivant en Afrique (7,18,24,26,29,34,36). A Zimbabwe, Mielke et al ont montré dans leur étude que l’épilepsie a un impact profond sur le fonctionnement social des personnes atteintes de cette maladie (26). En Ouganda, Nabukenya et al (29), en calculant différents scores, ont pu montrer chez 175 patients épileptiques une faible estime de soi avec comme impact la stigmatisation et des autres préjugés négatifs sur toutes les dimensions de la vie. PERSPECTIVES Au Maroc, les stratégies appropriées pour réduire le déficit thérapeutique de l’épilepsie sont multiples. Dans le domaine du traitement médical, des efforts sont fournis pour essayer d’élargir la couverture médicale à la majorité de la population marocaine. Quant au traitement chirurgical, il est actuellement disponible dans les centres hospitalo-universitaires de Rabat et de Fès, mais il ne concerne malheureusement, vu les recours humains et matériels, que les épilepsies temporales pharmaco-résistantes ayant une lésion visible à l’IRM. Le traitement de l’épilepsie par radio-chirurgie est aussi disponible au Maroc mais à cause du prix alloué à ce traitement, il n’est réservé qu’aux patients qui ont une assurance privée complémentaire à L’AMO. Dans leur lutte contre le déficit thérapeutique de l’épilepsie, les professionnels de santé doivent être accompagnés par les travailleurs sociaux, par les patients eux même ainsi que leurs familles, par les leaders d’opinion et par toutes les instances qui peuvent apporter de l’aide dans le but d’éviter les facteurs de risque, de réduire la stigmatisation, d’améliorer de l’accès au diagnostic biomédical et au traitement. Si toutes ces conditions se réunissent, les résultats seraient très favorables avec la maîtrise totale des crises, la reprise d’une vie normale et l’éviction de toutes les conséquences sociales, professionnelles et familiales parfois dramatiques. LES TUMEURS DU SYSTEME NERVEUX CENTRAL A ANTANANARIVO MADAGASCARINTRODUCTION Les tumeurs intracrâniennes se définissent comme tout processus expansifs intracrâniens malins ou bénins, primitives ou secondaires qui intéressent la boite crânienne, les enveloppes ou le parenchyme cérébral (2). L’incidence des tumeurs cérébrales dans le monde en 2008 est estimée globalement, à partir des registres généraux de cancer, à 3,5 pour 100 000 (taux annuel standardisé) ce qui correspond à 237 913 nouveaux cas par an dans le monde (Ferlay et coll.) (11). Les incidences les plus bas sont enregistrées sur le continent africain (1,4/100 000) et les plus élevées dans les pays européens (5,4/100 000) en particulier en Europe du Nord (7,1/100 000) avec des incidences supérieures à 10/100 000 en Norvège, au Danemark et en Finlande, et en Amérique du Nord (5,6/100 000) (11). Les tumeurs cérébrales sont révélées le plus souvent dans 03 circonstances : les crises d’épilepsie, l’hypertension intracrânienne et les signes déficitaires focaux (6). Selon la classification topographique des tumeurs cérébrales, elles peuvent siéger soit au-dessus, soit au-dessous de la tente du cervelet, soit à cheval entre les deux. Ainsi, on distingue: les tumeurs sus-tentorielles (lobes cérébraux, hémisphériques profondes et hémisphériques médianes), les tumeurs sous-tentorielles, les tumeurs à cheval entre les deux étages (13). La nouvelle classification des tumeurs du système nerveux de l’OMS, basée sur la biologie moléculaire et la génétique de chaque tumeur, est établie en 2016 et quelques sous-types sont ajoutés (16). Le diagnostic est suspecté à la clinique, à l’imagerie et est confirmé par l’examen anatomo-pathologique. L’incidence de cette pathologie est restée encore mal connue à Madagascar, motivant l’initiation de ce travail, afin de décrire les aspects épidémiologique et histopathologique des tumeurs primitives cérébrales. METHODES Il s’agit d’une étude rétrospective bicentrique, de 117 cas de tumeurs du système nerveux central, menée dans 2 laboratoires d’Anatomie Pathologique d’Antananarivo, Madagascar : l’UPFR d’ACP du CHU-JRA, laboratoire de référence du Ministère de la Santé Publique, et le laboratoire d’Anatomie pathologique SALFA Andohalo, sur une période de 10 ans, allant de Janvier 2007 à Décembre 2016. Nous avons inclus toutes les tumeurs primitives et secondaires de l’enfant (âge inférieur ou égal à 15 ans) et de l’adulte (âge supérieur à 15 ans). Le recueil des données est fait par analyse des dossiers des patients hospitalisés ou non, dont les prélèvements ont fait l’objet d’un examen histologique dans ces 2 laboratoires. Les paramètres étudiés ont été le genre, le sexe, les renseignements cliniques, la topographie et l’histologie. Une relecture des lames a été faite et la classification utilisée a été celle de l’OMS 2007. RESULTATS Nous avons colligé 117 cas soit 0,29 % de tous les prélèvements reçus dans ces 2 laboratoires pendant la période d’étude. L’incidence a été de 0,51/100 000 habitants. L’âge moyen de nos patients était de 37,83 ans avec des extrêmes de 9 mois et 79 ans. Le sex ratio était 0,64 soit une prédominance féminine dans 54,33%. La population pédiatrique (âge inférieur ou égal à 15 ans) représentait 19,65 % contre 80,35 % pour les adultes. Les principaux signes révélateurs ont été l’hypertension intracrânienne (18,8 %), le syndrome cérébelleux (13,67 %) et le déficit moteur (11,96 %). L’exophtalmie a représenté 0,85 % et la baisse de l’acuité visuelle 1,70 %. Aucun renseignement clinique n’est fourni dans 30,82 % des cas (figure 1). Figure 01 : Répartition des signes révélateurs selon les renseignements cliniques donnés.
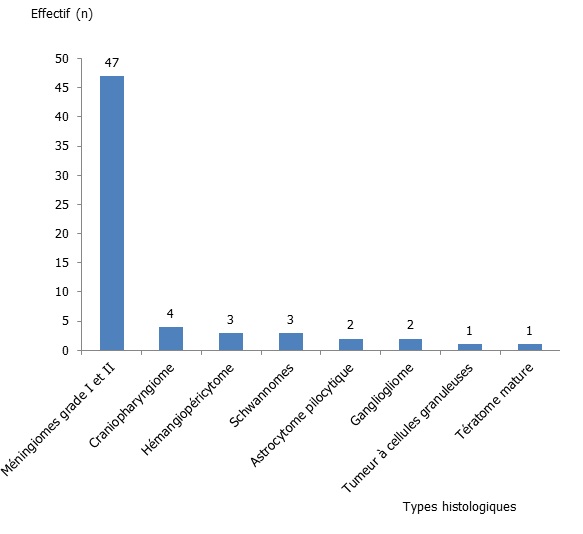
Concernant la topographie, notre étude a montré une prédominance des tumeurs de la région sus-tentorielle (23,93 %), c’est-à-dire 11 cas dans la loge frontale (9,40 %), 9 cas dans la loge pariétale (7,69 %), 5 cas en temporale (4,27 %) et 3 dans l’hypophyse (2,56 %), suivie de la fosse postérieure (22 cas soit 18,80 %). Les tumeurs à cheval sur la région sus et sous-tentorielle ont représentées 3,41 % (4 cas). Le siège du reste des cas n’est pas mentionné. Concernant le type histologique, nous avons observé 53,80 % de tumeurs bénignes (grade I et II) dont 47 méningiomes grade I et II (40,18 %), 4 craniopharyngiome (3,41 %), 3 hémangiopéricytome (2,55 %), 3 schwannomes (2,56 %), 2 astrocytome pilocytique (1,70 %), 2 gangliogliome (1,70 %), une tumeur à cellules granuleuses (0,85 %), et un tératome mature (0,85 %) (figure 2).
Figure 02 : Répartition selon les types histologiques des tumeurs bénignes
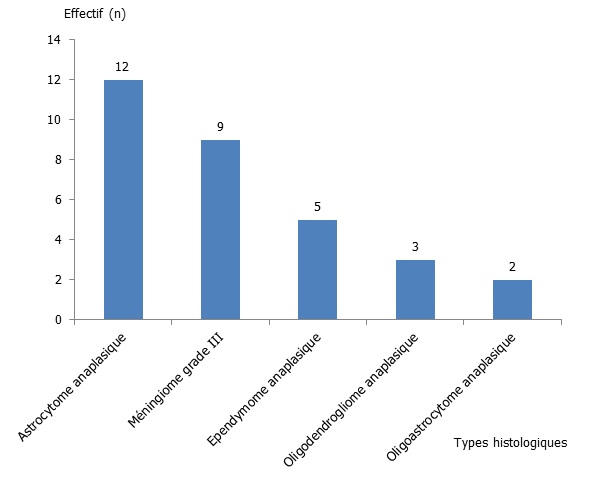
Les tumeurs de malignité intermédiaire ont représenté 25,65 % avec 12 astrocytome anaplasique (10,25 %), 9 méningiome grade III (7,72 %), 5 épendymome anaplasique (4,27 %), 3 oligodendrogliome anaplasique (2,56 %), et un oligoastrocytome anaplasique (0,85 %) (figure 3).
Figure 03 : Répartition selon les types histologiques des tumeurs de malignité intermédiaire.
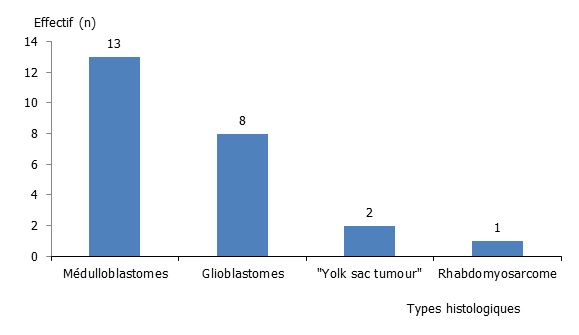
Les tumeurs malignes ont constitué 20,55 % des cas dont 13 médulloblastomes (11,17 %), 8 glioblastomes (6,83 %), 2 « Yolk sac tumour » (1,70 %), et un rhabdomyosarcome (0,85 %) (figure 4).
Figure 04 : Répartition selon les types histologiques des tumeurs malignes
Tableau 1: Corrélations entre la nature histologique, le sex ratio, et l’âge moyen
Le tableau 1 montre le sex ratio et l’âge moyen des patients selon la nature histologique des tumeurs. Nous avons noté une prédominance féminine et les âges moyens ont varié de 32 à 43 ans selon la nature histologique (tableau I).
Tableau 2 : Nature et répartition des tumeurs selon la localisation
Le tableau 2 montre la corrélation entre la nature histologique et les différentes localisations. FP : fosse postérieure Sus-tentorielle : F : frontale P : pariétale T : temporale H : hypophyse 2 : à cheval sur la région sus et sous-tentorielle NP : non précisée
DISCUSSION
Concernant la fréquence, l’incidence annuelle des tumeurs intracrâniennes primitives entre 1998 à 2002 en Amérique a estimée à 14,8/100.000 habitants par an (21). En France, selon Zaouaoui et coll., l’incidence a été de l’ordre de 15/100 000 habitants par an (25). A Madagascar, des études antérieures faites par Mamisoa (18) et Ramarikoto (23) ont trouvé respectivement 25 cas sur une période de 18 mois et 54 cas sur une période de 4 ans. Dans notre étude, nous avons observé 117 cas de tumeurs cérébrales en 10 ans soit une incidence de 0,51/100 000 habitants. Il pourrait s’agir d’un état mais le nombre faible de laboratoire d’Anatomie Pathologique et leurs concentrations dans la capitale, et l’insuffisance de service de neurochirurgie et de diagnostic pourraient en être les causes. Cette faible incidence pourrait être aussi la réticence des patients à rejoindre les centres hospitaliers afin de bénéficier d’une prise en charge diagnostique adéquate, par peur des hôpitaux, et surtout par faute de moyen financier. La neurochirurgie serait encore pour certaines familles un acte couteux et à risque. Dans une étude faite au Maroc, les enfant ont représenté 16,72 % et les adultes (83,28 %)(17). Nos résultats se sont rapprochés des données marocaines avec 19,65 % de cas chez l’enfant contre 80,35 % chez l’adulte.
Certains auteurs n’ont pas signalé de prépondérance de sexe (3,5). Dans d’autres pays, comme en France (25) et au Mali (24), ont trouvé une prédominance masculine respectivement dans 53,3 % et 64,70 % avec un sex ratio de 1,42. D’autres séries ont montré une légère prédominance féminine comme au Japon avec 50,44 % (20) ou à Madagascar avec 60 % et 52,72 % (18,23). Notre étude rejoint ces derniers avec une prédominance féminine dans 54,33 % soit un sex ratio de 0,64. La prédominance des méningiomes observés surtout chez la femme expliquerait en partie ce résultat.
En France, Zouaoui et coll. ont trouvé que l’âge médian au diagnostic a été de 56 ans et l’âge moyen de 52,3 ans (25). Une étude faite en Espagne a trouvé une moyenne d’âge entre 55 à 64 ans (10). Au Maroc, selon Jalal Massour et coll., l’âge moyen des malades a été de 44 ans (14). Dans la série d’Alexis Thera au Mali, l’âge moyen a été de 30,59 ans (24). Dans notre travail, l’âge moyen de nos patients a été de 37,83 ans.
A Strasbourg, les signes d’hypertension intracrânienne ont représenté le principal signe d’appel avec 41 % suivi des crises comitiales à 15 % (19). D’après le référentiel national français du collège des Enseignants de la neurochirurgie, la fréquence des signes visuels dans les tumeurs intracrâniennes est liée à celle du syndrome d’HTIC étant donnée le lien de ces signes avec la croissance du processus expansif intracrânien ou avec le blocage des voies d’écoulement du liquide céphalo-spinal. Par ordre décroissant de gravité, ils se manifestent par : une baisse de l’acuité avec flou visuel, puis cécité par atrophie optique (8). Au Maroc selon Alaouch, le maître symptôme est représenté par le signe d’hypertension intracrânien dans 70% des cas (1). A Madagascar, selon Bemmo, les tumeurs cérébrales se manifestent par des céphalées et des vomissements dans 69,05% des cas, des troubles visuels dans 66,67 % des cas, de baisse d’acuité visuelle (47,62%), des crises convulsives (26,05 %) et de cécité (19,05%)(4). D’après Mamisoa, les troubles ophtalmologiques ont été retrouvés dans 07 cas soit 28% dont 04 cas de baisse de l’acuité visuelle, 02 cas d’hémianopsie bitemporale, et 01 de cécité (18). Dans notre série, les signes revélateurs sont l’hypertension intracrânienne (18,8 %), le syndrome cérébelleux (13,67 %), le déficit moteur (11,96 %), la baisse de l’acuité visuelle 1,7 % et l’exophalmie 0,85 %.
En France, selon Gilbert D (12), les tumeurs frontales occupent 24% de l’ensemble des tumeurs intracrâniennes, les tumeurs temporales 18%, les tumeurs de la région pariétales 6 à 7% et les tumeurs occipitales 2 à 3%. Dans notre étude, la localisation la plus fréquente a été le lobe frontal (9,40 %), suivie du lobe pariétale (7,69 %), du lobe temporale (4,27 %) et de l’hypophyse (2,56 %).
Bemmo a trouvé une localisation sous-tentorielle de 23% pour les tumeurs cérébrales (4). Dans notre série, nous avons observé une prédominance des tumeurs de la fosse postérieure dans 18,80% (n=22).
Dans notre étude, nous avons observé 4 tumeurs à cheval sur la région sus et sous-tentorielle.
En Australie (9), Martin Dobes constatait que 58,09 % des tumeurs cérébrales ont été bénignes et 41,90 % malignes. Aux Etats Unis, selon Quinn, les études réalisées en 2010 concernant les tumeurs cérébrales ont montré une prédominance des tumeurs bénignes (22). Nous avons observé une prédominance des tumeurs bénignes (53,80 %), suivie des tumeurs de malignité intermédiaire (25,65%) et des tumeurs malignes (20,55 %).
Aux Etats Unis, parmi les tumeurs bénignes, les méningiomes ont représenté 35,8 % des cas (15). En France, Zouaoui et coll. ont constaté que les tumeurs bénignes étaient surtout représentées par les méningiomes (25). Au Mali, Alexis Thera a retrouvé dans leur série d’étude que le méningiome représentait la majorité des cas de tumeur bénigne (24). Au Maroc selon Alaouch et coll., les tumeurs bénignes sont surtout dominées par les méningiomes (23,5%) (1). Notre résultat corrobore ces constats. Nous avons observé 53,80 % de tumeurs bénignes (grade I et II) dont 47 méningiomes grade I et II (40,18 %), 4 craniopharyngiomes (3,41 %), 3 hémangiopéricytomes (2,55 %), 3 schwannomes (2,56 %), 2 astrocytomes pilocytiques (1,70 %), 2 gangliogliomes (1,70 %), une tumeur à cellules granuleuses (0,85 %), et un tératome mature (0,85 %).
Dans notre série, les tumeurs de malignité intermédiaire ont représenté 25,65 % avec 12 astrocytome anaplasique (10,25 %), 9 méningiome grade III (7,72 %), 5 épendymome anaplasique (4,27 %), 3 oligodendrogliome anaplasique (2,56 %), et un oligoastrocytome anaplasique (0,85 %).
Aux Etat-Unis, selon Quinn, les tumeurs malignes cérébrales sont surtout représentées par le glioblastome dans 42,5 % (22). En France, selon Cohadon, les tumeurs primitives cérébrales ont occupé plus de 80% de l’ensemble des tumeurs intracrâniennes et sont surtout représentées par le gliome (7). Au Mali selon Alexis Thera, le gliome a représenté la majorité des cas de tumeurs malignes, soit 16 % de toutes les tumeurs cérébrales confondues (24). Au Maroc, le glioblastome a représenté 18 % des tumeurs intracrâniennes (1). Dans notre série à Madagascar, les tumeurs malignes ont constitué 20,55% des cas dont 13 médulloblastomes (11,17 %), 8 glioblastomes (6,83 %), 2 « Yolk sac tumour » (1,70 %), et un rhabdomyosarcome (0,85 %). CONCLUSION Nous avons recensé 117 cas de tumeurs cérébrales sur une période de 10 ans soit 0,29 % de tous les prélèvements avec une fréquence de 0,51/100 000 habitants, contrairement aux pays industrialisés où la fréquence est plus élevée. L’âge moyen de nos patients a été plus jeunes (37,83 ans). Nous avons noté une prédominance féminine et les adultes sont les plus touchés. Les tumeurs méningées ont été observées plus fréquemment chez les femmes. Chez l’enfant, les tumeurs de la fosse postérieure ont prédominé, et sont représentées par le médulloblastome. Les tumeurs du tronc cérébral ne figurent dans notre série car ces tumeurs n’ont pas été opérées. Nous avons pu mettre en évidence la fréquence des tumeurs à cheval sur la région sus et sous-tentorielle ainsi que la répartition des tumeurs à malignité intermédiaire qui sont rarement discutées. CONFLITS D’INTERETS Les auteurs ne déclarent aucun conflit d’intérêt. CONTRIBUTIONS DES AUTEURS Tous les auteurs ont contribué à cet article et ont lu et approuvé la version finale de ce manuscrit. TROUBLES COGNITIFS ET DIABETE DE TYPE 2 AU CONGOINTRODUCTION Le diabète de type 2 (DS 2) est une maladie métabolique caractérisée par une hyperglycémie chronique secondaire à une résistance à l’insuline et/ou à une anomalie de l’insulinosécrétion [3]. C’est une maladie chronique dont l’expansion mondiale lui confère les caractéristiques d’une pandémie [38]. Le DS 2 représente la forme de diabète sucré la plus fréquente avec plus de 85% des cas [38]. En Afrique subsaharienne (ASS), le DS 2 représente un problème majeur de santé publique. On estime une augmentation de sa prévalence de 12,1 millions en 2010 à 23,9 millions d’ici 2030 [46]. Les fonctions cognitives sont des aptitudes et capacités qui permettent les opérations intellectuelles de la pensée et du raisonnement. Elles comprennent : l’orientation, l’attention et la concentration, la mémoire, et l’abstraction [12,19]. Leur altération représente un problème de santé publique. L’influence du diabète sur les fonctions cérébrales est de plus en plus étudiée. La plupart de ces études ont été réalisées dans des populations des sujets âgés, chez lesquels la présence des co-morbidités peut surestimer la prévalence de ces troubles [31,47,55]. Les conséquences du diabète sur les fonctions cérébrales sont représentées par : le déclin cognitif, les démences, les états dépressifs et les accidents vasculaires cérébraux (AVC) [31]. Cependant, la relation entre le diabète et les AVC reste la plus documentée [27,45]. Les troubles cognitifs représentent les complications cérébrales du diabète les moins documentées en Afrique. Au Congo, avec une prévalence entre 4 et 6% [38], le DS 2 a bénéficié de plusieurs études [32-34], nous n’avons pas trouvé une étude ayant abordé la problématique des troubles cognitifs du diabétique de type 2. L’identification de ces troubles cognitifs a cependant, toute son importance en raison non seulement de leur conséquence en termes d’observance thérapeutique, mais aussi de leur impact sur la prise en charge globale et le rendement socioprofessionnel du patient diabétique. Le but de cette étude est d’évaluer les fonctions cognitives chez le diabétique congolais de type 2.
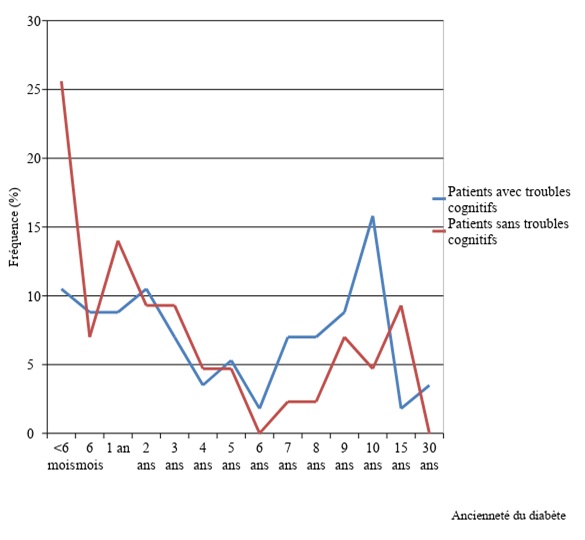
METHODOLOGIE Il s’est agi d’une étude cas-témoins menée du 05 janvier au 30 juin 2015, en consultation externe de diabétologie de l’hôpital Adolphe Sicé de Pointe Noire et du CHU de Brazzaville. Concernant les participants à notre étude, les cas et témoins ont été consentants à participer à l’étude. Ainsi, ces participants ont été classés en deux groupes : les cas, patients diabétiques, âgés d’au moins 40 ans, et les témoins constitués des patients non diabétiques, âgés d’au moins 40 ans. Les témoins ont été choisis parmi les accompagnateurs des patients et le personnel soignant. Tous les patients ayant un antécédent d’accident vasculaire cérébral, ayant présenté un coma au courant des trois derniers mois, présentant un handicap sensoriel sévère ou une dépression, n’ont pas été inclus. Les variables ont été d’ordre épidémiologique, clinique et paraclinique. La dépression a été évaluée par l’échelle gériatrique de dépression ayant 15 items, l’évaluation des fonctions cognitives a été réalisée à partir du test de Grober et Buschke ou RL/RI-16, dans sa version validée par l’étude EPIDEMCA au Congo [21,22]. Les données ont été saisies sur les logiciels Excel 2010 et analysées sur CDC Epi info 7.1.5. Le seuil de significativité choisi pour l’ensemble des analyses statistiques a été de 0,05. Le modèle de régression logistique a permis d’identifier les facteurs associés à la survenue des troubles cognitifs. Seuls les facteurs avec une valeur de p<0,20 ont été retenus pour analyse multivariée. RESULTATS Nous avons inclus 100 cas et 100 témoins. La fréquence globale des troubles cognitifs était de 57% (n=57) chez les patients diabétiques et 34% (n=34) chez les témoins. Les diabétiques étaient âgés entre 40 et 80 ans avec une moyenne 56,30 ± 8,60 ans, les témoins étaient âgés de 40 à 82 ans avec une moyenne 57,70 ± 11,50. L’âge moyen des patients ayant des troubles cognitifs était de 58,50±8,92 chez les diabétiques et 65,32±10,64. Concernant le genre, 55 (55%) femmes et 45 (45%) hommes ont été diabétiques, soit un sex ratio de 0,82 (H/F). Trente-deux (56,1%) diabétiques de sexe féminin et 25 (43,9%) de sexe masculin avaient des troubles cognitifs soit un sex ratio de 0,78 (H/F). Chez les témoins 50 (50%) ont été de sexe féminin et 50 (50%) ont été de sexe masculin ; 22 (64,7%) patients de sexe féminin et 12 (37,3%) avaient des troubles cognitifs. Dans le groupe des patients diabétiques, la durée moyenne d’évolution du diabète était de 5,24±5,83 ans [extrêmes 9 mois et 30 ans]. Les troubles cognitifs étaient en proportion élevés chez les patients diabétiques qui avaient un diabète évoluant entre 6 et 10 ans (Figure 1). Soixante-seize pourcent des patients diabétiques (n=77) étaient déséquilibrés avec un pourcentage moyen d’hémoglobine glyquée (HbA1C) de 8,7±2,2 [Extrêmes 5 – 14%]. Sur l’ensemble des patients diabétiques, 49% avaient un antécédent d’hospitalisation pour le diabète. Le délai moyen entre l’inclusion et la dernière hospitalisation était de 2,55±4,64 [extrêmes : 6mois – 7 ans]. Quarante-cinq patients avaient un antécédent d’au moins un épisode d’acidocétose, dont la durée moyenne entre le dernier épisode et l’inclusion dans l’étude était de 3,09±5,49 [Extrêmes : 4 mois -30 ans]. Dix-huit patients (18%) avaient rapporté au moins un épisode d’hypoglycémie, 2 (2%) patients ne pouvaient préciser si oui ou non, ils avaient déjà présenté une hypoglycémie et 80 patients n’avaient aucun antécédent d’hypoglycémie. Le délai moyen entre le dernier épisode d’hypoglycémie et l’inclusion dans l’étude était de 1,12±1,17 [Extrêmes 4mois – 5 ans]. La répartition selon les différents types de troubles cognitifs est représentée dans le tableau I. On analyse univariée, le diabète est un facteur indépendant de risque de troubles cognitifs avec un OR = 2,57 et un intervalle de confiance à 95% [1,45-4,56], p=0,0012. Le tableau II et III présentent l’analyse univariée de risque des troubles cognitifs, respectivement dans les deux groupes et chez les diabétiques. Concernant les différents types de troubles cognitifs, seuls les troubles des fonctions exécutives étaient associées au diabète, OR : 3,67, IC 95% [1,28-6,98], p=0,002 Après ajustement sur différents facteurs, le diabète demeure un facteur de risque des troubles cognitifs avec un OR ajusté = 3,72, IC 95% [1,77-7,80] et un p=0,0005. Le modèle final, multivarié est représenté dans le tableau IV. DISCUSSION Les études sur l’évaluation des fonctions cognitives en Afrique sub-sahariennes sont rares du fait de la rareté des outils transculturels validés. L’utilisation préférentielle du test de Grober et Buschke au cours de l’évaluation des fonctions cognitives dans notre étude se justifie par le fait que ce test est essentiel dans l’évaluation des différentes composantes de la mémoire, l’attention et les reconnaissances [51], de même, il a bénéficié d’une adaptation validée pour la population congolaise [21,22]. La fréquence des troubles cognitifs chez les patients diabétiques était de 57% avec un OR à 2,57 et un IC95% [1,45-4,56], p=0,0012 par rapport aux patients non diabétiques. Nos résultats sont supérieurs à ceux de Roy et al aux USA qui rapportent une fréquence de 19,5% [44]. Cette différence est essentiellement d’ordre méthodologique, car leur étude a utilisé une population beaucoup plus jeune entre 18 et 60 ans, et l’identification des troubles cognitifs n’a été réalisée qu’avec le MMS, qui est moins sensible que le Grober et Buschke. Cependant nos résultats sont proches de ceux de plusieurs études. Luchsinger et al [28] ont rapporté une fréquence de 42.5% de MCI dans le groupe des diabétiques contre 34,5% chez les non diabétiques. Fontbonne et al [18], en France ont rapporté un OR à 2,3 et un IC95% [1,20-4,30] et Feinkohl et al [17], en Ecosse estiment que la fréquence des troubles cognitifs chez les patients diabétiques varie entre 20 et 50%. L’âge moyen de 56 ans chez les diabétiques et 57 ans chez les témoins dans notre étude est superposable à celui obtenu par plusieurs auteurs. En Chine Zhang et al [61] et Wang et al [53] ont retrouvé un âge moyen respectif 57ans et 60 ans dans les deux groupes ; Xia et al [59] qui ont rapporté un âge moyen de 58 ans chez les diabétiques et 55 ans chez les témoins. Certains travaux réalisés uniquement chez les patients âgés rapportent un âge moyen supérieur au nôtre. C’est le cas d’Umegaki et al [50], Van Harten et al [52] et Manshot et al [30] qui ont rapporté un âge moyen respectifs de 74 ans, 73 ans et 66 ans. La tranche d’âge la plus représentée dans notre étude, est superposable à celle rapportée dans la littérature [3,40,44]. L’âge supérieur à 60 ans a été un facteur de risque indépendant de survenue des troubles cognitifs chez les patients diabétiques, comme l’ont aussi rapporté certains auteurs [39,41]. Cela se justifie par le fait que le vieillissement entraine une altération du système endocrinien à l’origine d’une vulnérabilité au déséquilibre métabolique. Cependant, de façon intéressante notre étude a montré que l’âge inférieur à 60 ans, est un facteur protecteur avec un OR à 0,27; un IC95% [0,15-0,50], p<0,00001, en analyse univariée, et OR à 0,042 ; un IC95% [0,20-0,88], p=0,021, après ajustement sur les autres facteurs en analyse multivariée. Aucune donnée de la littérature disponible ne nous a permis de comparer nos résultats. Cependant, l’existence des troubles cognitifs dans cette tranche d’âge a été rapportée par certains auteurs [37,44]. Les données sur le sexe sont discordantes dans la littérature. Nos résultats sont proches de ceux de Roy et al [44] aux USA, qui ont rapporté des effectifs homme/femme de 44/38, Wang et al [53] en Chine qui ont rapporté des effectifs de 95/93 chez les diabétiques et 128/138 chez les témoins ainsi que Zhou et al [62] toujours en Chine, qui ont rapporté des effectifs 44/44 chez les diabétiques et 56/49 chez les non diabétiques; Certains travaux notent une prédominance féminine [11,15,61] alors que d’autres rapportent une prédominance masculine [17,29]. Dans toutes ces études, le sexe n’est pas significativement associé à la survenue de troubles cognitifs. La prédominance féminine chez les patients avec troubles cognitifs peut être justifiée le fait que notre population d’étude était plus féminine. Le niveau socioculturel secondaire a été le plus représentatif dans notre étude. Ceci s’explique par l’âge de notre population, et du fait qu’il y a quelques décennies, la majorité des congolais accédaient au marché de l’emploie avec un niveau secondaire. Le niveau socioculturel bas, a été identifié comme facteur de risque de survenue des troubles cognitifs. Bruce et al [5] rapportent un OR à 4,2 ; un IC95% [1,90-9,10], ce qui est légèrement supérieur à nos résultats OR à 3,29 et un IC95% [1,79-6,03], p=0,001. Cette observation corrobore certaines données de la littérature [20,51]. Cependant Roy et al [44] et Crosby-Nwaobi et al [9] en Iran notent qu’il n’y a pas de lien entre le niveau socio-culturel et la survenue des troubles cognitifs. En effet le bas niveau socio culturel peut insinuer une mauvaise observance thérapeutique, une méconnaissance des facteurs de risque vasculaires, pouvant être responsable de la survenue d’une altération des fonctions cognitives. Concernant les facteurs de risque vasculaires, l’hypertension artérielle est le plus fréquent dans la population congolaise [25]. Sa fréquence élevée dans les deux groupes, est le reflet de sa prévalence en population général. L’hypertension artérielle est un facteur de risque indépendant de survenue des troubles cognitifs, avec un OR à 6, un IC95% [2,86-12,61], p<0,00001 en comparant les patients diabétiques aux témoins, et un OR à 3,67; IC95%[1,43-9,43], p=0,007, en comparant des patients sans troubles cognitifs à ceux ayant des troubles cognitifs au sein des patients diabétiques. Nos résultats corroborent les données de la littérature [9,41,50,53]. Johnson et al [24] ont rapporté l’association entre l’hypertension artérielle et la survenue des troubles cognitifs, ainsi que la régression du risque sous l’effet des traitements antihypertenseurs. L’influence de l’hypertension chez les patients diabétiques, dans la survenue des troubles cognitifs passe par la majoration de complications micro et macrovasculaire. Certaines études par contre n’ont montré aucune association entre l’hypertension artérielle et la survenue des troubles cognitifs chez les patients diabétiques [5,30]. Peu d’études ont abordé la relation entre les dyslipidémies et les troubles cognitifs chez les patients diabétiques, avec des résultats discordants [17,59]. L’absence d’association retrouvée dans notre étude a été rapportée par certains auteurs [6,44,60]. Plusieurs auteurs ont soulevé l’existence d’une association entre l’hypertriglycéridémie et l’hypercholestérolémie avec les troubles cognitifs [6,16,50]. Xia et al [59] en Chine ont rapporté une association entre le faible taux de cholestérol total, de LDL-CT et les troubles cognitifs. Cette différence est non seulement d’ordre méthodologique en rapport avec l’étude de type cohorte menée par la plupart de ces auteurs mais aussi en rapport avec la grande fréquence de dyslipidémie dans certaines études tel que dans celle de Feinkohl et al [17], où il y avait 92,7% de cas. Nos résultats sur l’obésité vont dans le même sens que ceux de Roberts et al [43] en Ecosse, qui n’ont noté aucun lien entre l’obésité et la survenue des troubles cognitifs. Par contre Whitmer et al [56] ont rapporté l’influence de l’obésité sur les troubles cognitifs. L’action de l’obésité sur la survenue des troubles cognitifs passerait par l’augmentation des cytokines pro-inflammatoires, non seulement au niveau des tissus adipeux, mais aussi au niveau du système nerveux [23,54]. Très peu d’études réalisées sur les troubles cognitifs chez les diabétiques ont abordés le lien avec le tabagisme. Ceux qui l’ont abordé ont rapportés une association entre les habitudes tabagiques et la survenue des troubles cognitifs chez les patients diabétiques [16,28]. Cette différence s’explique par la rareté du tabagique en Afrique mais également parce que l’aveu du tabagisme est difficile. Ni l’hyperglycémie, ni le taux de l’HbA1c >7% n’ont été associés au risque de survenue des troubles cognitifs dans notre étude, comme l’ont aussi rapporté Bruce et al [5], Chen et al [6] et Umegaki et al [50] et Yanagawa et al [60]. Plusieurs études cependant, ont rapporté le lien entre le déséquilibre de l’HbA1c et les troubles cognitifs [30,42], ainsi que le déséquilibre glycémique et la survenue des troubles cognitifs [1]. L’effet de l’hyperglycémie passerait par une augmentation du stress oxydatif, à l’accumulation des produits de glycation avancée dans le cerveau conduisant à une anomalie structurelle et fonctionnelle au niveau du cerveau, ainsi qu’à une insulino-résistance au niveau cérébral [14,23]. L’absence d’association retrouvée dans notre étude se justifie par la durée de l’étude limitée. Nous avons trouvé que la moitié de nos patients atteints de déficience cognitive avaient un diabète évoluant entre 6 et 10 ans. Dans la présente étude l’ancienneté du diabète supérieure à 5ans était un facteur de risque de survenue des troubles cognitifs OR : 2,39 (IC 95% : 1,04-5,49) p=0,04. Pernot et al [41], dans leur revue de la littérature rapportent un lien entre l’ancienneté du diabète et la survenue des troubles cognitifs. Le lien entre la durée du diabète et les troubles cognitifs peut se justifier par le fait que le diabète de type 2 est souvent silencieux et découvert déjà au stade de complications. De même certains auteurs affirment que la durée du diabète est importante dans la pathogenèse de troubles cognitifs chez les sujets diabétiques [15,44]. D’autres auteurs par contre, rapportent l’influence sur les troubles cognitifs pour une durée supérieure à 10 ans [47,49]. Dans notre étude aucune complication classique du diabète n’a influencé la survenue de troubles cognitifs. Nous résultats sont superposables à ceux de Roy et al [44] aux USA qui ont rapporté une absence d’association entre le degré de microalbuminurie et les troubles cognitifs. Concernant la neuropathie, Moreira et al au Brésil [36] ont retrouvé les mêmes résultats, dans leur travail ayant étudié spécifiquement l’association entre l’existence d’une neuropathie diabétique, sa sévérité et la survenue des troubles cognitifs. Gorska-Ciebiada et al [20] ont également rapporté l’absence d’association entre la neuropathie et les troubles cognitifs, alors que la rétinopathie et la néphropathie diabétique étaient associées à la survenue de MCI. Pernot et al [41] dans leur revue ont rapporté une influence de la microalbuminurie sur les fonctions cognitives avec un OR à 1,38; un IC95% [1,2-1,6] ce qui différe de nos résultats. L’influence de la rétinopathie et de la néphropathie a été également rapporté par Ding et al [13] et De Bresser et al [10]. Cela s’explique par le fait que les troubles cognitifs et les autres complications du DS II ont en partie les mêmes mécanismes physiopathologiques par le biais de la microangiopathie. En 2014, une méta-analyse réalisée par Monette et al [35], sur les différentes perturbations pouvant être mises en évidence au cours du bilan neuropsychologique réalisé chez les patients diabétiques, a montré que les troubles cognitifs étaient dominés par des troubles exécutifs, avec au premier plan, des troubles attentionnels, puis des troubles mnésiques et à une moindre mesure une faiblesse de l’efficience globale. D’autres études affirment une augmentation significative du risque de développer tous les types de démence y compris la maladie d’Alzheimer, chez les sujets diabétiques [2], ce qui a été également rapporté par Biessels et al [4], dans leur revue de 14 études longitudinales, où l’incidence des différents troubles cognitifs était plus élevée chez les sujets diabétiques, par rapport aux non diabétiques. Notre étude rapporte des troubles mnésiques, à type d’amnésie d’évocation, d’atteinte de l’encodage, ainsi que des troubles attentionnels, comme l’ont aussi rapporté Pernot et al [41]. Convit et al [8] ainsi que Kodl et al [26], ont rapporté que les troubles des fonctions exécutives, sont les plus fréquemment rapportés, principalement des troubles attentionnels, la flexibilité mentale (expliquant les troubles de l’encodage dans notre étude), l’apprentissage et la mémoire (expliquant l’amnésie d’évocation) et l’habilité motrice qui n’a pas été étudiée dans notre travail. Seule l’atteinte de l’encodage présente une association avec le diabète dans notre étude. Tran et al [48] ont montré que les troubles des fonctions exécutives sont fréquents chez le diabétique, et influencent leur capacité et habilité à recourir aux services de soins. CONCLUSION Nos données préliminaires prouvent que les diabétiques de type 2 sont plus susceptibles de développer des troubles cognitifs par rapport aux non diabétiques. L’équilibre glycémique et la prise en charge précoce du diabète peuvent améliorer la fonction cognitive. Des facteurs de risque tels que l’âge, l’HTA, le bas niveau socio culturel, les épisodes d’hypoglycémie peuvent influencer la survenue des troubles cognitifs chez les diabétiques. La recherche de la plainte mnésique mérite d’être systématique dans le suivi des patients diabétiques. D’autres travaux sont indispensables en particulier des études de cohorte alliant à la fois les outils neuropsychologiques, des marqueurs biologiques et l’imagerie cérébrale afin de mieux comprendre la relation entre le diabète type 2 et les troubles cognitifs.
Le tableau I : Répartition des différents troubles cognitifs dans les deux groupes.
Tableau II. Analyse univariée sur le risque de survenue des troubles cognitifs.
NSC : Niveau socioculturel *NSC bas : analphabète et primaire.
Tableau III : Analyse univariée des différentes variables chez les patients diabétiques.
Le tableau IV : Analyse multivariée des différents facteurs
Articles récents
Commentaires récents
Archives
CatégoriesMéta |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647