|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCTION One of the leading brain disorders in developing countries such as sub-Saharan Africa (SSA) is represented by epilepsy. It is estimated that 80% of people living with epilepsy (PWE) around the world, reside in developing world such as Africa (1). In Ethiopia, the prevalence of epilepsy in rural area was estimated to be 5.1 in 1000 and incidence was 64 /100,000 (2). Contrary to the western countries, very few PWE get adequate treatment in low-and middle-income countries (LMIC), whereby the treatment gap reaches around 95 % (1,3). Antiepileptic drugs (AEDs) are effective in treatment of epilepsy whereby about 70% of patients with epilepsy can be seizure free. Good adherence to AEDs will results in remission and functional restoration among individuals suffering from epilepsy (4). In most cases the stigma of the disorder plays a major role in discouraging people from seeking treatment for symptoms and becoming identified with the disorder; in different communities there is a belief that epilepsy is contagious and hesitate to give help a person who has fallen during seizure (5); further worsening the poor adherence of AEDs among PWE. Epilepsy is widely associated with increased mortality and morbidity. PWE have estimated mortality of two to three times than general population (3). In most developing countries, factors that attribute for treatment gap of epilepsy in includes: limited access to health care facilities, unavailability of AED, lack of awareness of medical treatment, cultural stigmas and poor adherence (6). Non-adherence to medication treatment regimens is a worldwide health problem. Non-adherence rates among patients with epilepsy range from 30% to 50 % and highly associated with morbidity and mortality of the illness (4–7). Poor adherence to AEDs leads to repeated seizure attack, psychosocial stress; factors contributing to the treatment adherence could be individual factors like demographic and socioeconomic features, perception and beliefs about epilepsy; disease features like seizure frequency and severity; medication use like number of daily doses and side effects, and factors related to patient–provider relationship (4–7). To date, most of the studies conducted to evaluate AEDs adherence among PWE did not account for the influence of variables such as, comorbid depression. Therefore, the objective of this study was to assess the prevalence of AEDs adherence and associated factors in epileptic individuals in tertiary care centers in Addis Ababa, Ethiopia. METHODS AND MATERIALS Study area and design The study was conducted at the Neurology referral clinic in Tikur Anbesa Specialized Hospital (TASH) and Zewditu Memorial Hospital (ZMH). TASH is the largest specialized referral teaching hospital in the country. Epilepsy is one of the top ten diseases seen at neurology referral clinic. ZMH is one of the tertiary level public hospital affiliated with TASH and located in the vicinity of TASH. Combined, nearly 1,200 PWE /year are seen both at TASH and ZMH. The Study was conducted from April 1st, 2018 to September 30, 2018. This is a facility based observational cross-sectional survey in a sample of an epileptic patients visiting the two neurology referral clinic during study period fulfilling the inclusion criteria; age ≥13 years and on the AEDs treatment for at least six months. Assessment tools used during the study Morisky Medication Adherence Scale (MMAS-8) was used for adherence assessment. Sensitivity of this scale was estimated to be 93%, and the specificity was 53%. The medication adherence measure proved to be reliable with good concurrent and predictive validity in primarily low income, minority patients with hypertension. Score of ≤ 2 are to be adherent and >2 are to be non-adherent (8). Depression was assessed using a well validated assessment tool; Patient Health Questionnaire (PHQ)-9 PHQ-9 with a sensitivity of 88% and specificity of 88% for major depression. PHQ-9 score 5, 10, 15, and 20 represents mild, moderate, moderately severe and severe depression (9). Statistical analysis Clinical characteristics were first described by their means, frequency, percentile, and standard deviation. Association were done using chi square or Fisher exact test, logistic regression analysis and results were presented using odds ratio (OR), and p value was set at < 0.05 as statistically significant. Ethical considerations Ethical clearance was obtained from Addis Ababa University School of Medicine Neurology Department Ethics Committee. All questionnaires were coded to maintain maximum confidentiality. All patients gave a written or verbal consent before the interview. RESULTS Baseline and clinical characteristics of study participants A total of 250 epileptic patients were included in the present study. The mean age was 29.4 ± 11.5 years. The prevalence of AEDs non-adherence was 47.6% (n=119) and 45.2% fulfilled diagnostic criteria of comorbid depression (Table 1). Those participants age below 30 years shows significant association with antiepileptic drugs non-adherence compared with those above age 30 (Figure 1). Males accounted for 54% (n=135). The majority (92%) came from urban areas. More than half (65.6%) were single. Majority (65.2%) of the participants attended primary education and above; and little more than half of the patients were unemployed. Out of the total participants, nearly two-third of the patients reported having seizure in the past two weeks despite taking the AEDs. In majority of the epileptic patients (n=215, 86%), the antiepileptic drug was initiated immediately / or after one year. Those individuals who reported stigma shows higher AEDs non-adherence compared to those with no-stigma (Figure 2). Hundred thirty-nine (55.6%) participants were on monotherapy; and more than half (59.6%) of the patients pay for their AEDs by themselves (Table 1). Risk factors of antiepileptic drugs (AEDs) non-adherence in the study participants In the present study, individuals aged below 30 year were significantly associated with AEDs non-adherence compared to those above 30 (p=0.01); and no significant difference was observed between gender and AEDs non-adherence (p=0.85). In the present study, single epileptic patients are associated with AEDs non-adherence. No association was observed between non-adherence and employment status; level of education; AEDs polytherapy; and AEDs insurance coverage (Table 2). Co-morbid depression was significantly associated with AEDs non-adherence (p=0.009). In the present survey, near-significant association was observed between AEDs non-adherence and having seizure in the past two years (p=0.05). Higher proportion of AEDs non-adherence was observed among epileptic patients who started AEDs immediately/ or after 1 year, compared to those patients who started AEDs late after epilepsy diagnosis (p=0.08) (Table 2). Logistic regression analysis of AEDs non-adherence and covariates In the present study, in multivariate logistic analysis, age of the study participants (AOR 0.94, 95% CI 0.89-0.98, p=0.006); age at first seizure (AOR 1.07, 95% CI 1.03-1.12, p=0.001); and comorbid depression (AOR 1.80, 95% CI 1.01-0.32, p=0.04) were found to be an independent predictors of AEDs non-adherence when adjusted for the covariates. In univariate logistic regression analysis, being single was associated with AEDs non-adherence (COR 2.05, 95% CI 1.20-3.51, p=0.009); however, when adjusted for age, age at first seizure, and comorbid depression, near-significant association was observed (p=0.07) (Table 3). DISCUSSION AND CONCLUSION Patients with epilepsy have increased mortality and morbidity compared to general population (10–12). Non-adherence to AEDs considered one of the reasons for such detrimental effect of epilepsy (13,14). The present study found out that 46.7% of patients were non-adherent to their AEDs. Globally the rate of non-adherence range between 30 and 50 % (15–17). The present study is consistent with cross sectional study conducted in Nigeria were the rate of non-adherence was 44.5 % (16), but higher than other studies (10,11,18). The discrepancy in the rate of non-adherence with other study is due to different methods in assessing adherence and sample size. This result highlighted the need to address the poor antiepileptic drug adherence observed among people living with epilepsy in Ethiopia. In the present study, higher proportion of non-adherence was observed in younger, single, and those study participants who reported stigma. Many of the studies including local regarding factors associated with poor treatment adherence found longer treatment duration, forgetfulness, complex therapy, cost of the drug and comorbid illness (14–17,19). In this study comorbid depression found to be predictor of poor adherence which is consistent with one study in china (12). In the present study, factors such as; being single and feeling of stigma because of their diagnosis was associated with higher proportion of AEDs non-adherence. These is consistent with previously reported studies; which identified the following factors influencing adherence including: specific beliefs about medications, being depressed or anxious, poor medication self-administration management, being married, uncontrolled recent seizures, frequent medication dosage times, being female, and financial or cost of drugs (5,6,20,21). Therefore, it’s important to tackle these factors in epileptic patients to improve their AEDs adherence. In the present observation, younger study participants, having seizure in a younger age, and experiencing seizure in the past two years were associated with antiepileptic drugs non-adherence. These results are consistent with previously reported studies (4,6,20–23). This highlighted on the need to focus on the younger epileptic patients to improve their adherence and frequently assessing their antiepileptic medications schedules; this way we may able to detect those having poor adherence and able to intervene earlier. Through logistic regression, age at first seizure, being single and comorbid depression showed association with poor adherence. Previous studies also showed consistent findings with the present study (22–25).This finding necessitate screening of patient regularly for comorbid depression and giving emphasis regarding treatment adherence among younger age groups. In the present study, comorbid depression was observed in nearly half of the study participants. This is consistent with previously reported studies which shown that the prevalence of depression is higher in those with epilepsy as compared to matched healthy controls (26–28). Depression is the most common comorbid psychiatric disorder in patients with epilepsy, yet it remains under- recognized and under-treated and reported by nearly 43% (26–28). This result further supports the need to include routine screening of depression among epileptic patients in Ethiopia; in order to identify, diagnose, and treat early. The limitations of this study include: small sample size and lack of healthy control groups. In summary, the present study showed high prevalence of antiepileptic medication non-adherence among epileptic patients in Addis Ababa, Ethiopia. Furthermore, participants age, age at first seizure, and comorbid depression were found to be independent predictors of AEDs non-adherence. We recommend conducting a future prospective control study in order to consolidate the present results. Acknowledgements: We thank all the patients who participated in this study and all the nurses working at the two neurology clinics Declarations: Consent to publish: Participants consent for publication is not applicable. Availability of data and materials: All data sets on which the conclusions of the manuscript rely are available as spread excel sheets documents and available from the corresponding author on reasonable request from the journal. Competing interests: The authors declare they have no competing financial interests. Funding: No funding was received.
Table 1: Baseline characteristics of study participants (n=250)
Table 2: Risk factors of AEDs non-adherence in the study participants (n=250)
Table 3: Logistics regression analysis of AEDs non-adherence and covariates
COR: Crude odds ratio; AOR: Adjusted odds ratio; CI: Confidence interval; Ref.: Reference.
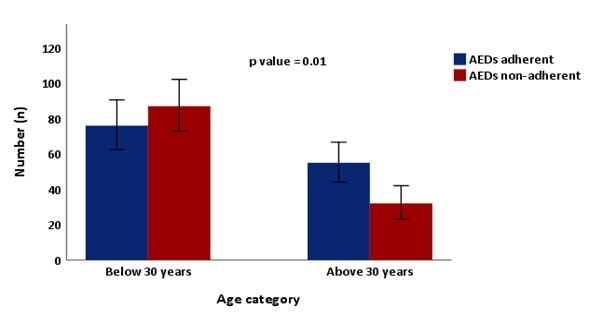 Figure 1: Bar graph showing association between those below age 30 years and antiepileptic drugs (AEDs) non-adherence.
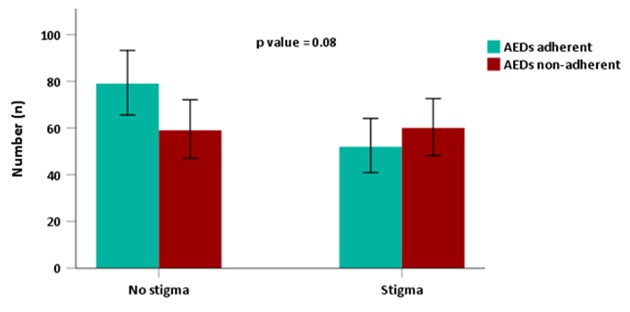 Figure 2: Bar graph showing a near-significant association between stigma and antiepileptic drugs (AEDs) non-adherent study participants INTRODUCTION Les accidents vasculaires cérébraux (AVC) constituent un véritable enjeu de santé publique. Chaque année, environ quinze millions de personnes en souffrent dans le monde, parmi lesquels cinq millions meurent et cinq autres millions vivent avec un handicap permanent (15). Dans les pays en développement (PED), ils représentent la deuxième cause de mortalité (16) et plus de 80% des décès causés par les AVC intéressent ces pays. L’incidence des AVC en 2030 est estimée à 23 millions et les PED auront à supporter 30% de ce nombre (22,31). La baisse des taux de mortalité observée dans les pays industrialisés est la conséquence d’une meilleure prévention primaire et secondaire, et d’une meilleure prise en charge à la phase aiguë. En Afrique subsaharienne, le délai moyen d’admission varie de 24 h à 365 jours tandis qu’en occident il est de 30 mn à 18 h (20). La mortalité globale à un mois varie de 20,3% à 44,6% en Afrique subsaharienne contre 22,9% en occident (6,7,32,36). Les AVC ont représenté 8,8% des hospitalisés dans le service de neurologie à Bangui en République Centrafricaine en 2004 avec un taux de mortalité de ces patients en hospitalisation de 33% (21). Les facteurs pronostiques des AVC en milieu hospitalier sont dominés par les facteurs neurologiques (crises convulsives, récidives d’AVC), les facteurs cardiaques et les complications de décubitus. Une prise en charge dans un milieu spécialisé dans les 48 premières heures permet de diminuer le taux de mortalité et le handicap de 20% (3). Les causes et les facteurs associés à la mortalité par AVC en Centrafrique ne sont pas encore connus. L’insuffisance des moyens d’exploration neurologique, source d’erreurs diagnostiques, entrave la prise en charge efficiente des patients victimes de ces affections ce qui a pour corollaire une augmentation de la mortalité. Cette létalité élevée serait aussi en rapport avec un délai d’admission plus allongé où les patients admis au-delà de 24 heures seraient plus exposés à un risque de décès. Le délai d’admission des patients souffrant d’AVC pourrait donc être un facteur pronostique préhospitalier associé à la mortalité, facteur très peu documenté en Afrique Sub-saharienne. C’est pourquoi nous avons mené cette étude afin d’évaluer la valeur pronostique du délai d’admission des patients victimes d’AVC sur la durée de survie un mois après l’hospitalisation dans les hôpitaux de Bangui. METHODOLOGIE Il s’agit d’une étude pronostique transversale de type prospectif réalisée à Bangui dans les services de neurologie de l’hôpital de l’Amitié, de médecine interne de l’hôpital communautaire et des unités de soins intensifs de ces hôpitaux, de février à août 2019. Le recrutement des sujets était exhaustif à l’aide d’un questionnaire confectionné se basant sur celui modifié de l’Organisation Mondiale de la Santé (OMS) sur les désordres neurologiques. Ont été inclus tout patient âgé de plus de dix-huit ans et répondant à la définition clinique de notre étude : déficit d’une fonction cérébrale (motrice, sensitive, visuelle, phasique) ou d’un nerf crânien, focal, brutal sans notion de traumatisme, spontané et persistant dans le temps, depuis plus de vingt-quatre heures (3) ; revu au contrôle de suivi à un mois ; dont le consentement éclairé a été obtenu auprès d’un tiers informant proche du sujet. Les survivants ont été revus le jour de leur sortie de l’hôpital et un mois après le diagnostic. Ne faisait pas partie de notre échantillon, tout patient non revu à un mois, hormis ceux décédés pendant l’hospitalisation. Le traitement et l’analyse des données ont été faits avec le logiciel Statview 5.0 (SAS Institue, Cary, USA). Deux analyses ont été faites :
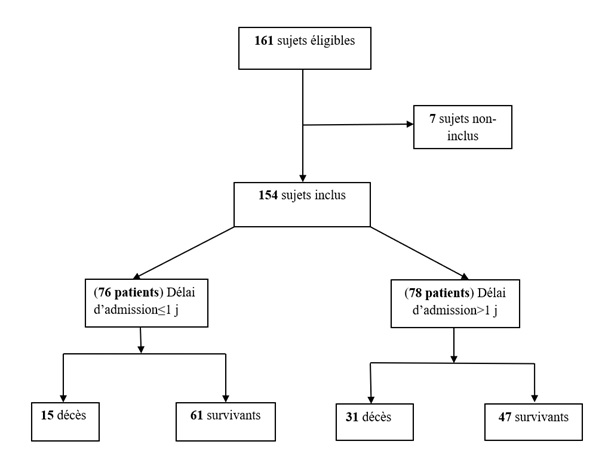
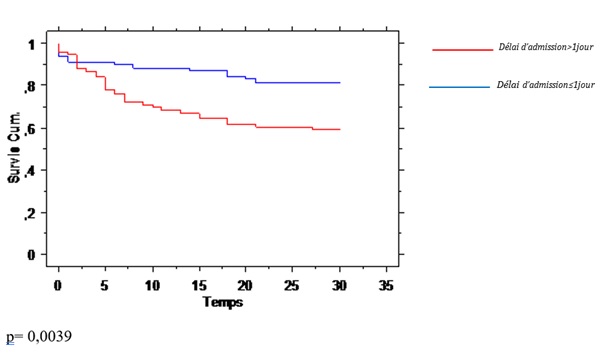
Les courbes de survie ont été réalisées selon la méthode de Kaplan-Meier et comparées entre elles à l’aide de tests de Log-rank. RESULTATS Un total de 154 patients victimes d’AVC ont été inclus (Figure 1). L’âge moyen des patients était de 63,15 ans ± 10,98 avec des extrêmes allant de 38 et 91 ans. La médiane des âges était de 63 ans. Quatre-vingt-douze sujets (60%) étaient de sexe masculin et 62 (40%) de sexe féminin, soit un sex ratio (H/F) de 1,5. Pour 76 sujets (49,35%) la prise en charge était faite avec un délai d’admission à l’hôpital inférieur ou égal à un jour et pour les 78 autres (50,65%) le délai d’admission était supérieur à un jour. La moyenne du délai d’admission des patients pris en charge précocement était de 24 heures et celle du délai d’admission supérieur à un jour était de 4,59 ± 2,33 jours avec une différence statistiquement significative (p< 0,0001). La médiane du délai d’admission des patients pris en charge tardivement était de 4 jours. Sur un total de 153 patients consultés avant l’hospitalisation (un patient présentait des données manquantes et n’a pas été pris en compte sur ce total), 105 patients (68,63%) ont été pris en charge au début de leur maladie par un agent de santé et 48 autres (31,37%) par un tradithérapeute avant l’hospitalisation. Parmi les 105 patients pris en charge par un agent de santé, 68 (61,82%) ont été examinés par un médecin généraliste. Les déterminants préhospitaliers et hospitaliers en fonction du délai d’admission sont présentés dans le tableau I. Le délai de survie était meilleur dans le groupe des patients qui étaient pris en charge précocement (p= 0,0039) (Figure 2). Sur les 46 cas (29,87%) de décès observés dans notre étude, 31 cas (39,74%) étaient pris en charge tardivement versus 15 cas (19,74%) dans l’autre groupe (p= 0,0067). La durée moyenne de survie était de 25 ±11 jours dans le groupe des patients pris en charge dans la journée et de 21 ± 12 jours, dans le groupe des patients pris en charge après un jour. La médiane de survie dans les deux groupes était de 30 jours. DISCUSSION Forces et faiblesses Forces Notre étude était une étude pronostique réalisée sous forme d’une enquête de cohorte de type prospectif. Les cas d’AVC ont été identifiés et inclus selon la définition de l’OMS prenant en compte les cinq signes cliniques dont l’association s’entoure d’une sensibilité proche de 80%. Tous les patients ont été recrutés par un neurologue, ce qui limite les biais de sélection qui seraient dus à une erreur de diagnostic dans un contexte d’absence d’imagerie cérébrale. Notre étude était de type prospectif, facilitant l’enregistrement du maximum des informations attendues. Le recrutement des patients était exhaustif sur une période de six mois et il a été réalisé dans les deux hôpitaux de la ville de Bangui. Faiblesses L’absence d’imagerie cérébrale pouvant confirmer ou éliminer le diagnostic clinique d’AVC et préciser le type d’AVC est évidemment la faiblesse la plus importante. La durée de suivi des patients et la durée de l’étude n’étaient probablement pas suffisamment longues, bien que le nombre de patients ait été calculé et que la différence sur le délai d’admission est significative. Un suivi sur une période d’une année aurait permis une évaluation conséquente du handicap fonctionnel dans le temps. Population d’étude Notre étude a permis d’évaluer la valeur pronostique du délai d’admission des patients victimes d’AVC sur la durée de survie à un mois d’hospitalisation dans les hôpitaux de Bangui. Il ressort de cette étude les caractéristiques sociodémographiques suivantes : l’âge moyen des patients victimes d’AVC était de 63,15 ans avec des extrêmes de 38 et 91 ans ; les hommes étaient les plus représentés dans notre échantillon sans une différence statistiquement significative et le délai moyen d’admission à l’hôpital était de 4,59 ± 2,33 jours. Ces résultats sont superposables à ceux retrouvés dans la littérature. En Afrique subsaharienne, au Congo, l’âge moyen des patients victimes d’AVC était estimé à 62,70 ± 11,20 ans ; le sexe masculin était le plus représenté (58,80%) et la durée moyenne du délai d’admission était de 28,20 ± 3,4h (10). A Dakar au Sénégal, l’âge moyen des patients était de 61,30ans ± 13,80 avec une prédominance plutôt féminine (32). En Mauritanie (5), l’âge moyen retrouvé était de 58 ans avec une prédominance masculine. En Occident : A Genève, l’âge moyen était de 72,4 ans avec une prédominance masculine. Le délai d’admission variait de 1,5 à 6h avec une médiane de 3h 20mn (27). Le délai d’admission variait de 30 min à 10h avec une médiane de 3,5h en France (35). D’une manière générale les données de la littérature ont montré que l’âge était le facteur de risque le plus observé. Le risque d’AVC augmente proportionnellement avec l’âge. Après 55 ans, le risque d’AVC est multiplié par deux après chaque décennie (24). Au New jersey (USA), le délai d’admission variait de 1,5 à 6h (14). A Karachi au Pakistan, l’âge moyen des patients victimes d’AVC était de 60,04 ± 13,98 ans avec une prédominance masculine. Le délai d’admission variait de 3 à 24h avec une médiane 6h (29). Le délai d’admission des patients victimes d’AVC variait selon les études et selon les pays. Ceci s’explique par une meilleure organisation des structures de prise en charge de ces patients avec un plateau technique suffisant, ce qui n’est pas le cas dans beaucoup de pays en développement. Niveau d’étude Les résultats de notre travail avaient montré que le niveau d’instruction était associé de manière statistiquement significative à la survie de nos patients. Plus le niveau d’instruction était élevé plus les patients étaient pris en charge précocement. Les patients avec un niveau primaire et les non-scolarisés représentaient plus de la moitié de la population de notre échantillon (non-scolarisés 42 (27,27%) et niveau primaire 48 (31,17%). Ces résultats sont similaires à ceux de Siddiqui et al., qui ont noté que 62 (37,6%) des patients étaient illettrés contre 44,8% avec un niveau supérieur sur une population de 165 sujets mais sans une différence statistiquement significative (29). Prise en charge préhospitalière et délai d’admission La prise en charge préhospitalière de nos patients était faite dans 68,63% (105 patients) par des agents de santé contre 31,37% (48 patients) par des médecins traditionnels. Les médecins généralistes étaient la catégorie des agents de santé la plus représentée. Nos patients étaient suivis dans les deux hôpitaux de la ville de Bangui : l’hôpital de l’amitié de l’amitié qui dispose de l’unique service de neurologie et l’hôpital communautaire. Sur les 154 patients admis dans notre étude, 29 patients victimes d’AVC (38,16%) étaient hospitalisés et pris en charge à l’hôpital communautaire et 47 patients (61,84%) étaient pris en charge à l’hôpital de l’amitié de Bangui (p=0,3152). On n’a pas observé une différence statistiquement significative au niveau de la prise en charge entre les deux hôpitaux. 76 sujets (49,35%) étaient pris en charge avec un délai d’admission inférieur ou égal à un jour et 78 sujets (50,65%) avec un délai d’admission supérieur à un jour (p<0,0001). Maïga et al., ont remarqué que 90,6% des soignants hospitalisaient les patients dans leurs propres structures, seulement 9,4% adressaient les patients systématiquement à un niveau supérieur de la pyramide sanitaire. Quant à l’itinéraire thérapeutique des patients : 45,6% des praticiens avaient affirmé recevoir régulièrement des malades ayant déjà séjourné chez des tradithérapeutes ; 45,4% avaient déclaré ne recevoir que des patients provenant de structures périphériques ou directement de leurs domiciles (18). Une étude en Afrique du Sud avait étudié la participation des communautés quant à la prise en charge des AVC. Il ressortait de cette étude un déficit important de connaissance des populations sur les AVC (34). Le non référencement systématique des patients dans le service spécialisé (service de neurologie) et le recours à la médecine traditionnelle en première intention par les patients pourraient être responsables en partie du retard de prise en charge des patients victimes des AVC et par conséquent de l’augmentation du taux de mortalité lié à cette maladie. Déterminants en préhospitalier L’HTA et l’antécédent d’un AVC étaient les deux déterminants observés avec une différence statistiquement significative dans les deux groupes. Dans la littérature, l’HTA était connue comme facteur de risque de tous les types d’AVC, avec un risque relatif à 4 dans les infarctus cérébraux (3). Maïga et al., ont observé que l’HTA reste le facteur de risque le mieux connu et était citée comme seul facteur de risque par 61,1% des prescripteurs (18). Diagana et al., ont noté aussi que l’hypertension artérielle (HTA) était le facteur de risque prédominant des accidents ischémiques (56 %) et la principale étiologie des AVC hémorragiques (6). Zenebe et al., ont identifié l’hypertension artérielle comme étant le facteur de risque le plus fréquent des AVC avec 65,6% (36). Raveloson et al., ont retrouvé dans leur étude que 70,59% de leurs patients avaient un antécédent d’HTA dont 29,41% seulement suivaient régulièrement leur traitement. L’antécédent d’AVC était retrouvé dans 11,76% et tous étaient des hypertendus et diabétiques (25). Dans notre échantillon lors de l’analyse en régression logistique, l’HTA n’était pas associée de manière statistiquement significative à la survie, ce qui pourrait être expliqué par une bonne prise en charge d’une HTA sévère chez les patients victimes d’AVC pendant l’hospitalisation et que l’HTA ne serait pas cause de la mortalité. L’HTA reste le facteur de risque le plus fréquent des AVC. L’antécédent d’AVC dans notre étude était l’un des déterminants préhospitaliers le plus fréquemment retrouvé avec une différence statistiquement significative dans les deux groupes. Il était aussi associé de manière statistiquement significative à la survie de nos patients. Dans la littérature, on note que l’antécédent familial de toutes les formes d’AVC est un facteur de risque (9). Dans notre étude le caractère familial de l’antécédent d’AVC n’a pas été recherché. Le diabète, les cardiopathies, la migraine, l’hypercholestérolémie sont des facteurs de risque prouvés des AVC (3,9). Dans notre étude, ces déterminants préhospitaliers ont été comparés dans les deux groupes mais on n’a pas observé une différence significative. Ces antécédents ont été recherchés à l’interrogatoire et la majorité de nos patients avaient un statut (agropastoral 38 soit 24,68% ; ménagère 33 soit 21,43% et sans profession 21 soit 13,64%) qui ne pouvait leur permettre de réaliser un bilan de santé régulier pouvant mettre en évidence ces facteurs de risque. Il n’existe pas à Bangui un système de couverture sanitaire sociale. Déterminants hospitaliers Les troubles de la déglutition, le sepsis et les escarres étaient observés comme les déterminants hospitaliers dans notre échantillon avec une différence statistiquement significative et une tendance pour les pneumopathies d’inhalation. Les troubles de la déglutition étaient observés dans le groupe des patients admis au-delà d’un jour, dans 11 cas (14,47%) et 22 cas (28,21%) dans le groupe des ceux admis le même jour. Nos résultats sont comparables à ceux retrouvés dans la littérature. Les troubles de la déglutition étaient considérés comme une complication largement sous-estimée, des AVC (8). Ils étaient observés dans 29-51% des cas à la phase aiguë (11,19) dans 47% des cas lors d’une étude réalisée dans un service de rééducation, soit entre la deuxième et la troisième semaine après l’AVC et dans 17% dans des cas entre le deuxième et le quatrième mois post-AVC. Smithard et al., (30) ont trouvé une association significative dans une étude évaluant le risque d’infection pulmonaire en cas de troubles de déglutition au cours de la première semaine suivant l’infarctus cérébral (33% versus 16% ; p = 0,05). Notons que Hilker et al., ont remarqué que les pneumopathies d’inhalation multipliaient le taux de mortalité par trois (12). Par ailleurs, il a été rapporté que ces types de pneumopathies étaient à l’origine d’un quart de décès dans le premier mois après un AVC (33). Handicap fonctionnel évalué à un mois Le handicap fonctionnel évalué à un mois par l’échelle de Rankin modifiée dans note série était plus sévère aussi bien chez les patients pris en charge précocement (29 patients soit 78,33%), que chez ceux qui ont été pris en charge au-delà d’un jour (31 patients soit 68,89%) avec une prédominance dans le premier groupe et une différence statistiquement significative. Dans une étude réalisée à Parakou au Bénin en milieu hospitalier sur 61 patients vivants à la sortie, 37 (55,7%) étaient indépendants (RANKIN≤ 2) avec une durée d’hospitalisation allant 2 à 76 jours et une moyenne de 14,4 jours ± 10,1 jours (1). A Dakar, il a été noté après un suivi mensuel sur 12 mois, que 58,3% des patients sur 84 survivants, étaient devenus autonomes avec un index de Barthel supérieur à 60 points (28). L’index de Barthel permettait d’évaluer les aptitudes fonctionnelles des patients sur un score de 0 à 100. Un score inférieur à 60 points pouvait témoigner soit d’une dépendance totale (0 à 20) soit d’une dépendance sévère (21 à 60) avec une perte de déambulation et d’autonomie partielle pour la toilette et l’habillage (17). L’insuffisance des ressources humaines et matérielles en matière de rééducation fonctionnelle en République Centrafricaine en général et dans les deux hôpitaux de Bangui en particulier, expliqueraient en partie les difficultés dans la meilleure prise en charge et l’évaluation de l’incapacité fonctionnelle de nos patients. Survie Sur les 46 cas (29,87%) de décès observés dans notre série, 31 cas (39,74%) étaient pris en charge tardivement versus 15 cas (19,74%) dans l’autre groupe (p= 0,0067). La durée moyenne de survie était de 25 ±11 jours dans le groupe des patients pris en charge dans la journée et de 21 ± 12 jours dans le groupe des patients pris en charge après un jour Le délai de survie était meilleur dans le groupe des patients pris en charge précocement (p= 0,0039). Nos résultats sont comparables à ceux retrouvés dans la littérature (13,24,26,32). Ainsi, le taux élevé de létalité hospitalière par AVC reflète la gravité de la maladie.
Tableau I : Caractéristiques générales des patients en fonction du délai d’admission
NEUROCOGNITIVE IMPAIRMENT IN AGING PEOPLE LIVING WITH HIV; A COMPARATIVE STUDY OF ELDERLY PATIENTS ATTENDING THE UNIVERSITY COLLEGE HOSPITAL IBADAN, NIGERIA. INTRODUCTION People Living with HIV(PLWH) have increased longevity and are ageing with HIV since the advent of combined Highly Active Antiretroviral (HAARTs) (1). HIV-infection in ageing PLWH coexists as a chronic disease and moderates the morbidity pattern. Globally and most especially in Africa, researches on HIV and ageing are not robust despite the growing concerns (2). It was reported at the end of 2012, that 10% of the adults PLWH, in Lower and Middle-Income Countries (LMICs) were aged 50 years or older and they experience a higher burden of diseases (3). Likewise, it had been projected that in Africa, HIV-infected patients aged 50 and over, will triple by the year 2040 due to “greying of HIV epidemic” (1,2,4). Therefore, there is an expedient need to bridge the research gap on ageing PLWH (1,2,4). Cognitive impairment is an expectation of the ageing modern society due to many risk factors. HIV is known to exacerbate age-associated cognitive impairment, with ageing PLWH having cognitive decline akin to that of much older non-HIV infected adults (4). HIV reproduces in the brain microglia with resultant central nervous system inflammation which causes a spectrum of progressive cognitive impairments referred to as HIV Associated Neurocognitive disorders (HANDs) (5). HANDs ranges from Asymptomatic Neurocognitive Impairment (ANI) through Mild Cognitive Impairment(MCI) to dementia (5). Advancing age, age-associated chronic diseases and HIV- related morbidities and infections like Hepatitis B and Hepatitis C, are common risk factors to neurocognitive impairment in ageing PLWH, hence the concern for cognitive impairment in PLWH (5). Mild neurocognitive disorder occurs in the early stages of HIV and the symptoms are usually subtle and elusive (5,6). Unrecognized or untreated, neurocognitive impairments in PLWH may eventually progress to dementia at a later stage, with memory and executive function problems (5–8). Dementia, the extreme of neurocognitive impairment, is projected to quadruple by 2050 worldwide, with a higher burden in Low and Middle-Income Countries (LMICs) especially due to “triple-burden-of-diseases” (5–7). Triple burden of diseases, in LMICs, explains the phenomenon where, the high burden of poverty, is superimposed on the double burden of communicable and non-communicable diseases (9,10). People living and ageing with HIV are prone to early onset MCI and dementia by virtue of their clinical condition. This risk is heightened in middle income country like Nigeria where neurocognitive assessment of PLWH is not a routine despite the tendency for triple burden of disease in PLWH. This study aimed to evaluate age-associated cognitive impairment in ageing PLWH in contrast to age-matched HIV-uninfected older adults. METHODS Study design: This was a cross-sectional survey of 186 persons aged 60 years and above. The participants were selected, using ratio 1:2, 64 HIV-positive and 124 HIV-negative patients were recruited in April-June 2018. Study population: The HIV-positive participants were recruited from the APIN (AIDs Preventive Initiative of Nigeria) clinic of the Infectious Disease Institute of the College of Medicine, University of Ibadan Nigeria. The HIV-negative participants were selected from the Chief Tony Aneni Geriatric Center (CTAC) of the University College Hospital, Ibadan Nigeria. Sampling: Consecutive consenting eligible patients encountered at the APIN and geriatric clinics were selected to participate in the study. For every selected person living with HIV, 2 (two) patients of the geriatric center were selected after matching for age at ± 5 years. The presumed HIV-negative participants selected from the geriatric center of the University College Hospital (UCH) Ibadan had Voluntary Counselling and Testing (VCT) for HIV, after which they are recruited on confirmation of negative HIV-screening test results. Study tools: Cognitive assessment of each participant was conducted using the Montreal Cognitive Assessment (MoCA) questionnaire and the Trail Making Test (TMT) A and B (11). The Montreal Cognitive Assessment examination (MoCA) is a valid and reliable screening test for early cognitive impairment in older adults, as it evaluates multiple cognitive domains in one sitting even in absence of obvious physical and behavioural abnormality (5,11). The MoCA is a 30-point screening tool that can be administered within 10 minutes, to ages 49 years to ≥ 85 years and it evaluates aspects of attention, orientation, language, verbal memory, visuospatial, and executive function (11). The MoCA scores for all participants was adjusted for education using a one-point correction for participants with less than 12 years of formal education (11,12). There are a published MoCA score cutoffs, with a score of < 26 points taken as cognitive impairment (11,12). Specifically, the MoCA score range of 19-25.2 is taken as Mild Cognitive Impairment (MCI) and the score range of 11.4-21 is taken as dementia (11,13,14). However, due to the known differences in MoCA scores by ethnic groups, the mean and S.D scores of the study population was utilized for classifying patients in the study. Mild Cognitive impairment (MCI) for this study was defined by MoCA score of +1 SD below the mean, and MoCA score of +2 S.D below the mean was used to define dementia, as previously validated (11,13,14). The Trail Making Test (TMT) A and B, are known to readily identify cognitive impairment in persons 15-89 years of age, as it measures attention, speed, mental flexibility, visuospatial organization, sequencing, abstraction, recall, recognition and task shifting (15,16). People, especially older adults with a cognitive deficit lacks mental flexibility and often have difficulty in performing timed and repetitive activities (5,6). The Trail Making Test is sensitive and useful in assessing cognitive impairment and has high predictive power, although the specificity has been debated (15,16). The Trail Making Test -B specifically measures the cognitive domain of executive functioning with the ability to maintain two trains of thoughts, modify an action plan, psychomotor speed and cognitive flexibility (15,16). Both components of Trail Making Test are timed and the score represents the amount of time an individual completes each of the tasks (15,16). The expected time for cognitively competent individual averages 29 seconds for trail A and 75 seconds for trail B, trail completion time above 90 seconds and 3 minutes respectively for trail A and B, signifies cognitive impairment (17,18). Trail Making Test, has also been found to be effective in the identification of mild neurocognitive disorder and HIV associated Dementia with a sensitivity of 86 % and specificity of 79 % when combined with other neuropsychometry tools (15–18). The raw completion time scores of Trail Making Test was utilized in this study, with higher TMT completion time (scores) interpreted as worse cognitive assessments. Information on sociodemography, clinical and laboratory parameters were obtained from the participants and their medical records. The socio-economic classification was done using the Wealth Index questionnaire. Relevant records of HIV-management including viral titer and CD4-counts were obtained from APIN medical records. Data management: Collected data were analyzed with the Statistical Package for Social Sciences (SPSS) version 23 using Chi-square test, T-test, correlation analysis and logistic regression. RESULTS Ageing people living with HIV, in contrast to the HIV-uninfected cohort had lower mean age (63.5yrs; p=0.000) and poorer cognitive ability [lower MoCA-scores (p=0.000) and longer TMT A & B completion-time (p=0.001 & 0.006)] (Table 1). There was female preponderance in both groups and more of the ageing PLWH were widowed (p=0.051), had lower education attainment (p=0.000) and more chronic Non-Communicable Diseases (NCDs) (p=0.000). The ageing PLWH had lower mean BMI despite which they had higher markers of cardiovascular and metabolic disorder [i.e. higher Systolic Blood Pressure (SBP) and Fasting Blood Sugar (FBS)]. Using the validated mean MoCA scores with the S.D variations, 71% (44) of the ageing PLWH, had cognitive impairment, of which 51.6% (32) had MoCA scores indicating Mild Cognitive Impairment (MCI) and 19.4% (12) had scores in keeping with dementia. The female PLWH had lower MoCA score compared to the males (19.4 vs 21.9, p=0.045, t=2.046). The average duration of HIV-infection was 8.79 (±3.52) years at a range of 1-14 years, mode of 13 years and median of 9 years. The cognitively impaired ageing PLWH had lower MoCA scores, especially for the visuospatial functioning which correlates negatively with the TMT completion time (TMT A; rs-0.358, p-0.004 and TMT B; rs-0.208, p-0.104). The cognitively impaired PLWH were younger, had fewer years of HIV 1-infection, higher viral titer and poorer compliance with Highly Active Antiretroviral (HAARTs) prescriptions. (Table 2). In contrast to the cognitively unimpaired PLWH, the cognitively impaired ageing PLWH had a higher burden of chronic NCDs and socioeconomic disadvantages. Additionally, all (100%) the ageing PLWH with Hepatitis B (2.2% prevalence) or C (3.2% prevalence) were cognitively impaired. Table 3 shows the result of logistic regression (Chi sq-24.137, df=11, p=0.019) at 75.8% overall prediction with 81.1% correct prediction for cognitive impairment. The prediction for cognitive impairment among ageing PLWH, revealed that the duration of HIV-infection (wald=4.588 p=0.032), HAARTs-compliance (wald=4.255, p=0.039), type-1 HIV infection (wald=3.636 p=0.057) and viral titers (wald=3.138, p=0.076) are important risk factors. Table 4 showed results of multivariate analysis (R=0.449; R squared=0.201; adjusted R squared =0.114; F=2.310, p=0.046) of predictors of cognitive impairment. The analysis revealed that an increase in the age and duration of HIV-infection can decrease MoCA scores (decrease MoCA scores=poorer cognition) by 2.0% and 8.9% respectively. Likewise, an increase in the number of chronic Non-Communicable Diseases (NCDs) and HIV viral titer can decrease MoCA scores by 53.4% and 16.1% respectively. However, an increase in the percentage HAART-compliance and CD4-count can increase MoCA scores (increased MoCA scores=better cognition), by 10.5% and 0.7% respectively. DISCUSSIONS HIV-infection is a common cause of preventable Neurocognitive-Impairment (NCI) and young- onset dementia (dementia under 65years), which readily occurs, as a comorbidity in ageing PLWH (11,13,14). This is evident in this study, where the ageing PLWH at a mean age of 63.5years significantly had poorer cognitive measures in contrast to the HIV-uninfected counterpart at mean age 68.5years. The prevalence of HAND in Sub-Saharan Africa (SSA) varies widely between 17% to 88%, depending on the nomenclature used (11,13,14). This study revealed a 71% prevalence of cognitive impairment among the ageing PLWH with 51.6% prevalence of Mild Cognitive Impairment (MCI) and 19.4% prevalence of dementia. In tandem with this study, it was reported that the prevalence of MCI and dementia in ageing PLWH may be as high as 60% and 29% respectively (5). It was also theorized that mild neurocognitive impairment does not necessarily progress to dementia but a longitudinal cohort study reported progressively severe cognitive impairment in PLWH despite viral suppression and immune reconstitution, as can be inferred from the results of this study (5,20). HIV associated dementia (HAD) was commoner in the pre HAART era, while MCI is commoner since the advent of combined HAART, but it has been said that the longer people live with HIV infection, the more the possibility of an increase in dementia prevalence (21). The aforementioned can be drawn from the results of this study. Neurocognitive impairment is commonly associated with HIV-1 infection, and it is one of the most feared complications in ageing PLWH, due to the chronic immune activation driven by viral titer and central nervous system (CNS) viral infection (6). This study revealed that many of the cognitively impaired ageing PLWH had HIV-1 infection with significantly higher plasma viral titer, and both are important predictors of neurocognitive impairment. It is known that in PLWH, the brain act as a sanctuary site for the latent slowly replicating virus (6). HIV-1 infection induces neurodegeneration due to deposition of amyloid and precursor protein such as the toxic viral products called tat protein, in the brain, which produces changes similar to that seen in Alzheimer’s disease (6,7). There is a postulation that neurocognitive impairment in ageing PLWH results from HIV-induced aggravated immunosenescence which accelerates the premature expression of dementia (7). These can explain the reason why the ageing PLWH in this study had worse cognitive measures despite being significantly younger than the HIV-negative cohort. However, the exact mechanism by which HIV-1 provoke neuronal injury and death is controversial but there is evidence of multiple risk factors and mechanisms contributing to neurocognitive impairment in PLWH (7,21). Aside from the synergistic effect of age-related and direct HIV-related immunosenescence in PLWH, there are other indirectly related factors, which facilitate the early presentation of neurocognitive impairment (6,7). For instance in this study, compared to the HIV-negative elderly, anemia, a higher burden of chronic NCDs and metabolic markers (elevate blood pressure and sugar) of cardiovascular disease, supports premature pathogenesis of neurocognitive impairment in ageing PLWH (6,7). The cognitively impaired ageing-PLWH in this study were of lower mean age compared to the cognitively unimpaired ones, which is in agreement with the fact that HIV and ageing are independent risk factors for cognitive impairment (22). HIV infection is known to accentuate brain ageing as found in a study that reported a higher predicted brain age relative to chronological age in PLWH (22). Likewise, although the cognitively impaired ageing PLWH were younger than the unimpaired PLWH, they had higher risk factors for a metabolic disorder which had been linked to earlier and poorer cognitive function in ageing PLWH (23). Additionally, it is important to note that in this study, an increase in the age of older PLWH significantly increase the cognitive impairment, as previously published (6,7). There was female preponderance in this study and the females in the HIV-infected cohort significantly had poorer cognitive scores, in keeping with the fact that the female gender is a risk factor for HAND, especially for dementia (5,24).Majority of the cognitively impaired PLWH were of lower social status, suggesting the possibility of the inherent poverty, malnutrition and limited access to health care may underscore the poorer cognitive ability, observed (1). It can be deduced that among people of lower social status malnutrition supports anemia, a higher level of percentage total body fat, visceral fat and dyslipidemia as observed in the cognitively impaired ageing PLWH in this study (1). The association of “triple burden of disease’’ with neurocognitive impairment is evident in this study because aside socioeconomic disadvantage and a higher burden of chronic NCDs, all ageing PLWH with Hepatitis B and Hepatitis C were cognitively impaired (7). Majority of the cognitively impaired PLWH in this study were on first-line HAART. A study compared neurocognitive impairment between the pre-HAART and post-HAART era, and found out that NCI was associated with being on HAART only in the HAART era (8). This raises the question of whether some of the newer ARV medications may have toxic effects on the CNS (8). The first line group of HAART are very effective, well-tolerated and therefore preferred, but some of them are neurotoxic. Ritonavir, Zidovudine and Etravirine which are components of the cART prescribed for this studied PLWH has been linked to neurotoxicity and consequent NCI (21). Likewise, Efavirenz and Nevirapine are neurotoxic, particularly Efavirenz which have been linked to neurocognitive impairment (21). Additionally, it was reported that some neurotoxic HAART can increase the production of brain lymphocytes that can cause cognitive disorder (5). There were higher levels of triglyceride, percentage total body fat and visceral fat in the cognitively impaired ageing PLWH compared to the cognitively unimpaired PLWH. It has been documented that adipose tissues alteration (ATA) is common with the use of HAART especially with first-line HAART (24). Dyslipidemia and adipose tissue alteration in ageing PLWH can aid the pathogenesis of neurocognitive impairment, as can be inferred from the results of this study (1,24). Abdominal or visceral fat accumulation is the predominant type of adipose tissues alteration which worsens with a longer duration on HAART, as the person living with HIV ages (1,24). This study showed a significant difference in visceral fat between the PLWH, with higher levels in the cognitively impaired PLWH. Adipose tissues alteration starts around two years of HAART initiation and increases as PLWH age and increases the risk of cognitive impairment (24). This could be the reason the cognitively impaired PLWH in this study, at fewer years of HIV-infection, had cognitive impairment due to higher fat deposition enhanced by 1st-line HAART (1,24). Adipose tissues alteration invokes metabolic alteration which expedites cognitive impairment, which is exponential in the presence of Hepatitis infection and this may be another explanation for the observation of cognitive impairment in all PLWH who had hepatitis coinfection (1,24). Stavudine, one of the commonly used HAART among the studied ageing PLWH, has been linked to increased risk of ATA and indirectly can contribute to the development cognitive impairment (24). Chronic non-communicable conditions were important comorbidity and predictor of neurocognitive impairment among PLWH in this study. In sub-Saharan Africa, chronic non-communicable conditions are prevalent in ageing PLWH compared to non-HIV infected counterpart as demonstrated in this study (23). Additionally, this study revealed that cognitive impairment in ageing PLWH was significantly associated with a higher burden of the risk factors for chronic non-communicable diseases (NCDs). These, included elevated systolic blood pressure (SBP), elevated blood glucose, dyslipidemia and elevated body fat. In accordance, studies have reported that chronic NCDs and these multiple risk factors for chronic non-communicable diseases are covariates of cognitive impairment in PLWH (7,11,25). A study reported that cardiovascular disease markers like elevated blood pressure and elevated blood sugar, are more strongly associated with neurocognitive impairment in ageing PLWH compared to HIV-disease markers like current viral load and CD4 counts (7). This study showed evidence of this, where the effect of chronic NCDs on neurocognitive impairment supersede that of HIV-disease markers. Likewise, chronic NCDs, high body fat and dyslipidemia as found among cognitively impaired PLWH in this study, are documented modifiable risk factors for NCI in PLWH (7,11,25). Low levels of CD4 count are known risk factor for neurocognitive impairment in ageing PLWH (4). A lower current CD4 count was associated with NCI in ageing PLWH in this study, and it has been debated whether nadir rather than current CD4 tracks better with neurocognitive impairment in PLWH and many controversies abound (26). The association between CD4-count and NCI in this study was weak. A plausible explanation is that regardless of good immune recovery on combined HAART other risk factors contributes to the occurrence of HANDs ageing PLWH (26). Likewise, high rates of neurocognitive impairment are known to persist at all stages of HIV-infection in PLWH, especially in the presence of other risk factors regardless of immune recovery (8). Poorer HAART compliance and use of neurotoxic HAART are HIV-related factors while dyslipidemia, anaemia and impaired blood sugar are non-HIV related factors, as shown from this results of this study and confirmed by other researches (1,8,24). Lower education attainment, seen in the setting of lower social status as found more prevalent, amongst the PLWH in this study is a sociodemographic factor that can support the development of NCI regardless of CD4 counts (8). A study reported a 20% prevalence of hepatitis co-infection among PWLH and this usually occurs at lower CD4-count (4). Regardless of immune recovery and current CD4-count, hepatitis coinfection persists and contributes to the development of neurocognitive impairment in ageing PLWH. Although in this study the prevalence of hepatitis B and C was minimal, all ageing PLWH with hepatitis co-infection had cognitive impairment at not too low CD4 count. The cognitively impaired ageing PLWH had lower percentage HAART compliance and increase in HAART compliance in this study is associated with better cognition function. There were higher incidence and prevalence of HAND in the pre and early HAART era (8). However, HAND prevails mostly in developing countries especially in ageing PLWH, in the presence of poor HAART compliance and other risk factors like anemia and lower social status, as discovered in this study (5). Long-term use of HAART is said to have an undetermined effect on the course of HIV associated dementia, however, HAART compliance has been proven to delay the course of HAND (5). Viral titers were significantly higher in cognitively impaired PLWH in this study, although not a significant predictor like HAART compliance. This is in tandem with the report that HAND is known to be associated with higher viral titer which can occur in PLWH with reduced HAART adherence (26). STRENGTH, LIMITATION AND RECOMMENDATION This study provides current information on ageing PLWH and attempts to bridge some research gap on neurocognitive impairment in people living and ageing with HIV in Nigeria. However, the cross-sectional nature limits stronger inferences on the associations between neurocognitive impairment and HIV related factors in ageing PLWH. It can be recommended that a longitudinal cohort studies between HIV and non HIV infected older adult be conducted to establish stronger causalities of earlier neurocognitive impairment and dementia in HIV infected older adults. CONCLUSION This study showed that ageing PLWH are at risk of developing neurocognitive impairment due to HIV-related factors and non-HIV factors engendered by HIV induced aggravated immunosenescence. Routine evaluation of cognitive function can facilitate early detection of mild neurocognitive impairment, which is more manageable than burdensome dementia. The cognitively impaired ageing PLWH were females of lower social status with type 1 HIV and were significantly younger with shorter duration of HIV infection, higher viral titer and had more risk factors for metabolic syndrome and chronic NCDs. These may be the factors to consider in the evaluation and management of HAND in ageing PLWH. The importance of delaying the onset or modifying the progress of neurocognitive impairment in ageing PLWH cannot be overemphasized. Therefore, there is a need to actively monitor and reduce the risk of neurocognitive impairment in ageing PLWH.
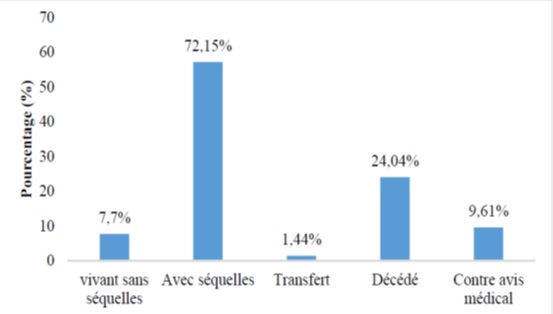
Table 1: Characteristics of study participants N=186
Table 2: Covariates of cognitive impairment in Ageing People Living with HIV (N=62)
Hemoglobin concentration; Hb (g/dl) = (PCV÷ 3) (%) +(MoCA score correlates positively with CD4 count and negatively with Viral Load)
Table 3 : Predictors of Cognitive impairment in ageing PLWH
*cART-Combined Antiretroviral
Table 4; Multivariate analysis of predictors of cognitive impairment (MoCA scores) in ageing PLWH
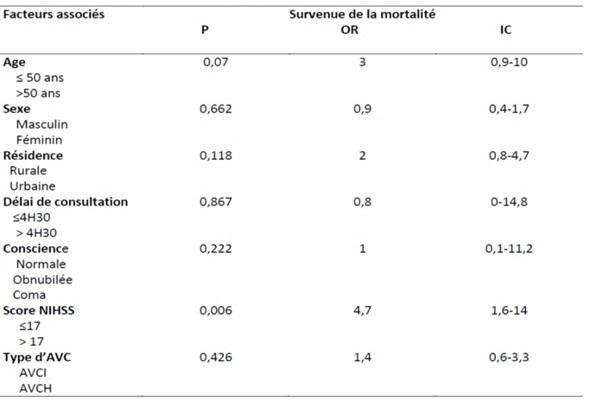
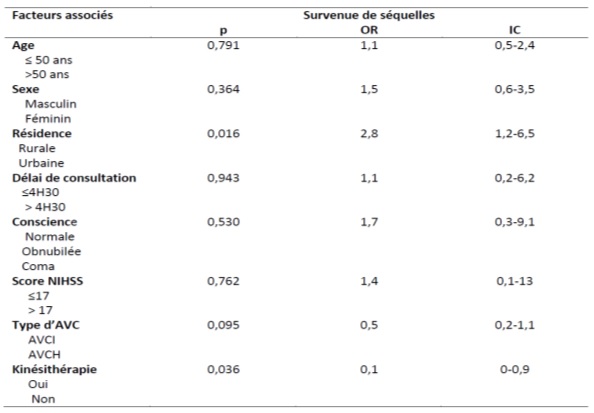
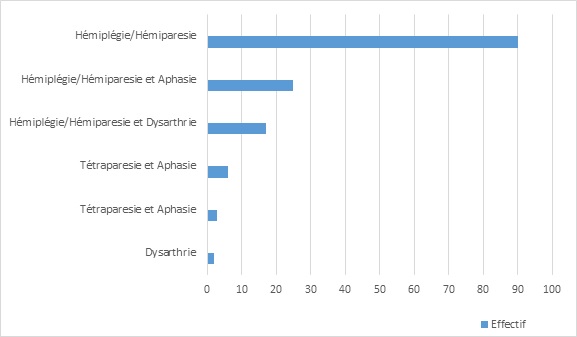
INTRODUCTION Les accidents vasculaires cérébraux constituent un véritable problème de santé publique dans le monde. Selon l’OMS les pays à revenu faible et moyen sont les plus touchés avec 80% des cas (17). Ce constat est d’autant plus accablant que les projections à l’horizon 2030 augurent d’une persistance de la situation (17,23). On estime qu’une personne est touchée par un AVC toutes les cinq secondes dans le monde (23) et la mortalité qui en résulte est élevée car il constitue la seconde cause de mortalité après les maladies coronariennes (17,20). Les maladies cardiovasculaires représentent la première cause de décès dans le monde soit près de 17,7 millions par an (17). Les AVC constituent également la première cause de handicap non traumatique dans le monde. Une étude Australienne retrouvait un handicap modéré chez 56% des patients victimes d’accident vasculaire cérébral ischémique. Ce handicap était sévère chez 42% et très sévère chez 2% des patients selon la même étude (12). La mortalité liée aux AVC est élevée aux Etats-Unis et on estime qu’en moyenne toutes les 3 minutes 35 secondes, une personne décède des suites d’un AVC (2). En France, l’AVC est la première cause de handicap acquis de l’adulte, la deuxième cause de démence après la maladie d’Alzheimer et la 3ème cause de mortalité après les accidents coronariens et les cancers (8,10). En Afrique du nord et au Moyen-Orient, la mortalité due aux AVC doublera pratiquement en 2030 selon les prévisions (25). En Afrique subsaharienne, les AVC constituent la première cause d’incapacité motrice dans les grands centres de neurologie (4). Au Burkina Faso, plusieurs études ont été menées sur les AVC. Au Centre Hospitalier Universitaire Sourô Sanou (CHUSS) de Bobo-Dioulasso la mortalité hospitalière était importante (31,6%), frappant davantage les personnes âgées et les femmes en 1997 (26). Une étude plus récente au CHUSS de Bobo-Dioulasso en 2015 retrouvait une mortalité de 28,21% parmi les cas confirmés d’AVC (18). Malgré l’ampleur du problème, peu d’études à collecte de données prospectives sont disponibles dans notre contexte. L’objectif de cette étude était d’analyser les facteurs liés au pronostic vital et fonctionnel des patients hospitalisés pour AVC au CHUSS de Bobo-Dioulasso. METHODOLOGIE Il s’est agi d’une cohorte prospective réalisée au CHUSS de Bobo-Dioulasso, l’hôpital de référence de la région ouest du Burkina Faso dont la capacité est de 550 lits répartis dans six départements. Notre étude a porté sur les patients admis pour AVC dans les services de neurologie et aux urgences et couvrant la période de janvier à octobre 2016 et ayant accepté de participer à l’étude. Les cas d’hémorragies sous-arachnoïdiennes et les cas de thromboses veineuses cérébrales n’ont pas été inclus. Chaque malade identifié a été interrogé, puis examiné de façon complète à l’entrée puis 14 jours après l’AVC et les examens paracliniques nécessaires ont été demandés. Il a été établi une fiche d’enquête afin de collecter les informations suivantes : variables sociodémographiques ; facteurs de risque; motifs d’hospitalisation ; délai de consultation ; paramètres vitaux ; données de l’examen physique en évaluant l’état de conscience avec le score de Glasgow (catégorisé en normal si score 14—15/15 et anormal si score ≤ 13/15) et le score de NIHSS ; délai de rééducation motrice ; résultats des examens paracliniques réalisés (glycémie, scanner cérébral, bilan lipidique); résultats du scanner; type de prise en charge; durée d’hospitalisation ; pronostic fonctionnel et vital. Les données qualitatives ont été exprimées en pourcentage (%) et les variables quantitatives en moyenne ± écart-type. Les données ont été saisies sur Epi data dans sa version 3.1. L’analyse a été faite à l’aide de la version 13.0 du logiciel Stata. Les paramètres de statistique descriptive usuels ont été estimés pour chaque variable. Les tests de comparaison ont été faits après vérification de leurs critères de validité, en considérant un seuil de signification statistique de p<0,05; le test du Chi-deux de Pearson pour la comparaison des proportions et le test t de Student pour la comparaison des moyennes. L’odds-ratio (OR) a été calculé avec un intervalle de confiance (IC) de 95 %. Les données ont été recueillies après avoir obtenu les consentements éclairés des patients et /ou de leurs accompagnants. La confidentialité des informations recueillies a été respectée vue que l’étude a été menée par des personnes tenues au secret médical. L’anonymat des malades a été préservé, les fiches de report de cas ne comportant pas leurs identités. Seuls étaient mentionnés les numéros de dossiers. RESULTATS Nous avons inclus 208 patients avec 64,42% d’AVCI et 35,58% d’AVCH. Dans notre population d’étude, l’âge moyen était de 59,51 ans ± 14,49 ans avec des extrêmes de 20 ans et 95 ans. La prédominance était masculine avec 121 patients soit 58,17% de la population d’étude dont le sex-ratio était de 1,39. La résidence urbaine était retrouvée chez 56,25% de nos patients. Dans notre étude, les patients non scolarisés représentaient les deux tiers. Les principaux facteurs de risque cérébro-vasculaire étaient l’HTA chronique (64,29%), la consommation d’alcool (39,9%), l’antécédent d’AVC (13,57%), les fausses couches à répétition (5,71), le diabète (5%), l’antécédent de cardiopathie (3,57%), la prise de contraceptif oral (2,14%) et la drépanocytose (2,14%). Le délai moyen entre la survenue de l’AVC et la consultation était de 41,19 heures ± 43,1 heures (42,54%) avec des extrêmes allant d’une heure et 192 heures. Seulement 35 patients soit 16,83% ont consulté avant 4 heures 30 minutes. Le déficit moteur représentait 47,11% des motifs d’hospitalisation. Les troubles de la conscience étaient notés chez 37,99% des AVC dont 9,13% de cas de coma. Le score de NIHSS était supérieur à 17 chez 58 patients. La rééducation motrice a débuté en moyenne au bout de 7 jours et a concerné 29,67% des patients. La mortalité intra hospitalière était de 24,04% pour une durée d’hospitalisation de 14, 6 jours en moyenne avec des extrêmes de un jour et 65 jours. Dans cette étude, 72,15 % des patients sont sortis de l’hôpital avec des séquelles (Figure1). Il s’agissait surtout des troubles moteurs et du langage (Figure 2). Un score de NIHSS supérieur à 17 était un facteur associé au décès dans notre étude (p=0,006; OR= 4,7 ; IC95%:1,6-14). Par contre, l’âge, le sexe, le type d’AVC, les troubles de la conscience, le délai de consultation n’avaient pas de lien statistiquement significatif avec la survenue du décès (Tableau1). La résidence urbaine était un facteur associé à une meilleure récupération fonctionnelle dans notre étude (p=0,016; OR= 2,8 ; IC95%:1,2-6,5). Aussi, la kinésithérapie en hospitalisation était aussi associée à une meilleure récupération fonctionnelle (p=0,036; OR= 0,1 ; IC95%: 0-0,9). Par contre, l’âge, le sexe, le type d’AVC, les troubles de la conscience, le délai de consultation et le score de NIHSS n’avaient pas de lien statistiquement significatif avec le pronostic fonctionnel (Tableau II). DISCUSSION Nous présentons ici une étude prospective et hospitalière rapportant des données sur le pronostic vital et fonctionnel des accidents vasculaires cérébraux ischémiques et hémorragiques. Ces données ne sont cependant pas représentatives de tous les accidents vasculaires cérébraux survenant dans la région. Cette étude a permis de trouver une létalité de 24,04% pour une durée d’hospitalisation moyenne de14, 6 jours. Ce taux de mortalité est très élevé contrairement à celui observé dans les pays développés. La mortalité à court terme (7 premiers jours) en milieu hospitalier varie de 3,3% au Danemark à 6,9% au Canada (3,22). En Iran, on a retrouvé une mortalité hospitalière élevée à 20,5% (9). Nos résultats étaient comparables à ceux retrouvé au Benin (29%) (1) ainsi qu’au Cameroun (26,7 et 26.8%) (14,16). Au Sénégal, Touré et al (24) ont retrouvé une mortalité de 24,8%. Ce taux très élevé de mortalité témoigne du faible plateau technique de nos hôpitaux et l’absence d’unité neuro-vasculaire. Dans notre étude, le score de NIHSS supérieur à 17 était statistiquement lié au pronostic vital de façon significative. Ce résultat a été partagé par d’autres auteurs. Ainsi, Frankel et al (11) avaient noté que les patients avec un score de NIHSS élevé avaient un mauvais pronostic, et Ossou-Nguiet et al (19) avaient montré que le score de NIHSS avait un lien statistiquement significatif avec le pronostic vital (p < 0,0001). Lompo et al (15) avaient montré qu’un score NIHSS ≥ 17 à l’admission (OR : 4,167 ; IC95 % 1,160—9,467 ; p = 0,001) était un facteur de risque indépendant de mortalité intrahospitalière. L’âge est souvent indexé comme étant l’un des principaux facteurs associés au décès après un AVC. Dans notre série, l’âge, le sexe, ou le type d’AVC, les troubles de la conscience, le délai de consultation n’étaient pas associé au décès. Cependant dans une étude rétrospective précédente, les facteurs associés à la mortalité étaient l’âge (p=0,001; OR 2,4 ; IC95%1,4-4,1), le coma (p<0,001; OR= 3,8 ; IC95% :1,8-8,1), le type d’AVC (p=0,007; OR= 2,0 ; IC95% :1,2-3,3) et le recours aux mesures de réanimation (p <0,001; OR= 3,5 ; IC95% :1,6-7,8) (18). Les séquelles post-AVC ont un large spectre. Elles peuvent être physiques (troubles moteurs, sensitifs ou du langage), psycho-intellectuels (trouble cognitif, dépression), fonctionnels (limitation des activités) ou socio-professionnels (conduite, perte d’emploi, difficultés familiales) (13). Dans notre étude, 72,15 % des patients avaient des séquelles neurologiques à leur sortie. Ces résultats étaient identiques à ceux de Charfi et al (5). Mais notre étude ne montrait pas de lien statistiquement significatif entre le type d’AVC et le pronostic fonctionnel. Coulibaly et al (6) dans leur étude, ne trouvaient pas de lien entre le pronostic fonctionnel et le type d’AVC (p=0,751). Cependant, Sene Diouf et al (22) notaient que les AVCH avaient une meilleure récupération fonctionnelle que les AVCI (p <0,05). La kinésithérapie précoce joue un rôle très important car elle améliore le devenir fonctionnel des cas d’AVC avec incapacité motrice. Une étude réalisée en Côte d’Ivoire démontrait qu’aucun patient n’avait bénéficié de rééducation précoce pendant l’hospitalisation initiale (7). Dans notre étude, seulement 29,67% des patients ont bénéficié d’une rééducation physique au cours de leur hospitalisation. La kinésithérapie en hospitalisation et la résidence urbaine étaient les facteurs associés au pronostic fonctionnel dans notre étude. Cela est dû au fait que les principaux centres de rééducation n’existent que dans les grandes villes ainsi qu’à l’absence de kinésithérapeutes dans le service de neurologie. Aussi, dans notre région, il y a une insuffisance en ressources humaines qualifiées pour la rééducation (un seul médecin spécialiste en médecine physique et de réadaptation et pas d’orthophoniste). La mise en place d’unités de rééducation dans les services de neurologie permettra d’améliorer l’accessibilité des patients à une kinésithérapie précoce. Cependant, le score de NIHSS n’était pas associé au pronostic fonctionnel dans notre étude. Cela pourrait s’expliquer par le fait que la plupart des patients qui avait un score de NIHSS élevé était décédée. CONCLUSION Le pronostic des AVC demeure réservé dans notre contexte. Cette morbi-mortalité élevée justifie que des mesures adéquates soient prises pour améliorer la qualité de la prise en charge des patients. La mise en place d’une kinésithérapie précoce permettra d’améliorer la récupération fonctionnelle. Cependant, la lutte contre les facteurs de risque cardiovasculaires reste de mise pour réduire l’incidence de cette affection dans notre pays.
Tableau I: Facteurs associés à la survenue du décès.
Tableau II: Facteurs associés à la survenue de séquelles neurologiques.
FIGURES
PREVENTION DU SPINA BIFIDA : CONNAISSANCES, ATTITUDES ET PRATIQUES DES SAGES-FEMMES ET ACCOUCHEUSES AUXILIAIRES D’ETAT DANS LE DISTRICT SANITAIRE DE LA KOZAH (TOGO). INTRODUCTION Le spina bifida est une anomalie de fermeture du tube neural. Les anomalies de fermeture du tube neural (AFTN) sont responsables de « handicaps à la naissance souvent irréversibles » voire de décès. Ce sont des malformations congénitales sévères de développement du système nerveux. Le tube neural est à l’origine de l’encéphale et de la moelle épinière. Il se ferme lors de la 4e semaine de développement embryonnaire. Un défaut lors de cette étape aura de graves conséquences morphologiques et fonctionnelles, à la naissance (16,19,20). Le degré de l’atteinte diffère selon la localisation de la lésion et son étendue. Le spina bifida est l’une des formes les plus fréquentes et se caractérise par une anomalie du pôle rachidien. La prévalence de spina bifida à la naissance en Afrique est de 0,13%. Il y a une variation significative de la prévalence du spina bifida entre les pays étudiés : en Algérie (0,43%), en Ethiopie (0,32%), en Tanzanie (0,26%), au Cameroun (0,12%), en Egypte (0,10%), en Afrique du Sud (0,10%), en Libye (0,006%) et en Tunisie (0,009%) [13]. Au Togo, selon l’étude de Gnassingbé, en 2013, le spina bifida avait représenté 77,59% des 58 cas d’AFTN suivis au CHU de Lomé (7). L’anomalie survient chez les enfants des femmes ayant des antécédents ou un facteur de risque. Le risque de récurrence est d’environ 2 à 5 % (14). Plusieurs facteurs ont été mis en cause dans sa survenue. La prédisposition génétique, le mariage consanguin, le jeune âge maternel, la multiparité et surtout la carence en acide folique (7,8,14,17). Le mauvais état nutritionnel d’une femme avant la conception et jusqu’à 12 semaines de gestation peut accroitre le risque d’issue défavorable de la grossesse. C’est pourquoi l’Organisation Mondiale de la Santé (OMS) recommande la supplémentation en acide folique (400mg d’acide folique par jour) chez toutes les femmes dès qu’elles commencent à essayer de concevoir un enfant et jusqu’à 12 semaines de gestation. Par contre, les femmes avec un antécédent d’enfant atteint d’AFTN doivent être informées du risque de récurrence et bénéficier d’une supplémentation fortement dosée (5mg acide folique par jour) (11). Malgré cette recommandation de l’OMS, la supplémentation en folates reste faible dans la plupart des pays (6,7,13,14,17). Dans la région septentrionale du Togo, nous avons pris en charge en un an d’activité de neurochirurgie 30 cas d’AFTN. Devant cette fréquence hospitalière d’AFTN, nous avons jugé utile de faire l’état des lieux de sa prévention dans la pratique des prestataires de la santé de la reproduction que sont les sages-femmes d’Etat (SFE) et les accoucheuses auxiliaires d’Etat (AAE) qui conseillent et suivent les femmes. L’objectif de cette étude était d’évaluer les connaissances, attitudes et pratiques des SFE et AAE sur la prévention du spina bifida. METHODE Il s’est agi d’une étude transversale à visée descriptive allant du 22 juin au 20 juillet 2020 dans le district sanitaire de la Kozah dans la région de la Kara, au nord du Togo. Etaient incluses les Sages-Femmes d’Etat (SFE) et accoucheuses auxiliaires d’Etat (AAE) qui réalisaient les consultations prénatales et préconceptionnelles (au service de planification familiale) et présentes durant la période d’enquête. La collecte des données, par auto administration de questionnaires, a été réalisée à partir d’une fiche d’enquête pré établie. Les variables étudiées étaient : la qualification des enquêtées, les connaissances sur le spina bifida et AFTN, sur la prévention du spina bifida et les recommandations sur la prévention, les pratiques en matière de prévention. Le logiciel Epi Data, Microsoft Word et Excel 2013 ont permis de traiter les données. Définitions Sage-femme d’Etat : Avoir obtenu le diplôme de SFE après trois années d’études en soins obstétricaux et néonataux. Accoucheuse auxiliaire d’Etat : Avoir obtenu le diplôme d’AAE après trois années d’étude en pratique sage-femme et en soins infirmiers. Bonnes connaissances, bonnes attitudes ou bonnes pratiques : lorsque toutes les réponses cochées étaient correctes Mauvaises connaissances, mauvaises attitudes ou mauvaises pratiques : lorsque les réponses cochées étaient fausses et/ou incomplètes. RESULTATS Soixante-seize professionnelles avaient accepté de participer à l’enquête dont 42 SFE (55,3%) et 34 AAE (44,7%). Parmi elles, 23 SFE (75%) et 30 AAE (88,2%) avaient une expérience professionnelle supérieure à 5 ans. Trois (03) SFE ont affirmé avoir connaissance des AFTN. 41 SFE et 32 AAE soit 96% des enquêtées avaient entendu parler au moins une fois du spina bifida et 63 enquêtées (83,25%) avaient déclaré avoir reçu au moins une fois un cas de spina bifida dans leur pratique professionnelle. Concernant les facteurs de risque du spina bifida, 74 enquêtées (SFE et AAE) soit 97,4% ne les connaissaient pas (Tableau I). Vingt-neuf SFE (69%) et 15 AAE (44,1%) savaient qu’on pouvait prévenir le spina bifida. Mais, 40 SFE (95,2%) et aucune AAE ne connaissaient le rôle de l’acide folique dans la fermeture du tube neural dans la prévention du spina bifida. 74 enquêtées (41 SFE et 33 AAE) soit 97,4% ne connaissaient pas les aliments riches en folates (Tableau I). La supplémentation en acide folique en période périconceptionnelle et pendant la grossesse est une recommandation de l’OMS pour la prévention des malformations du tube neural dont le spina bifida. La supplémentation systématique en acide folique chez les femmes en âge de procréer était une recommandation pour 56 enquêtées (73,7%). Vingt-deux (22) enquêtées (28,9%) connaissaient la période de la supplémentation (avant et pendant la grossesse). Vingt et une (21) enquêtées (17 SFE et 04 AAE) soit 27,6% avaient coché la dose de 5mg par jour d’acide folique comme la posologie recommandée par l’OMS (Tableau II) sur la feuille d’enquête. Toutes les enquêtées ont affirmé prescrire systématiquement de l’acide folique associé aux sels ferreux aux femmes enceintes au cours des consultations prénatales dans le cadre de la prévention de l’anémie au cours de la grossesse selon les recommandations de l’OMS pour la prévention de l’anémie. Cependant, en matière de prévention du spina, 02 SFE (2,63%) avaient affirmé conseiller correctement les gestantes selon les recommandations sur la supplémentation en acide folique (Tableau III). DISCUSSION L’embryogenèse constitue une étape fondamentale de l’enfant à naître. Le spina bifida résulte d’une fermeture incomplète du tube neural (16,17). Cette malformation n’empêche pas la poursuite de la grossesse (16). Au cours de cette étude, 76 (96%) de ces professionnelles de santé réalisant les consultations prénatales et les activités de planification familiale, enquêtées avaient une fois entendu parlé du spina bifida. Par contre elles ne connaissaient pas les AFTN et les facteurs de risque. La connaissance des facteurs de risque est un gage de la mise en place des stratégies préventives pour toute pathologie. La consanguinité, les carences nutritionnelles, le bas niveau socio-économique, le faible revenu familial annuel, une grossesse non suivie étaient les facteurs les plus retrouvés dans la littérature (6,7,14,17). Une grossesse planifiée, le sexe masculin, un indice de masse corporelle normal ou insuffisant et la prise d’acide folique ou de multivitamines au cours du premier trimestre protégeaient des AFTN selon l’étude de Gedefaw et al. en Ethiopie. D’autres facteurs comme la prise d’anticonvulsivant, l’alcoolisme chronique, le tabac, le diabète mal équilibré, la prise d’une contraception orale ont été incriminés (5,6). Il est donc important de faire une mise à niveau des SFE et des AAE sur les facteurs de risque. Toutes les enquêtées prescrivaient l’acide folique associé au fer pour la prévention de l’anémie mais par forcement dans le cadre de la prévention du spina bifida, même si 57,9% des enquêtées (29 SFE et 15 AAE) avaient coché savoir que l’acide folique était un moyen de prévention. Encore qu’elles affirment ne connaitre le rôle de l’acide folique dans la fermeture du tube neural. Elles ne connaissaient pas non plus les aliments riches en folates. Il en ressort une mauvaise connaissance du personnel qualifié en matière de prévention du spina bifida. Une carence en acide folique lors de l’embryogénèse peut être à l’origine des AFTN dont le spina bifida. Il faut noter que l’acide folique ne prévient pas toutes les AFTN surtout celles liées à une prédisposition génétique (4). L’OMS recommande une prise d’acide folique quotidienne de 0,4 mg chez les femmes sans antécédent et de 5 mg chez les femmes avec un antécédent d’un enfant atteint de spina bifida depuis la période périconceptionnelle jusqu’à 12 semaines de gestation pour prévenir le spina bifida (11). Près des trois quart (73,7%) des enquêtées avaient affirmé connaitre cette recommandation et plus du quart (28,9%) connaissait la période de la supplémentation (avant et pendant la grossesse). Mais c’est seulement environ un quart (27,6%) des enquêtées qui connaissait la posologie adaptée aux femmes ayant un antécédent. La non-planification des grossesses, au Togo, rend les consultations des femmes avant la conception d’un bébé comme un évènement inhabituel. Pour des raisons culturelles voire cultuelles, certaines femmes souhaitent garder la grossesse secrète jusqu’au deuxième trimestre de grossesse. Cette situation tend à réduire les consultations des SFE et des AAE aux consultations prénatales. Les programmes du planning familial pourraient être une alternative pour informer et sensibiliser les femmes à la prévention du spina bifida par une alimentation à base de produits riches en acide folique et la prise d’acide folique en cas de désir de maternité. Comme le rôle de l’acide folique n’est plus à démontrer dans la prévention du spina bifida, certains pays ont adopté l’enrichissement obligatoire en acide folique de certains aliments de base entraînant ainsi une prévalence plus faible du spina bifida, quel que soit le type de cohorte de naissance. Cette situation a fait adopter des législations. Les données africaines étaient rares, mais de nombreux pays africains ont adopté une législation sur l’acide folique En comparant les données des différents pays, on constate que le spina bifida est significativement plus fréquent dans les régions du monde où il n’existe pas de législation gouvernementale (2). Le Togo ne disposant pas de législation gouvernementale sur la prévention du spina bifida, les SFE et les AAE du district de Kozah ne maitrisaient pas la recommandation de l’OMS. Les SFE et AAE prescrivaient systématiquement l’acide folique associé aux sels ferreux pendant les consultations prénatales dans un but de prophylaxie antianémique. Cette prescription ne répond pas à la recommandation sur la prévention du spina bifida. De plus, une étude réalisée dans le district de Kozah avait retrouvé un recours tardif à la première consultation prénatale soit 64,6% des gestantes consultaient après 15 semaines d’aménorrhée (1). Pour plusieurs auteurs, les mères des enfants atteints de Spina bifida n’avaient pas reçu de supplémentation en acide folique avant la grossesse ni au premier trimestre de la grossesse (7,12). Bannick et al. en Ouganda ont conclu que l’apport limité en acide folique était dû à un manque d’informations et de formations des femmes et surtout des agents de santé sur l’importance d’un apport précoce en acide folique (3). Etant donné que l’aspect préventif du spina bifida est assez mal connu par les SFE et AAE, l’acide folique est prescrit seulement au cours de la grossesse lors des consultations prénatales dans le cadre de la prévention de l’anémie. Pour des raisons énoncées précédemment, les femmes débutent le plus souvent la consultation prénatale au 2e trimestre de la grossesse bien après l’embryogenèse. Les futures mères ne planifient pas toutes leurs grossesses ou ne reçoivent pas des conseils sur la prévention lors de la visite préconceptionnelle qui sont rares. La supplémentation en acide folique réduit avec succès la prévalence des AFTN chez les nourrissons de sexe masculin et féminin (5,10,11,15). Les effets de la prévention sur les AFTN étaient significatifs lorsque ces mesures préventives étaient associées à l’enrichissement des aliments en acide folique pendant la période périconceptionnelle (2,8,9,11). Au Brésil, l’introduction de l’obligation d’enrichissement en fer et en acide folique des farines de blé et de maïs a été suivie d’une baisse significative de la prévalence des AFTN (18). CONCLUSION Cette étude révèle que les SFE et les AAE du district sanitaire de Kozah avaient de mauvaises connaissances, attitudes et pratiques dans la prévention du spina bifida. Cependant, l’acide folique combiné aux sels ferreux était prescrit systématiquement aux femmes enceintes pour la prévention de l’anémie au cours de la grossesse. Dans le cadre de la prévention du spina bifida, la supplémentation en acide folique devrait commencer en période périconceptionnelle selon la recommandation de l’OMS. Un accent particulier doit être mis sur cette recommandation dans les formations des SFE et AAE, maillon important dans la prévention du spina bifida. Aussi, le pays doit il se doter d’une législation pour établir de stratégies préventives efficientes.
Tableau I : Répartition des enquêtées selon les connaissances sur la prévention spina bifida
Tableau II : Répartition des enquêtées selon les attitudes sur la prévention du spina bifida
Tableau III : Répartition des enquêtées selon les pratiques sur la prévention du spina bifida
Articles récents
Commentaires récents
Archives
CatégoriesMéta |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647