|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCTION Traumatic Spinal Cord Injury (TSCI) is a sudden, unexpected catastrophic neurological event that results in motor paralysis, sensory loss and sphincter disorder in different degrees, imposing a significant burden on the health care system (8,26). Globally, the annual incidence of TSCI ranges from 2.3 per million to 83 per million (11). In Nigeria, approximately 17.5 deaths per million people per annum are attributable to TSCI (5). TSCI exerts an extensive physical, psychosocial and economic burden on the injured individual, family caregivers, and society as a whole (17,18). Mortality is particularly high in the first year after injury (19) and is strongly affected by the capacity of the health-care system. Treatment for patients with TSCI is often long-term and many times, life-long. This in part explains why it is regarded as a condition that is both devastating and costly in human and social terms (18). The cost of treatment is especially enormous in the first year of injury and remains a burden to the patients and their families (14). This substantial economic burden is complicated by high rates of morbidity, premature mortality and increased health care costs (17). Such burden would be more pronounced in Low and Middle Income Countries (LMIC) such as Nigeria where the official poverty rate is approximately 60.0% (27). Lack of hospices and special treatment/ rehabilitation centers for people with TSCI in Nigeria, elongates their stay in the hospital (23). This results in high hospitalization cost which contributes significantly to the total cost of treatment. Kawu et al (14) estimated the cost of conservative treatment for acute TSCI in Nigeria to be $1598.29 per patient and most of this is spent on hospitalization. Cost of treatment is of increasing interest not only to patients but also to physicians, family, and the nation at large. Yet, most studies on cost of healthcare and illnesses are from developed countries (3). The data from such studies are not transferable to a resource-constrained economy like Nigeria. Studies on direct cost of TSCI in Nigeria are scarce and limited to acute care. This study was conducted to estimate the direct cost of treatment for patients with TSCI at the University College Hospital (UCH), Ibadan, Nigeria. METHODS Sources of Data This retrospective study employed an incidence-based costing approach. New cases of adults with TSCI admitted into Nigeria premier tertiary health facility, the University College Hospital, Ibadan between January 2009 and December, 2013 were identified for review. The University College Hospital is the designated center of excellence in, and a major referral center for, the neurosciences in Nigeria. Ethical approval was obtained from the appropriate Institutional Health Research Ethics Committee. Only case files of patients who survived and were discharged home after in-patient care were reviewed. Patients with associated traumatic brain injury, long bone fracture and extensive soft tissue injuries requiring surgical interventions were excluded. Information on socio-demographic variables (age, sex, marital status, level of education, and occupation) and clinical characteristics (severity of the injury, level of injury, mechanism of injury and co-morbidity) of the patients were retrieved from individual patient’s case files. Severity of injury was defined according to the American Spinal Injury Association Impairment Scale (AIS). This is a standard for assessing and classifying the neurological level and extent of TSCI. The level of injury was categorized as tetraplegia for lesions above T2 and paraplegia for lesions below T2 (16). Direct costs of treatment over the first year of injury were derived from cost associated with in-patient and out-patient treatments as documented in patients’ records. The direct costs of in-patient treatment include costs of diagnostic tests and procedures, surgical treatments, physiotherapy, drugs and non-drug items and hospitalization and nursing. Unit costs of diagnostic tests and procedures, surgical treatments, physiotherapy, drugs and non-drug items and hospital admission were based on the hospital billing system for each of the years studied, while the costs of consultations by neurosurgeons were calculated from the government payer’s perspective (National Health Insurance Scheme, NIHIS). Cost of diagnostic tests, procedures, surgical treatments and investigations was obtained by multiplying the number of times each test/procedure was carried out by the relevant cost of test/procedure. Cost of test/procedure = No of times of test/procedure x relevant cost of test/procedure. Cost of hospitalization and nursing care was calculated using the length of hospital stay multiplied by the per diem cost of hospital bed including nursing services. Cost of hospitalization = Length of hospital stay x per diem cost of hospital bed and nursing services. Type of drugs and record of drug usage in terms of frequency and dosage was estimated from the drug charts in the case files. Variations in drug clusters were eliminated by taking the most commonly used drug as the drug of treatment. Subsequently, dosage and frequency of drugs used daily was calculated and the relevant unit cost applied. Other types of treatment given, including physiotherapy, and the number of treatment sessions were obtained from the case files and cost of treatments was calculated as for drugs. Cost of outpatient care was calculated based on the frequency of out-patient visits over the first year after discharge from inpatient care and the drugs and treatment taken over this period multiplied by the relevant unit cost.
DATA ANALYSIS Descriptive statistics of mean and standard deviation, frequency and percentages were used to summarize data. Chi square test was used to investigate the association between cost of treatment and each of severity of injury, level of injury and length of hospital stay. The level of significance was set at 0.05. RESULTS One hundred and fourteen adults with TSCI comprising 73 males and 41 females who were discharged home alive from the hospital during the period studied were reviewed. More than half (53.5%) of the participants were aged between 20 and 39 years with a mean age of 39.6 ± 12.1 years (Table 1). About two-thirds (66.7%) of the participants had cervical spine injury (Table 2). Road Traffic Accidents (RTAs) was the single most common cause of injury (80.7%) and the length of hospital stay ranged from 3 to 192 days with a mean of 51.4 ± 37.2 days. The estimated total direct cost of in-patient treatment was N34,079,381.30 ($212,996.13) [average = N303,479.75± 181,508.42 ($1896.75 at exchange rate for year 2013) per patient]. The highest driver of direct cost treatment for patients with TSCI in Ibadan, Nigeria was cost of consultations by neurosurgeons which constituted about a third (34.4%) of the total cost of treatment (Table 3). Only about a quarter (24.2%) of the total cost of in-patient treatment was spent on therapeutic interventions (surgery, drugs and physiotherapy). The total cost attributable to cervical spine injury was N310,769.40 ($1942.31) per patient, while the cost for thoracic spine and below was N273,957.05 ($1712.23). The total cost of treating a complete SCI was N404,219.61 ($2526.37) per patient while an incomplete SCI incurred a cost of N242,518.21 ($1515.73). The direct cost of out-patient treatment in the index year following in-patient discharge was N6,218,519.25 ($38865.75). The average per person cost of in-patient treatment was approximately 27% more than the average per person costs of out-patient treatments. There was a significant association between the direct cost of treatment and each of severity of TSCI (p=0.01) and length of hospital stay (Table 4). There was however, no significant association between total cost of treatment and level of injury (p=0.89). DISCUSSION This incidence-based study estimated the direct cost of in-patient treatment and out-patient treatment over the first year post-discharge for 114 patients with TSCI managed at the Nigeria premier teaching hospital in Ibadan, Nigeria. Going by the records obtained, there was an average of 22 new cases of TSCI per annum between 2009 and 2013. This is high compared to reports from earlier studies on TSCI in Nigeria (12,29). There have been growing concerns on the increasing incidence of SCIs in low and middle income countries including Nigeria (13). This along with increase in road traffic accidents might have resulted in the increased incidence found in this study. Majority of the patients were young, male adults and had tertiary education. This finding is consistent with reports from previous studies that TSCI mostly affects young male adults (1,4,20,23). According to Yip and Malaspina (28), most of the over 40 million people who suffered SCI annually are young men aged between 20 and 35years. Road Traffic Accidents (RTAs) was the most common cause of injury among patients in this study. This is similar to reports from earlier studies from different countries that RTAs are the leading cause of TSCI (5,6,15,26). The role of RTAs in the etiology of TSCI in Nigeria is underscored by the increased urbanization and escalation in the use of commercial motorbikes for transportation by many, coupled with poor adherence to road safety measures by the operators/riders. The most common level of injury recorded in this study was the cervical spine. This is in agreement with findings from earlier studies that most TSCI occurred at the cervical spine (21,29). Conversely, Ihegihu et al (13), reported the most common level of injury as the thoracic spine in their study. The similarity observed between our findings and those of Yongu et al (2), and Moshi et al (21), may be related to the time series in all three studies. Whilst these researchers reviewed patients seen between 2012-2014 and 2010 – 2015, we reviewed patients seen between 2009 and 2013. Though not exactly the same, these are comparable time series, which could account for the similarity in findings. Ihegihu et al (12), on the other hand reviewed patients seen between 2001 and 2005 (almost a decade earlier). Variations in etiologies and pattern of TSCI across decades and sites have been reported in literature (24). The estimated direct cost of in-patient treatment for TSCI for the five-year period was N34,079,381.30 ($212,996.13 at exchange rate for year 2013) with the mean cost of treatment being N303,479.75± 181,508.42 ($1896.75). This is enormous in view of the federal minimum wage of N18,000 per month ($120/month). Moreover, majority of the citizens have no healthcare coverage under the National Health Insurance scheme and paid for treatment out of pocket. The implication of this is that most patients could not afford needed care, which leads to increased morbidity and mortality among these patients. Kawu et al (14) had earlier reported the average cost of conservative management for SCI in Nigeria as $1598.29. This is significantly less than the average cost of $1896.75obtained in this study. This is despite that the cost estimated by Kawu et al (14), included income loss by the patients. The difference between our findings and that of Kawu and colleagues may be because they estimated only the cost for the acute phase of treatment spanning six weeks of hospital admission whereas we estimated the cost of treatment for the entire duration of in-patient care. Across the five years, the cost associated with consultations/reviews by neurosurgeons was higher than all other direct costs of treatment and accounted for about a third of the total cost of treatment. Dryden et al (7), reported that hospitalizations including cost of acute care and in-patient rehabilitation accounted for the highest expenditures. Munce et al (22), on the other hand, separated the costs of acute care and inpatient rehabilitation and found the costs of rehabilitation to be more than three times the costs of acute care. These authors did not specify what constituted acute care and inpatient rehabilitation. We estimated cost of treatment based on services and procedures received during in-hospital care. We found that patients received all needed care including rehabilitation practically on a daily basis throughout hospitalization and are billed accordingly. Some of these services are not routinely required particularly when patients are stable and there are no complex or life threatening health issues. The frequency/cost of visits by neurosurgeons during in-patient care has impact on the cost of treatment borne by patients. It has been suggested that it is best to maintain the injured individual in a rehabilitation setting, and bring in the appropriate medical or surgical specialist if complications arise during inpatient rehabilitation (9). The high cost of care for TSCI has resulted in patients and/or their relatives requesting to be discharged home against medical advice (DAMA). This informs the need to review current treatment models and seek for cost-saving models for patients with TSCI. Cost of diagnostic investigations is another important factor associated with increase direct costs of treatment for patients with TSCI in Ibadan, Nigeria. This may be due to replication and repetition of imaging and laboratory investigations. Often times, a big time lag exists between when investigations such as laboratory tests are requested by surgeons and when they are paid for by patients, usually due to financial constraints. Many times, requested investigations are done piecemeal as funds are available to the patients. This, coupled with delays in processing investigation results, limit the usefulness of such result. This may necessitate a request for a repeat of such investigations to indicate the current state of the patient. In addition, some investigations are associated with high cost in Nigeria. For instance, Magnetic resonance imaging (MRI), though the gold standard for imaging the spinal cord and related soft tissues (25), is quite expensive for most patients. This is particularly important, considering that the majority of the patients with TSCI are in the low-income group (14). The high overhead on diagnosis reduces the fund available for therapeutics on the long run. The direct cost of out-patient treatment in the index year following in-patient discharge was quite low compared to cost of in-patient treatment. Out-patient treatment amounted to about one-sixth of the total cost of in-patient treatment. This is not surprising as majority of the patients admitted for treatment in the hospital did not report for follow-up visit. This could be because the hospital is a major referral center in Nigeria, receiving patients from different parts of the country. Patients who do not reside in the hospital environ often continue rehabilitation in their localities. The issue of cost and distance to location of hospital from their usual residence may also account for the observed reduction in out-patient visits. Some patients would rather stay home or seek help from alternative therapies which are sometimes cheaper and give false hope of recovery to the patient. Consultation fee was still the leading cost of out-patient treatment for TSCI during the study period. There was a significant association between direct cost of treatment and each of severity of TSCI and length of hospital stay. This suggests an increase in the cost of treatment with increased severity of injury. It has been demonstrated that more severely injured trauma patients incurred significantly higher cost than their less severely injured counterparts (2). This may be related to the tendency for patients with more severe injury staying longer in the hospital and their likelihood of developing complications that will also require treatment. There was however, no significant association between the direct cost of treatment and the level of injury. This is contrary to the findings of Dryden et al (7), and French et al (10). These researchers reported that the cost of care was higher for patients with tetraplegia than for paraplegics. Kawu et al (14) also reported a high cost for tetraplegics than for paraplegics. It could be that there are other factors other than level of injury that contribute to cost of care. It has been suggested that severity and/or completeness of SCI plays a role in cost of treatment. According to Dryden et al (7), complete SCIs are associated with more cost of treatment than incomplete SCIs. Our study comprised mostly patients with incomplete injury (about two-thirds). The outcome could have been different in the absence of this unintended bias. This study has provided the first comprehensive estimate of direct cost of treatment for patients with TSCI in Ibadan, Nigeria. However, it has some limitations. Cost estimation was based on recorded information. Accuracy of documented information could not be ascertained. This and the small sample size could result in under or over estimation of cost. In addition, direct costs incurred by patients for over-the-counter drugs, mobility and assistive technologies that were obtained outside of the hospital were excluded from cost estimations. This could be substantial and results in underestimation of cost of care for patients with TSCI in Ibadan, Nigeria. CONCLUSIONS Estimated direct cost of treatment for TSCI in Ibadan, Nigeria is substantial. These findings highlight a need to evaluate treatment processes and diagnostic procedures in the care of individuals with TSCI. There is a huge potential for minimizing cost through government investment in comprehensive rehabilitation units into which patients can be discharged for in-patient rehabilitation after acute management. This may reduce the cost of treatment and encourage appropriate utilization of scarce healthcare resources among patients. ACKNOWLEDGEMENTS This work was supported by the Medical Education Partnership Initiative in Nigeria (MEPIN) project funded by Fogarty International Center, the Office of AIDS Research, and the National Human Genome Research Institute of the National Institute of Health, the Health Resources and Services Administration (HRSA) and the Office of the U.S. Global AIDS Coordinator under Award Number R24TW008878. The content is solely the responsibility of the authors and does not necessarily represent the official views of the funding organizations. Conflict of interest: None declared Footnote: $1was equivalent to N160 at 2013 exchange rate.
Table I: Socio-demographic Characteristics of Patients with TSCI
Table II: Clinical Profile of Patients with TSCI
Table III: Direct Cost of In-patient and Out-patient Treatment
Table IV: Association between cost of treatment and each of severity of injury, level of injury and length of hospital stay
*significant at <0.05 PROFIL EPIDEMIOLOGIQUE, CLINIQUE ET THERAPEUTIQUE DES EPILEPSIES A BOUAKE (CÔTE D’IVOIRE)INTRODUCTION L’épilepsie est l’une des affections neurologiques les plus répandues dans le monde. (1) Selon l’organisation mondiale de la santé (OMS), environ 50 millions de personnes en sont atteintes, ce qui en fait l’une des affections neurologiques les plus fréquentes. (19,20) Près de 80% des personnes souffrant d’épilepsie vivent dans les pays à revenu faible ou intermédiaire. (1) Environ trois quarts des personnes affectées dans ces pays ne bénéficient pas du traitement dont elles ont besoin. (14) La prévalence de l’épilepsie varie entre 3 et 10‰ habitants dans les pays industrialisés. (17) En Afrique sub-saharienne, la prévalence de l’épilepsie est élevée, elle varie entre 2.2 et 58‰ et touche près de 4.4 millions de personnes. (16) En Côte d’Ivoire, elle est estimée à 8‰. (1) La crise socio-politique qu’a connue la Côte d’Ivoire depuis 2002 a été à l’origine d’un déplacement massif des populations et d’une désorganisation du système de santé. Avec la normalisation progressive de la situation et la reprise des activités du service de Neurologie sur le site de Bouaké depuis l’an 2012, notre travail visait à recueillir des données épidémiologiques et cliniques récentes, concernant l’épilepsie dans notre contexte de travail. MATERIEL ET METHODE Il s’est agi d’une étude rétrospective observationnelle et descriptive qui s’est déroulée dans le service de neurologie du Centre Hospitalier Universitaire (C.H.U) de Bouaké, de Mai 2012 à Septembre 2015. La ville de Bouaké est la deuxième ville de Côte d’ivoire située dans le centre du pays à 355 Km de la capitale économique (Abidjan). Le CHU de Bouaké est la seule structure hospitalière de niveau 3 des zones Centre, Nord, Ouest et Est du pays. Cette étude a concerné les dossiers des patients vus dans différents services du CHU de Bouaké (neurologie, urgences médicales, réanimation, psychiatrie) en consultation, en hospitalisation ou au cours des caravanes de lutte contre l’épilepsie et ayant présenté au moins deux crises épileptiques (généralisées, partielles) quelle qu’en soit la cause. Le recueil des données s’est fait à l’aide d’une fiche d’enquête comportant des données sociodémographiques, cliniques, paracliniques et thérapeutiques. Le traitement des données recueillies s’est fait à l’aide du logiciel SPSS 2.0. RESULTATS Deux cents (200) dossiers ont été retenus sur un total de 2263 dossiers de patients reçus dans la période d’étude, soit une prévalence de 88,38‰. L’âge moyen des patients était de 20 ± 16 ans avec des extrêmes de 4 mois et 79 ans. Quarante-quatre virgule cinq pourcent (44,5%) des patients étaient âgés de moins de 15 ans et 54,5% de sexe masculin, soit un sex ratio de 1,2 en faveur des hommes. Les patients du groupe Akan étaient prédominants (40%), suivi du groupe Mandé (24,5%) puis du groupe Gour (22,5%). Dans 8% des cas, le groupe ethnique n’a pu être précisé. Trente-sept virgule cinq pourcent (37,5%) des patients étaient sans emploi, 31,5% étaient des élèves, 20,5% des travailleurs du secteur informel, 8% des fonctionnaires et 2,5% des étudiants. Les antécédents médicaux des patients sont rapportés dans le Tableau 1. Quinze virgule cinq pourcent (15,5%) des patients étaient des épileptiques connus, la majorité des sujets (62%) avait fait leurs premières crises avant l’âge de 15 ans et 5,5% avaient présentés leurs crises au-delà de 45 ans. Au plan clinique, 71,5% des patients ont rapporté des crises généralisées. Dans 25,5% des cas, la sémiologie des crises n’a pu être précisée. Le tableau 2 montre les différents types de crises identifiés. Soixante-neuf pourcent (69%) des patients présentaient 2 à 3 crises dans le mois. Au plan paraclinique, 77,5% des enquêtés avaient réalisé un électroencéphalogramme (EEG). L’EEG était anormal dans 78% des cas. Les anomalies EEG étaient généralisées dans 82% des cas, focales dans 14% des cas et focales se généralisant au cours des épreuves d’activation dans 4% des cas. Un scanner cranio-encéphalique a été réalisé chez 15 de nos patients (7,5%), montrant des anomalies chez 7 d’entre eux. Il s’agissait de séquelles d’AVC (3 patients), d’atrophie corticale (3 patients) et d’abcès cérébral (1 patient). Dans 45% des cas, les patients avaient une épilepsie symptomatique. Au plan thérapeutique, 68,5% des patients ont bénéficié d’une monothérapie, 29,5% d’une bithérapie et 2% d’une trithérapie antiépileptique. Le phénobarbital était la molécule la plus utilisée (51%), suivi du valproate de sodium (36,5%). La lamotrigine a été utilisée dans 2,5% des cas. Au plan évolutif, après une année de prise en charge, il a été noté une régression complète des crises chez 55% des patients, une réduction importante de la fréquence des crises chez 25% d’entre eux. En revanche, chez 20% des patients le tableau clinique était stationnaire. Par ailleurs, nous avons constaté une inobservance thérapeutique et/ou le non-respect des mesures d’hygiène de vie chez 22,5% de nos patients. DISCUSSION La présente série a rapporté une prévalence de l’épilepsie estimée à 88,38 ‰. Cette prévalence est proche de celle rapportée par Espinosa-Jovel et al. dans leur revue de la littérature concernant les données épidémiologiques en matière d’épilepsie dans les pays à faibles ou moyens revenus (81,7‰). (6) En revanche, la prévalence de notre série est nettement supérieure à celle rapportée par Paul et al. en 2012 dans leur revue de littérature concernant l’épilepsie en Afrique sub-saharienne (entre 2,2 et 58 ‰). (16) Cette prévalence élevée dans les pays à faibles revenus diffère de celle des pays développés, où elle est plus faible (entre 5,8 et 15,4 ‰) (13) et s’explique en partie par certains facteurs de risque tels les traumatismes crâniens, les infections du système nerveux central, les affections périnatales retrouvés plus fréquemment dans les pays à faibles ou moyens revenus. (13) La prévalence élevée de la série rapportée pourrait également s’expliquer par le recrutement d’une partie de nos patients au cours des différentes campagnes de sensibilisation réalisées dans les quartiers de la ville de Bouaké. Ces campagnes ont permis de recevoir des patients dont la révélation de la maladie était jusque là considérée comme taboue par l’entourage du fait de la stigmatisation dont font l’objet les patients vivants avec l’épilepsie. La prédominance masculine de notre population d’étude est également rapportée par la plupart des données de la littérature. Une bonne part de nos patients était non scolarisée. (40,5%) Ce fait pourrait s’expliquer par l’ampleur des préjugés sur l’épilepsie qui pousserait à la non scolarisation des personnes vivant avec l’épilepsie. Owolabi et al. ont noté dans leur travail relatif à la connaissance des enseignants concernant l’épilepsie au Nigéria que certains enseignants refusaient même de recevoir des enfants vivant avec l’épilepsie dans leur classe. (15) Dans notre étude, 8,5% des patients avaient un antécédent de traumatisme crânien, 13,5 % avaient présenté une infection du système nerveux central (neuropaludisme, méningite) et 8% une affection périnatale (prématurité, souffrance fœtale). Les traumatismes crâniens représentent une cause commune d’épilepsie. (6) En Afrique, les accidents de la voie publique sont l’une des causes principales des traumatismes crâniens, dus au déficit dans la régulation du trafic routier avec non-respect du code de la route, notamment l’absence de port de ceinture de sécurité ou l’absence de port de casque pour les motocyclistes. (1) Le non-respect du port de casque pour les motocyclistes constitue un « véritable fléau » dans la région de Bouaké. Dans une étude réalisée au Mali, l’épilepsie post traumatique avait été retrouvée chez 7% des 70 patients vivant avec l’épilepsie. (7) Les infections du système nerveux central qui sont en général associées à la survenue de crises généralisées sont principalement d’origine parasitaire en Afrique équatoriale. (8) Parmi ces atteintes parasitaires, nous pouvons citer le paludisme (8), la cysticercose, l’onchocercose et la toxocarose. (18) Le paludisme est l’une des parasitoses tropicales communément impliquée dans le développement de l’épilepsie, vu les lésions cérébrales fréquentes induites par le parasite. (11) Ngoungou et al., dans une étude menée en Afrique sub-saharienne (Mali et Gabon) sur une cohorte d’enfants suivie au décours d’un accès palustre, avaient rapporté un risque plus élevé de développer une épilepsie après un neuropaludisme. (12) Notre série ne note en revanche pas d’atteinte cysticerquienne, quand bien même, elle est décrite comme l’une des causes parasitaires les plus communes d’épilepsie en Afrique, en Asie et en Amérique latine. (3, 10) Les études en population générale en Afrique sub-saharienne, et particulièrement dans les zones rurales, ne rapportent généralement pas correctement les cas de crises focales, ni même les crises « absence ». Le nombre réduit de neurologues et les difficultés de réalisation des examens paracliniques, notamment l’électroencéphalographie (EEG), sont des raisons, rapportées par Ba-Diop et al., pouvant expliquer les faibles taux de notification des types de crises autres que les crises généralisées, mieux connues. (1) La faible notification des crises focales dans la série rapportée pourrait s’expliquer, également par ce fait. En effet, les patients référés au C.H.U de Bouaké proviennent des centres périphériques, qui ne disposent généralement pas de neurologues. Aussi, les patients avec des crises focales ou des crises absences, difficiles à reconnaitre sur le plan clinique, ne seront pas correctement orientés. La plupart des patients n’ont pas bénéficié d’un scanner crânio-encéphalique en raison du manque de moyens financiers. Cinquante-trois virgule quatre-vingt-quatre pourcent (53,84%) des scanners crânio-encéphaliques réalisés étaient anormaux. Dans la série rapportée par Doumbia-Ouattara et al. concernant les épileptiques vus au C.H.U de Yopougon (Côte D’ivoire), le taux de réalisation du scanner cérébral était plus élevé (77,5%), probablement dû au caractère prospectif de l’étude. (5). Au plan thérapeutique, nous avons été confrontés à l’inobservance thérapeutique chez 22,5% des patients. En Afrique sub-saharienne, 59% des personnes vivant avec l’épilepsie ne bénéficient pas de traitement antiépileptique ; et parmi celles qui en bénéficient, 33% ne sont pas correctement traitées. (1) Selon Mbuba et al., en tenant compte de la concentration sérique des antiépileptiques, environ deux tiers des patients vivant avec l’épilepsie rapportés dans leur série n’était pas traité. (9) Les facteurs de risque de non observance rapportés par Mbuba et al. étaient les croyances religieuses animistes, la difficulté d’accès aux structures pharmaceutiques, le coût du traitement, la non scolarisation, la durée de traitement supérieure à 5 ans. (9) Soixante-huit virgule cinq pourcent (68,5%) de nos patients ont bénéficié d’une monothérapie et le phénobarbital a été la molécule la plus utilisée. Cette molécule est efficace dans toutes les formes d’épilepsie sauf les cas d’absence typique. (4) Le phénobarbital est le médicament antiépileptique le plus prescrit dans le monde du fait de son coût. (4) Au Cameroun, Dongmo et al. ont rapporté dans leur série, 90% de traitement en monothérapie et 75% d’utilisation de phénobarbital. (4) Sous traitement, la rémission complète était observée chez 70% des patients, une réduction de la fréquence des crises dans 16% des cas et la persistance de la fréquence des crises dans 14%. (4) Dans une série rapportée au Mali, 60% des patients traités par le phénobarbital avaient présenté une rémission complète des crises dans le suivi. (2) Les molécules antiépileptiques de dernière génération telle la lamotrigine ont été peu utilisées du fait de leur coût élevé et du manque de couverture médicale pour bon nombre de patients. Nous avons noté un certain nombre de difficultés dans la réalisation de cette étude. Il s’agissait notamment des difficultés de réalisation des examens paracliniques (EEG, scanner crânio- encéphalique) dû au manque de moyen financier et à l’absence de couverture médicale, des dossiers insuffisamment renseignés du fait de l’absence des carnets de santé mère-enfant et de l’inobservance thérapeutique de nos patients. CONCLUSION La série rapportée réalisée dans les services du CHU de Bouaké et au décours des caravanes contre l’épilepsie dans la ville de Bouaké a montré une prévalence très élevée, mais similaire à celle rapportée dans la littérature en Afrique sub-saharienne, en partie dûe au mode de recrutement de nos patients (recrutement à partir de campagnes de sensibilisations dans la ville de Bouaké). Elle souligne donc l’importance de la poursuite de ces campagnes de sensibilisation, dont le but est « de sortir l’épilepsie de l’ombre ». L’instauration dans l’arsenal thérapeutique des molécules de dernière génération chez les patients pourrait améliorer la prise en charge et le taux de rémission. Cette série laisse apparaitre la nécessité de mener des études à plus grande échelle avec une méthodologie rigoureuse afin d’obtenir des données épidémiologiques fiables sur la situation des épileptiques. Tableau 1 : Répartition des patients selon les différents antécédents
Tableau 2 : Répartition des patients selon le type de crise présenté
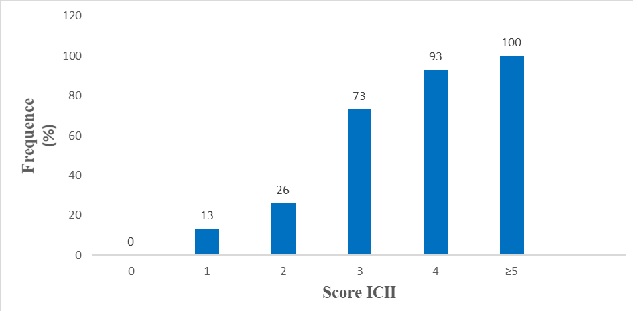
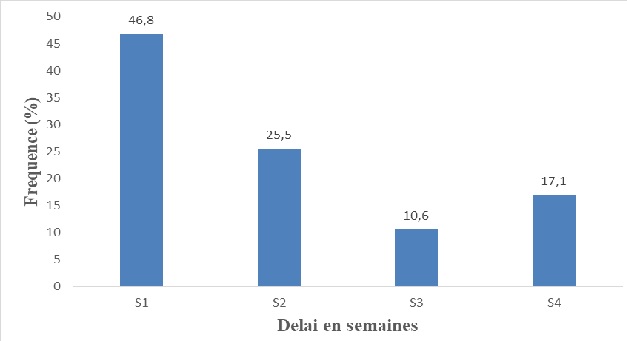
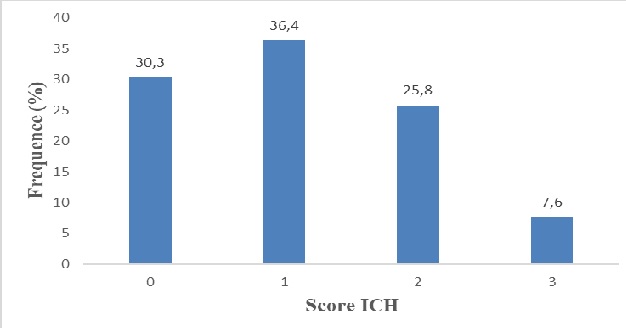
PRONOSTIC DE L’ACCIDENT VASCULAIRE CEREBRAL HEMORRAGIQUE CHEZ DES PATIENTS HOSPITALISES A LA CLINIQUE DES NEUROSCIENCES IBRAHIMA PIERRE NDIAYE, DAKAR, SENEGAL EN 2018 INTRODUCTION Les accidents vasculaires cérébraux (AVC) constituent un problème de santé publique dans le monde. Ils demeurent la troisième cause de mortalité dans le monde, et certainement la première cause d’invalidité (5,18). Dans les pays industrialisés, les accidents vasculaires cérébraux hémorragiques (AVCH) représentent 10 à 20% de l’ensemble des AVC soit 10 à 20 cas par 100 000 habitants (10). Ils correspondent à une extravasation de sang dans le parenchyme cérébral (9). Ils sont souvent de pronostic réservé, et la mortalité à 30 jours de l’AVCH est comprise entre 35 et 52 % (22). En Afrique, la fréquence est élevée avec des taux allant de 28 à 60% (9,15,23) et un taux de mortalité variant entre 19,85 % et 57,4% (4,5). Plusieurs études se sont intéressées au pronostic de l’AVCH, ainsi qu’au devenir des patients en Afrique subsaharienne (2,4,20,25). Au Sénégal, les AVC sont au premier rang des affections neurologiques, avec plus de 30 % des hospitalisations, et sont responsables de deux tiers des décès dans le service de neurologie de Dakar (24,26). Deux études y avaient abordé le pronostic des AVCH dont l’une chez les sujets de moins de 55 ans et l’autre chez les patients comateux (26,25). Cependant dans ces études, les patients conscients et les sujets âgés de plus de 55 ans n’étaient pas inclus, ce qui pourrait constituer une limite pour évaluer le pronostic. C’est dans ce cadre que nous avons mené ce travail qui avait pour objectif d’évaluer le pronostic à court terme de tous les patients hospitalisés pour AVCH à la clinique de neurosciences Ibrahima Pierre Ndiaye du Centre Hospitalier National Universitaire (CHNU) de Fann sur une période de 1 an. MATERIEL ET METHODE Notre étude a été menée à la clinique de Neurosciences Ibrahima Pierre Ndiaye du CHNU de Fann, Dakar-Sénégal. Nous avons réalisé une étude transversale (descriptive et analytique) sur une durée d’un an allant du 1er janvier 2018 au 31 décembre 2018. Ont été inclus dans l’étude tous les patients hospitalisés ayant rempli les critères du diagnostic de l’accident vasculaire cérébral hémorragique (déficit neurologique soudain et présence d’une hémorragie intracérébrale à la TDM cérébrale). N’ont pas été inclus dans cette étude tous les malades hospitalisés pour accident vasculaire ischémique avec un ramollissement hémorragique secondaire. La collecte de données a été réalisée à l’aide d’un questionnaire. Ce dernier était rempli après un entretien avec le malade ou avec les membres de sa famille. Les données recueillies étaient le résultat de l’examen clinique et le bilan paraclinique réalisé. Ainsi, le questionnaire était administré dans les trois premiers jours suivant l’hospitalisation et à la sortie du service de Neurosciences Ibrahima Pierre Ndiaye. Pour les caractéristiques sociodémographiques, les variables étudiées étaient le sexe, l’âge, et le lieu de résidence. Concernant les caractéristiques cliniques, les variables étudiées étaient l’état de conscience, les déficits moteurs, les troubles du langage, le délai d’admission, les antécédents médicaux, les facteurs de risques vasculaires (HTA, diabète) et l’unité d’hospitalisation (unité de réanimation, salles d’hospitalisations). Les variables paracliniques étudiées étaient la glycémie à l’admission, le siège de l’hématome, le volume de l’hématome calculé selon la formule A x B x C/2 (7), la présence d’hémorragie ventriculaire, la présence d’engagement cérébral, et les dyslipidémies (LDL cholestérol > 1,5g/l, triglycérides > 1,5g/l et le cholestérol total > 2g/l). Les variables étudiées pour les aspects évolutifs étaient, les complications de décubitus, la durée de l’hospitalisation et les décès. Les variables étudiées, pour les aspects pronostiques étaient, le score ICH (Intracerebral Hemorrhage) de Hemphill (Tableau I) (13), la mortalité prédite dans les 30 jours (Figure 1) (13). La saisie et le traitement de données ont été réalisés avec les logiciels world 2016, Epi info dans sa version 3.5.1 et Excel 2016. Les résultats ont été exprimés en fréquences et moyennes +/- écarts-types. Le test de Chi-2 et le test exact de Fischer (p <0,05) ont été utilisés pour l’analyse univariée des facteurs pronostiques. Sur un total de 483 dossiers d’AVC, 132 cas d’AVCH ont été répertoriés soit une fréquence de 27,3 %. L’âge moyen des patients était de 59,2 +/- 13 ans avec des extrêmes allant de 23 à 91 ans et le sex ratio était à 1,38. Les caractéristiques de la population étudiées sont regroupées dans le Tableau II. Les patients hospitalisés en unité de soins intensifs neurologiques représentaient 26,5% et 73,5 % étaient admis en salle d’hospitalisation. Les données cliniques des patients sont mentionnées dans le Tableau III. Le bilan biologique, retrouvait une hyperglycémie chez 39.3%. Cette dernière était comprise entre 1,10 et 2 g/l chez 34,8%. Les données de l’imagerie sont répertoriées dans le tableau III. La mortalité à trente jours était de 35,6% soit 47 cas. La figure 2 montre la répartition de cette mortalité sur les quatre premières semaines d’hospitalisation. La durée moyenne de l’hospitalisation était de 13,8 jours. Le score ICH moyen était de 1,1 avec un minimum à 0, un maximum à 3 et un écart-type à 0,8. Trente-six virgule quatre pourcent des patients avaient un score ICH à 1 et 25,8% avaient un score à 2 (Figure 3). Sur le plan pronostic, le trouble de la vigilance, le siège sous tentoriel de l’hématome, l’hyperglycémie à l’admission, la présence d’engagement cérébral sous falcoriel et les complications de décubitus, étaient associés de façon statistiquement significative à la mortalité à 30 jours (Tableau IV) DISCUSSION Le taux de mortalité à 30 jours dans notre étude était de 35,6%. Ce taux reflète la gravité de cette affection. En effet, un taux de mortalité élevé a été constaté dans plusieurs travaux (3,17,26). Il était de 35,5 % en Côte d’Ivoire (12), 42,1% au Sénégal (26), 44% en Uganda (1). En plus, dans les études réalisées en unité de réanimation, un taux de mortalité plus élevéa été rapporté, soit 54,17% en Espagne (21) et 62,2 % au Congo Brazzaville (17). La mortalité est surtout élevée durant la première semaine suivant l’AVCH. Elle était de 46,8% (22 décès) durant la première semaine dans notre étude. Le score de Hemphill (ICH) est un outil utile pour prédire la mortalité à 30 jours chez les patients atteints d’accident vasculaire hémorragique (16). Dans notre étude, le score ICH moyen était de 1,1. Un score ICH à 4, 5, ou 6, n’a pas été observé dans notre travail. Les raisons qui pourraientt expliquer l’absence de score ICH élevé sont d’une part, le taux faible (26,5%) des patients admis en unité de réanimation du service de neurologie de CNHUF, et d’autre part, le fait que certains patients grabataires soent pris en charge en réanimation au service des urgences du CNHUF. Dans notre cohorte, la majorité (92.4%) des patients avait un score ICH entre 0 et 2. Akani en Côte d’Ivoire, a notifié aussi une tendance majoritaire (87,7%) des patients ayant un score ICH entre 0 et 2 (2). Un score ICH à 4 ou 5 a été rapporté dans deux études en Côte d’Ivoire, et aux USA (2,27). Plus le Score ICH est élevé plus le risque prédictif de mortalité est élevé (11). Dans notre cohorte, 90 % des patients ayant un score ICH à 3 étaient décédés, suivi de ceux ayant un score à 2 dont la mortalité était de 51,4%. Chez les patients ayant un score à 1, une mortalité de 31,3% a été notée, et pour ceux ayant un score à 0, la mortalité était de 12,8 %. Hemphill aux USA a rapporté un taux de mortalité à 0% et 12,5 % pour un score ICH à 0 et 1 (13). La figure 4 compare la mortalité prédite par le score ICH de Hemphill à celle observée dans notre étude. Dans notre cohorte, il a été constaté un taux de mortalité élevée pour des scores ICH bas. Plusieurs raisons pourraient expliquer cette mortalité élevée pour des scores faibles : un recours tardif (42,5% d’admission après 48h) à une structure médicale spécialisée pour la prise en charge des accidents vasculaires cérébraux et l’inexistence d’unité neurovasculaire fonctionnelle pour la prise en charge des AVC. De ce fait, on remarque que le score ICH sous-estime la prédiction de la mortalité dans notre contexte africain. En plus, Akani et al. en Côte d’Ivoire rapportaient que le score ICH ne prédisait pas correctement le risque de décès (2). Parmi les différentes composantes du score ICH, le trouble de la vigilance et le siège sous tentoriel de l’hématome étaient associés de manière statistiquement significative à la mortalité à 30 jours dans 66% et 81,8 %. Les autres facteurs indépendants du score prédictifs de la mortalité étaient : une hyperglycémie à l’admission, la présence d’engagement cérébral sous factoriel et les complications de décubitus. Les complications de décubitus étaient associées de manière statistiquement significative à la mortalité à 30 jours dans l’étude d’Akani et al. en Côte d’Ivoire (2). Ailleurs il s’agit des escarres et des pneumopathies au Togo et au Congo (4,20). Cependant, l’âge supérieur ou égal à 80 ans n’était pas associé de manière statistiquement significative à la mortalité à 30 jours. Aux USA, Taha et al. avaient fait le même constat (27). CONCLUSION L’accident vasculaire cérébral hémorragique est responsable d’une mortalité lourde. Dans notre étude, les patients ayant un score à 0, 1 et 2 avaient une mortalité élevée. Les autres facteurs indépendants du score, prédictifs de la mortalité identifiée dans notre étude étaient l’hyperglycémie à l’admission, la présence d’engagement cérébral sous falcoriel, et les complications de décubitus. La prise en charge de ces facteurs indépendants du score ICH, l’admission précoce dans une structure spécialisée et le renforcement des stratégies de préventions et des dépistages des facteurs de risques cardiovasculaires contribueront à réduire le taux de mortalité de cette pathologie.
 Figure 4 : Comparaison de la mortalité prédite dans les 30 jours selon le score ICH (13) et celle observée dans notre étude
Tableau I: Score ICH d’après Hemphill (13)
Tableau II: Caractéristiques de la population étudiée (n = 132)
Tableau III: Caractéristiques clinico-radiologiques de la population (n = 132)
Tableau IV : Répartition des patients selon les facteurs pronostiques
(*) Statistiquement significatif A CASE OF ISCHAEMIC STROKE FOLLOWING CERASTES CERASTES SNAKE BITE IN LIBYAINTRODUCTION Cerastes cerastes, also known as the horned desert viper, is a venomous species of viper native to the deserts of northern Africa and parts of the Middle East which has also been sighted in the Indian subcontinent (9,4). A handful of cases of ischaemic stroke occurring after viper envenomation have been reported in the literature (6,13,15). However, reported cases of ischaemic stroke following a C.cerastes bite are extremely few. Here we describe a case of ischaemic stroke ensuing four days after envenomation which highlights the importance of administering antivenom as soon as possible, even if the patient is initially asymptomatic, in order to reduce the risk of development of rare but significant neurological sequelae. CASE PRESENTATION A twenty-six-year-old male was admitted to our rehabilitation unit with a history of ischaemic stroke and right sided hemiplegia. Four months previously he had been working in a desert in western Libya when he was bitten on the medial aspect of his left foot by a horned desert viper. Four days later, the patient experienced sudden onset of right sided weakness with difficulty in speaking and was admitted to hospital. Brain magnetic resonance imaging (MRI) revealed ischaemia in the territory of the left middle cerebral artery (Figure 1). The patient was treated in the intensive care unit. Details of the patient’s initial investigatory findings and the treatment applied were unobtainable. The patient had no significant past medical history. On admission to our clinic, examination revealed a motor aphasia with a right sided hemiplegia. According to the Brunnstrom recovery stages (3), the motor function of the right upper extremity was stage 2, right hand stage 2 and right lower extremity stage 3. According to the modified Ashworth scale (2), there was grade two spasticity of the right elbow flexors and extensors, grade 1 spasticity of the right finger flexors and grade 2 spasticity of the ankle plantar flexors. The patient was able to walk unaided with right sided foot drop. Routine blood tests were normal. Ferritin, vitamin B12 and homocysteine levels were within the normal range. Coagulation screening including prothrombin time, fibrinogen levels, factor V, VIII, anti thrombin III, protein C and S levels were within the normal range. Active protein C resistance ratio was slightly above the normal limit at 1.24 (normal range 0.8-1.2). The patient had a borderline positive anti-nuclear antibody test (1/100 nucleolar +), and was negative for rheumatoid factor and anti-cyclic citrullinated peptide antibodies. Anti-extractable nuclear antigen antibodies (anti Sjögren syndrome A [Ro], Anti Sjögren syndrome B [La], anti-double stranded deoxyribonucleic acid, anti-Smith, anti-ribonucleoprotein) and human leukocyte antigen B27 surface antigen were also negative. Antineutrophil cytoplasmic antibody (cANCA, pANCA) titres were low and anticardiolipin IgG and IgM antibodies and lupus anticoagulant screening was negative. Following consultation with the Neurology department, colour doppler ultrasound imaging of the carotid and vertebral arteries, echocardiography (echo) and twenty-four hour Holter electrocardiogram were performed, all of which were normal. A transoesophageal echocardiogram was also performed to clearly view the posterior cardiac structures and rule out the presence of a patent foramen ovale. A brain MRI revealed findings consistent with chronic ischaemia in the territory of the left middle cerebral artery (Fig.1). A daily dose of aspirin 100 mg was commenced. The patient commenced a physical therapy program of range of motion, strengthening and stretching exercises alongside robotic gait training. DISCUSSION Taxonomically, C.cerastes belongs to the family of Viperidae and inhabits North Africa from Morocco in the northwest through Libya to Egypt in the northeast and parts of the Arabian Peninsula. Human envenomation by Viperidae resulting in haemorrhagic stroke has been widely described in the literature and is thought to occur due to disturbances in coagulation (1,16). In a study on the incidence of Bothrops Viperidae envenomation and stroke, 2.3% of bitten patients developed haemorrhagic stroke (1). However, in the same study only 0.3% of patients developed ischaemic stroke. Furthermore, only three cases of stroke following C.Cerastes Viperidae envenomation have been reported in the literature (17). Not only is ischaemic stroke following viper envenomation rare, but the onset of stroke is mostly not within the first eight hours of the bite (1). In the patient presented here, ischaemic stroke developed as long as four days after envenomation. Hypotension, endothelial injury, hypercoagulability and vasculitis have been suggested as possible mechanisms for stroke occurrence (14,15), however this topic is still under debate (7,11). In this case, the presence of large vessel infarct is more suggestive of venom induced thrombosis rather than hypotension or vasculitis. Metalloproteinases present in snake venom activate factor X and serine proteases which are prothrombin activators. Snake venom C-type lectins can also have procoagulant properties and may trigger platelet aggregation (5). Despite the onset of stroke occurring after envenomation, we must acknowledge that the detailed investigation into stroke aetiology took place four months’ post stroke. Therefore, despite the normal laboratory findings, coagulopathy and vasculitis following envenomation cannot be ruled out as possible mechanisms for stroke occurrence. In addition, even though the chronology of events suggests that the most likely cause of stroke is envenomation, as the detailed investigatory work up was delayed, and in the absence of cerebral angiography, other stroke aetiologies such as cerebral artery stenosis, transient arrhythmias and meningovasculitis cannot be ruled out (8,18,12). CONCLUSION This probable case of stroke secondary to envenomation highlights that ischaemic stroke may occur even days after a C.cerastes bite in an otherwise healthy individual and underlines the importance of early administration of antivenom. Patient education on this subject maybe considered an important public health issue in areas of Africa and Asia in which vipers and viper bites are rife. Further work into the pathophysiology of stroke onset is necessary in order to develop better drug treatment. Acknowledgment We would like to acknowledge the Baskent University Faculty of Medicine Department of Physical and Rehabilitation Medicine Authors’ consent All authors read and approved the manuscript for publication. Ethıcs approval and consent to partıcıpate Authors’ institution does not require ethical approval for publication of a single case report. Written informed consent was obtained from the patient. Consent for publıcatıon Written informed consent for publication of clinical details and images was obtained from the patient. Competıng ınterests The authors declare that they have no competing interests.
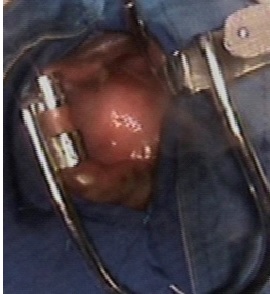
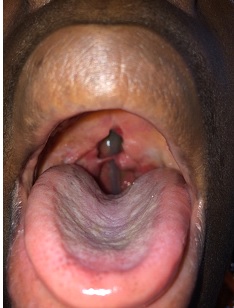
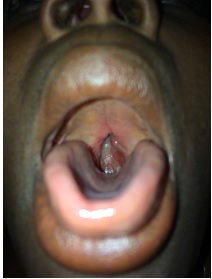
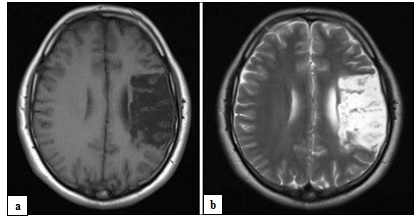 Fig. 1 T1 (a) and T2 (b) weighted magnetic resonance images of the brain showing a chronic infarct in the territory of the left middle cerebral artery INTRODUCTION Le paragangliome est une rare tumeur neuroendocrine résultant de la migration des cellules de la crête neurale associées au système nerveux autonome (10,14). Les sites sanctuaires de ces tumeurs sont la portion médullaire de la glande surrénale (phéochromocytomes), le glomus intercarotidien et le glomus jugulotympanique (14). Le paragangliome nasopharyngé fait partie des localisations rares des paragangliomes de la tête et du cou qui ne représentent eux même que 3% de l’ensemble des paragangliomes (3). L’objectif de ce travail était de présenter les aspects cliniques, radiologiques, anatomopathologiques, et thérapeutiques d’une localisation inhabituelle d’un paragangliome et de discuter de ces aspects à travers la littérature. OBSERVATION Il s’agissait d’une patiente de 39 ans, ménagère, sans antécédent médical particulier. Elle nous a été adressée par le service d’ORL pour la prise en charge d’une masse nasopharyngée s’étendant à la base du crâne. Les signes cliniques étaient faits de dyspnée d’aggravation progressive et d’épistaxis à répétition évoluant depuis 3 ans environ. L’examen général de la patiente mettait en évidence une pâleur conjonctivo-palmo-plantaire. A l’examen ORL, on notait une masse dans la fosse nasale gauche obstruant partiellement celle-ci et une tuméfaction du palais. L’examen neurologique avait objectivé une discrète paralysie faciale périphérique gauche. L’exploration de la lésion par le scanner avait mis en évidence une masse volumineuse isodense siégeant au niveau du nasopharynx obstruant partiellement les fosses nasales (figure 1A). La lésion était rehaussée après injection de produit de contraste (figure 1B). L’IRM n’a pu être réalisée en raison de difficultés d’accès à cet examen (coût élevé à la charge du patient). L’examen biologique sanguin confirmait une anémie avec un taux d’hémoglobine à 6,6g/dl. Devant les épisodes récurrents d’épistaxis et la dyspnée, l’indication d’une exérèse chirurgicale de la tumeur a été retenue après correction de l’anémie. Au vu de la localisation étendue de la lésion (pharynx s’étendant à la base du crâne et dans la fosse nasale gauche), une exérèse chirurgicale par une seule voie d’abord nous semblait difficile. Nous avons donc opté pour une exérèse par deux abords chirurgicaux. Dans un premier temps, un abord de la lésion par voie endonasale endoscopique a été retenu, ce qui a permis une exérèse de la portion endonasale et la partie supérieure de la lésion, dégageant ainsi les voies aériennes et stoppant les épisodes d’épistaxis. Dans un second temps, l’indication d’un abord direct sur le palais par voie endobuccale a été retenue pour compléter l’exérèse tumorale. Cette seconde chirurgie avait été proposée un mois après la première, le temps d’avoir une bonne cicatrisation du premier abord. La patiente, se sentant soulagée des épisodes d’épistaxis et de la dyspnée, avait souhaité attendre avant de prendre la décision de se faire réopérer, ce qui nous a amené a réalisé la seconde intervention 4 ans après la première. Cette seconde intervention a permis une exérèse partielle de la partie inférieure de la tumeur (figure 2). Il s’agissait d’une lésion dure et très hémorragique. Les suites opératoires ont été marquées par une déhiscence de la plaie opératoire (figure 3) nous amenant à faire une troisième intervention pour la fermeture de la plaie un mois après la deuxième chirurgie. Les suites de cette dernière intervention ont été simples (figure 4). La pièce opératoire, issue de la première chirurgie, avait été envoyée pour examen anatomopathologique au laboratoire BIOMNIS de Lyon à travers le laboratoire RODOLPHE MERIEUX de Bamako. Cet examen a mis en évidence une muqueuse nasopharyngée polypoïde revêtue d’un éphithélium malpighien sans atypie cellulaire. Les mitoses étaient rares. Les cytoplasmes étaient peu abondants, mal limités, éosinophiles ou clairs (figure 5). L’étude immunohistochimique a conclu à une localisation d’un paragangliome sans caractère patent de malignité. La patiente a ensuite été adressée en radiothérapie pour une irradiation complémentaire. Le protocole consistait à envoyer quotidiennement une dose de 2 gray sur le site tumoral jusqu’à atteindre 70 gray (35 séances au total). Suite à l’apparition d’effets secondaires faits d’ulcérations buccales et d’une agueusie, la patiente a arrêté la radiothérapie à 29 séances. Après une année de recul, l’évolution clinique et radiologique était satisfaisante. (Figure 6). DISCUSSION Les paragangliomes de la tête et du cou sont très rares. Ils représentent 0,012% de l’ensemble des tumeurs humaines, 0,6% des tumeurs de la tête et du cou et 3% de tous les paraglangliomes (9, 12). Peltier et collaborateurs ont décrit un cas de paragangliome du sinus caverneux en 2007 à Amiens (14). Ces tumeurs ont une localisation unique dans leur majorité mais dans 10% des cas, ils sont multiples (3,9,16). Les paragangliomes peuvent être sporadiques ou familiaux. Dans 10 à 50%, elles sont d’origine familiale (13). La grande majorité des cas rapportés sont bénins, la malignité est plus fréquente dans les tumeurs sporadiques que dans les tumeurs familiales (6,12). Ce sont des tumeurs richement vascularisées, avec une croissance lente et une possibilité d’infiltration des structures vasculaires, nerveuses et osseuses avoisinantes (1,5,7). Dans 1 à 3 % des cas, ces tumeurs secrètent des catécholamines (14). La grande majorité des paragangliomes du système nerveux se présente comme des tumeurs intradurales de la queue de cheval. Les sites anecdotiques intracrâniens sont le sinus caverneux, le cavum trigéminal de Meckel, la selle turcique, l’épiphyse, la pyramide pétreuse et l’angle pontocérébelleux (10,14,16). Les paragangliomes sont non douloureux en eux même. Leurs manifestations cliniques sont diverses et dépendent de leur topographie et de leur extension locale (3). Les localisations au niveau de la carotide interne peuvent entrainer une sténose carotidienne pouvant aboutir à un accident vasculaire cérébral ischémique. Ceux siégeant au niveau de la base du crâne sont pourvoyeurs d’atteinte de nerfs crâniens. Chez notre patiente, on notait une discrète paralysie faciale périphérique liée à l’extension de la lésion vers la base du crâne. On peut occasionnellement observer des signes en rapport avec la sécrétion de catécholamines comme l’hypertension artérielle, la palpitation et la diarrhée (16). Les présentations par des épisodes d’épistaxis sont très rares (11), même si ce signe a été le maître symptôme chez notre patiente à cause de la localisation nasopharyngée de la tumeur. L’évaluation préopératoire de ces tumeurs est basée sur le scanner et l’IRM. Le scanner permet d’objectiver l’érosion osseuse et met en évidence une importante prise de contraste de la lésion après injection (4,8). A l’IRM, le paragangliome apparaît homogène, isointense en T1 et hyperintense en T2 avec une apparence peu homogène décrite « sel et poivre » (3,4,14). L’artériographie peut montrer un « blush » tumoral ou une tumeur paucivascularisée (14,16). La localisation nasopharyngée du paragangliome peut simuler d’autres tumeurs qui se développent dans la même région anatomique, et qui se manifestent par des signes cliniques communs comme une épistaxis et une obstruction nasale (12). On peut citer le polype inflammatoire nasosinusien, l’hémangiome capillaire lobulaire, l’hémangiome caverneux de la région naso-sinusienne et pharyngée, l’angiofibrome nasopharyngé. La présentation du paragangliome sous l’aspect de « sel et poivre » à l’IRM peut aider à établir le diagnostic (3,14). Chez la patiente que nous avons prise en charge, nous nous sommes limités au scanner pour l’exploration de la lésion à cause d’une accessibilité moindre des patients à l’IRM dans notre pays. Le scanner, bien qu’il ne donne pas de signes spécifiques de paragangliome, avait permis d’avoir des signes d’orientation sur le diagnostic. Il avait montré une lésion isodense avec une importante prise de contraste sur les coupes injectées. La présence de récepteurs à somatostatine au niveau des paragangliomes a été récemment utilisée dans le diagnostic en scintigraphie. Les agents radioactifs utilisés comme le pentetreotide ont une sensibilité pouvant aller jusqu’à 90%, mais sont moins spécifiques en raison de la présence des mêmes récepteurs au niveau d’autres tumeurs neuroendocrines (3). Au plan de l’histologie, ce sont des tumeurs à caractère endocrine avec des caractéristiques immunohistochimiques particulières. Elles expriment les marqueurs des tumeurs neuroendocrines comme la synaptophysine, la chromogranine. Elles n’expriment pas les marqueurs des tumeurs épithéliales (1,12). La majorité des paragangliomes de la tête et du cou sont bénins, par conséquent, traités par chirurgie seule sans radiothérapie (3,12,16). En plus des voies endonasale et endobuccale par lesquelles nous sommes passés pour l’exérèse de la tumeur chez notre patiente, les voies transfaciales ont également été décrites pour l’abord des tumeurs nasopharyngées (3). La radiothérapie n’est indiquée que chez une catégorie de patients, ou en post opératoire. Elle semble être une alternative utile en cas de lésions non résécables, chez les patients présentant un risque anesthésique élevé, les patients atteints d’un paragangliome avec signes de malignité, et enfin en complément de la chirurgie en cas de résection incomplète (4,12,16,15). Dans notre cas, elle a été indiquée en complément de la chirurgie devant la résection incomplète de la tumeur. Le taux de récidive après exérèse complète est estimé dans la littérature entre 1 et 4 % (10, 2). Une radiothérapie complémentaire en cas de résection incomplète donnerait d’excellents résultats avec un taux de contrôle local pouvant aller jusqu’à 100% (12,16,15). L’embolisation est indiquée en préopératoire pour les tumeurs volumineuses. Elle permet de diminuer ainsi le saignement per opératoire (12). CONCLUSION La localisation nasopharyngée des paragangliomes est très rare. L’imagerie permet de donner des signes d’orientation, mais le diagnostic est basé sur l’immunohistochimie. La chirurgie assure la guérison si la résection est complète. La radiothérapie garde ses indications si la chirurgie est impossible ou lorsque la résection est incomplète. 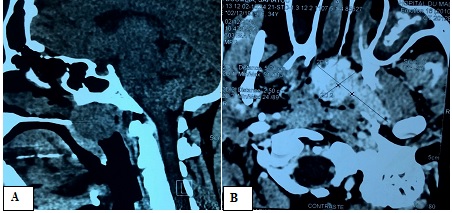 Figure 1 : (A) Masse nasopharyngée isodense obstruant les fosses au scanner non injecté. (B) Masse nasopharyngée s’étendant à la base du crâne prenant le contraste au scanner injecté
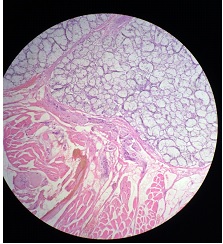 Figure 5 : Images anatomopathologiques de la pièce opératoire mettant en évidence une muqueuse nasopharyngée polypoïde sans atypie cellulaire. Coloration à l’hématoxine et à l’éosine × 200.
Articles récents
Commentaires récents
Archives
CatégoriesMéta |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2002-2018 African Journal of Neurological Sciences.
All rights reserved. Terms of use.
Tous droits réservés. Termes d'Utilisation.
ISSN: 1992-2647